链格孢侵染采后甜瓜病程相关蛋白基因表达及酶活性变化规律
王 瑾,白羽嘉,2,,冯作山,朱婉彤,曾禹睿慷,蒋莉莹
(1.新疆农业大学食品科学与药学学院,新疆果品采后科学与技术重点实验室,新疆 乌鲁木齐 830052;2.新疆农业大学作物学博士后科研流动站,新疆 乌鲁木齐 830052)
厚皮甜瓜(Cucumis meloL.)是一年生蔓性草本植物,是西北地区效益较好的一种经济作物[1]。伽师瓜是新疆特有的晚熟型厚皮甜瓜品种,耐贮藏[2]。86-1甜瓜为中晚熟厚皮甜瓜,贮藏性一般。两种甜瓜肉质松脆,甘甜爽口,果肉颜色相近,呈橘红色。果皮存在较大差异,伽师瓜果皮呈墨绿色,表面致密,无网纹或两端覆少网纹;86-1甜瓜果皮呈黄色夹杂绿色,通体布有网纹。
真菌病原菌是引起我国甜瓜腐烂的主要原因[3-4]。其中链格孢是采后甜瓜贮藏期间的优势致病菌,引起甜瓜黑斑病[5],甜瓜感染链格孢后,果实初期呈水渍状湿腐,果面变软腐烂,后在烂果表面产生大量黑霉,即病菌分生孢子梗和分生孢子,最终导致采后甜瓜腐烂变质[6-7]。真菌细胞壁以几丁质、纤维素为骨架,以β-1,3葡聚糖及蛋白质为主要填充物,保持真菌细胞壁的结构完整性[8-9]。病原菌侵染后,植物细胞分泌几丁质酶(chitinase,CHT)和β-1,3-葡聚糖酶(β-1,3-glucanase,GLU)消化真菌细胞壁中的几丁质和β-1,3-葡聚糖,破坏并裂解真菌细胞壁骨架,影响其形态建成、生长发育和致病力等[10]。目前,研究人员对甜瓜病程相关蛋白基因的研究仅针对于甜瓜果肉,如研究采后链格孢侵染甜瓜果肉CHT和GLU基因的变化规律[11-12];对果皮的研究多集中在CHT、GLU活性,如研究采后损伤接种链格孢菌,甜瓜果皮和果肉CHT、GLU活性变化规律[13-14],对甜瓜果皮和果肉CHT、GLU基因和酶活综合性研究鲜见报道。而果皮是甜瓜抵御病原菌侵染的第一道防线,也是最重要的物理抗病结构[15],具有重要的研究价值。
本研究以伽师瓜和86-1甜瓜为材料,损伤接种链格孢,测定病斑直径,观察病斑组织显微结构,实时聚合酶链式反应(real-time polymerase chain reaction,realtime PCR)比较CmGLU、CmCHT1、CmCHT2相对表达量,测定CHT和GLU活性。研究链格孢侵染采后伽师瓜和86-1甜瓜果皮和果肉组织的抗病性差异,旨在为甜瓜采后贮藏保鲜提供一定的理论依据。
1 材料与方法
1.1 材料与试剂
伽师瓜、86-1甜瓜采摘自新疆喀什地区伽师县,伽师瓜单果质量(4.12±0.55)kg,边缘可溶性固形物>12 °Brix,86-1甜瓜单果质量(3.5±0.5)kg,边缘可溶性固形物>12 °Brix。
链格孢菌:从自然发病的伽师瓜果实分离,马铃薯葡萄糖琼脂培养基(potato dextrose agar,PDA)保存。
30% H2O2、3,5-二硝基水杨酸、丙酮、冰乙酸、结晶酚、酒石酸钾钠、L-抗坏血酸、浓盐酸、氢氧化钠、无水乙醇、无水乙酸钠、五水合四硼酸钾 、亚硫酸钠(均为分析纯) 天津市致远化学试剂有限公司;二甲苯、中性树胶(均为分析纯) 国药集团化学试剂有限公司;几丁质、昆布多糖(均为分析纯) 美国西格玛奥德里奇公司;焦碳酸二乙酯(diethypyrocarbonate,DEPC)、乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)、脱盐蜗牛酶、β-巯基乙醇、琼脂糖生工生物工程(上海)股份有限公司;PDA培养基北京奥博星生物技术有限责任公司;六铵银染液 武汉谷歌生物科技有限公司;Trans2K DNA Marker、TransZol北京全式金生物技术有限公司;5×All-In-One Master Mix(with Accu RT Genomic DNA Removal Kit)、EvaGreen 2×qPCR Master Mix-Low ROX 加拿大ABM公司。
1.2 仪器与设备
MyCycler Thermal Cycler型PCR仪 美国Bio-Rad公司;QuantStudioTM6 Flex real-time PCR Syste 美国ABI公司;Nefuqe 15R型高速冷冻离心机 上海力申科学仪器有限公司;TGL-16G型高速冷冻离心机 上海安亭科学仪器厂;DYCZ-21型电泳槽、DYY-6C型电泳仪电源北京市六一仪器厂;2500型凝胶成像系统 上海天能科技有限公司;K5500型核酸蛋白定量仪 北京凯奥科技发展有限公司;ME204型电子天平、FE20型pH计上海梅特勒-托利多仪器有限公司;XHF-DY型高速分散器宁波新芝生物科技股份有限公司;TU-1810紫外-可见分光光度计 北京普析通用公司;RM2016型病理切片机上海徕卡仪器有限公司;DS-U3成像系统 日本尼康公司。
1.3 方法
1.3.1 甜瓜预处理
甜瓜表面用2% H2O2溶液浸泡杀菌,晾干待用[16]。
1.3.2 链格孢侵染
沿甜瓜果实赤道等距穿刺打孔(直径3.5 mm,深度5 mm),每孔接入链格孢孢子悬浮液20 μL(1×106spores/mL,含0.01%吐温-20)[17],对照组接入等量无菌水,(7±1)℃、相对湿度85%~90%冷库贮藏。
1.3.3 取样
处理后第0、3、6、9、12、15、18、21、24、27、30天取样。随机选择6 个甜瓜,测量病斑大小(包括过敏反应组织)[18],取发病与健康组织交界5 mm处果皮和果肉组织,液氮速冻,-80 ℃保存。
处理后第0、6、9、21、30天各取1 个甜瓜随机选择3 处病斑,取发病与健康组织交界处果皮和果肉组织(10 mm×10 mm),甲醛-乙酸-乙醇(formaldehyde-acetic acid-ethanol fixative,FAA)固定液固定,4 ℃保存。
1.3.4 组织切片显微结构观察
采用过碘酸六胺银(periodic acid-silver metheramine,PASM)染色法。FAA固定液中取出甜瓜组织→修整→脱水→石蜡包埋→切片→脱蜡→高碘酸染色→蒸馏水冲洗→六胺银染色液孵育染色→硫代硫酸钠处理→蒸馏水冲洗→复染伊红→脱水→中性树胶封片→全自动数字玻片扫描系统(Pannoramic DESK)获取图像文件→Caseviewer(C.V 2.3)软件分析。
1.3.5 链格孢侵染采后甜瓜病程相关蛋白基因表达变化分析
1.3.5.1 real-time PCR引物设计
CmCHT1-F/R参考甜瓜CHT基因序列(MG823396、MG823397、MELO3C023247T1),CmCHT2-F/R参考甜瓜CHT基因序列(MG823398;MG823399、MELO3C006069T1),CmGLU-F/R参考甜瓜GLU基因序列(MG823400、MG823402、MELO3C022133T1),内参基因CmGAPDH-F/R参考甜瓜甘油醛-3-磷酸脱氢酶(GAPDH)基因序列(XM_008441195.2)。引物信息见表1。

表1 荧光定量mRNA检测引物信息Table 1 Primer sequences used for quantitative fluorescent PCR
1.3.5.2 总RNA的提取
甜瓜组织液氮研磨,总RNA提取试剂盒(TransZol,ET101)提取总RNA。核酸蛋白定量仪检测RNA浓度,琼脂糖电泳检测RNA完整性。
1.3.5.3 检测mRNA的cDNA合成
使用5×All-In-One MasterMix(with AccuRT Genomic DNA Removal Kit)反转录试剂盒合成cDNA。总RNA 1 mg、Random Primer(0.1 μg/μL)1 μL、2×TS Reaction Mix 10 μL、TransScript®RT/RI Enzyme Mix 1 μL、gDNA Remover 1 μL、RNase-Free Water补足至20 μL。混匀,25 ℃反应10 min,42 ℃反应30 min,85 ℃反应5 s取出,结束反转录实验。将反转录得到的cDNA置于-80 ℃保存。
1.3.5.4 real-time PCR条件
real-time PCR体系:2×SYBR Green Select Mix 5 μL、Forward Primer 0.7 μL、Reverse Primer 0.7 μL、ROX 0.05 μL、cDNA 1 μL,RNase-Free Water补足至10 μL,轻轻混匀。95 ℃反应2 min;95 ℃反应15 s,60 ℃反应30 s(40 个循环)。以CmGAPDH为内参基因,用2-ΔΔCt法计算甜瓜不同时间内CmCHT1、CmCHT2、CmGLU的相对表达量。
1.3.6 CHT和GLU活性的测定
参照文献[19]进行测定。
1.4 数据处理
采用IBM SPSS Statistics 23.0进行数据分析,采用最小显著性差异法多重比较进行差异显著性分析(P<0.05,差异显著),Origin 2018软件进行绘图。
2 结果与分析
2.1 链格孢侵染甜瓜果实病斑发生规律
链格孢菌侵染采后伽师瓜和86-1甜瓜果实,86-1甜瓜第6天时出现病斑,伽师瓜第9天时出现病斑,病斑直径随贮藏时间呈不断扩大的趋势(图1),且86-1甜瓜病斑直径始终大于伽师瓜。第30天时,86-1甜瓜果皮和果肉病斑直径是伽师瓜的1.28 倍和1.29 倍,差异显著(P<0.05)。表明伽师瓜抵抗链格孢侵染的能力高于86-1甜瓜。

图1 链格孢侵染甜瓜果实病斑直径变化趋势Fig.1 Change in lesion diameter in two melon cultivars after infection by Alternaria alternata
链格孢菌侵染甜瓜果实,果皮及果肉组织病斑直径存在差异,果肉病斑直径始终大于果皮。侵染第30天时,伽师瓜果肉和果皮病斑直径分别为2.50 cm和2.21 cm,86-1甜瓜果肉和果皮病斑直径分别为3.20 cm和2.86 cm,差异显著(P<0.05)。表明甜瓜果皮抗病能力高于果肉。
链格孢侵染甜瓜果实阶段,研究发现接种深度5 mm,接种量20 μL,侵染9 d出现病斑;侵染15~30 d病斑直径几乎呈线性扩大。根据病斑出现时间和大小,确定0~9 d为侵染潜伏期,6~15 d为侵染初期,15~24 d为侵染中期,24~30 d(>30 d)为侵染末期。
2.2 链格孢侵染对伽师瓜和86-1甜瓜果实组织切片观察
选择侵染发生的关键时期(包括未侵染0 d、侵染初期6 d/9 d、侵染中期21 d、侵染末期30 d)的组织样品,进行PASM染色,观察病斑及周围组织显微结构,了解真菌菌丝的侵入情况。

图3 链格孢侵染甜瓜果肉PASM染色(×200)Fig.3 PASM staining of muskmelon pulp after infection by A.alternata (× 200)
链格孢侵染甜瓜显微结构观察(图2、3),伽师瓜和86-1甜瓜在0 d果皮和果肉组织切片结构完整,没有被侵染的现象;伽师瓜和86-1甜瓜侵染9 d和6 d出现病斑,此时病斑为组织过敏反应,呈轻微水渍状湿腐,但细胞结构基本完整,没有观察到菌丝;侵染21 d,伽师瓜和86-1甜瓜的病斑直径分别为1.76、2.26 cm,病斑周围组织结构被明显破坏,存在明显的菌丝侵入,并存在少量孢子,细胞形态遭到破坏,部分细胞壁出现空泡现象,果肉细胞菌丝入侵现象较为严重,86-1甜瓜比伽师瓜情况严重;侵染30 d,伽师瓜和86-1甜瓜的病斑直径分别为2.50、3.20 cm。细胞结构被严重破坏,细胞壁出现分层、皱缩现象,大量菌丝侵入,并存在大量孢子,孢子萌发成菌丝,再次产生孢子,重复着侵染过程。病斑周围部分未出现肉眼可见病斑的果肉组织(图4),其细胞结构完整,形态饱满,但实际上已被链格孢侵入。

图2 链格孢侵染甜瓜果皮PASM染色(×200)Fig.2 PASM staining of muskmelon peel after infection by A.alternata (× 200)

图4 链格孢侵染两种甜瓜第30天时非病斑果肉PASM染色(×200)Fig.4 PASM staining of non-lesion muskmelon pulp on day 30 after infection by A.alternata (× 200)
链格孢侵入甜瓜后,通过显微结构观察伽师瓜和86-1甜瓜病斑组织,发现果皮和果肉组织的细胞结构都遭到了不同程度的破坏,通过细胞壁增厚抵御链格孢侵染,果肉组织细胞壁抵抗能力较弱,侵染末期果皮与果肉组织细胞壁分层、皱缩,细胞内侵入大量菌丝体和分生孢子,果肉组织细胞部分解体,无法辨认细胞结构。
2.3 电泳检测结果
电泳检测CmCHT1、CmCHT2、CmGLU和CmGAPDH的PCR产物片段大小,片段大小符合检测基因的片段长度,条带单一(图5)。
图5 real-time PCR扩增结果Fig.5 Real-time quantitative PCR pattern
2.4 链格孢侵染对伽师瓜和86-1甜瓜CmCHT1相对表达量的变化
链格孢侵染采后伽师瓜和86-1甜瓜,果皮CmCHT1相对表达量随贮藏时间呈升高-降低的变化趋势(图6A)。伽师瓜果皮CmCHT1相对表达量始终高于86-1甜瓜,接种组始终高于对照组。潜伏期至侵染初期(0~15 d)伽师瓜和86-1甜瓜果皮CmCHT1相对表达量呈升高趋势,侵染中期(15~24 d)伽师瓜和86-1甜瓜果皮CmCHT1相对表达量在第15天和第18天最高,分别为7.20和4.18,是其对照组的3.85 倍和3.51 倍,伽师瓜是86-1甜瓜的1.72 倍,差异显著(P<0.05);侵染末期(24~30 d)伽师瓜和86-1甜瓜果皮CmCHT1相对表达量降低,第30天CmCHT1相对表达量分别是2.47和2.11,是峰值的34%和51%。
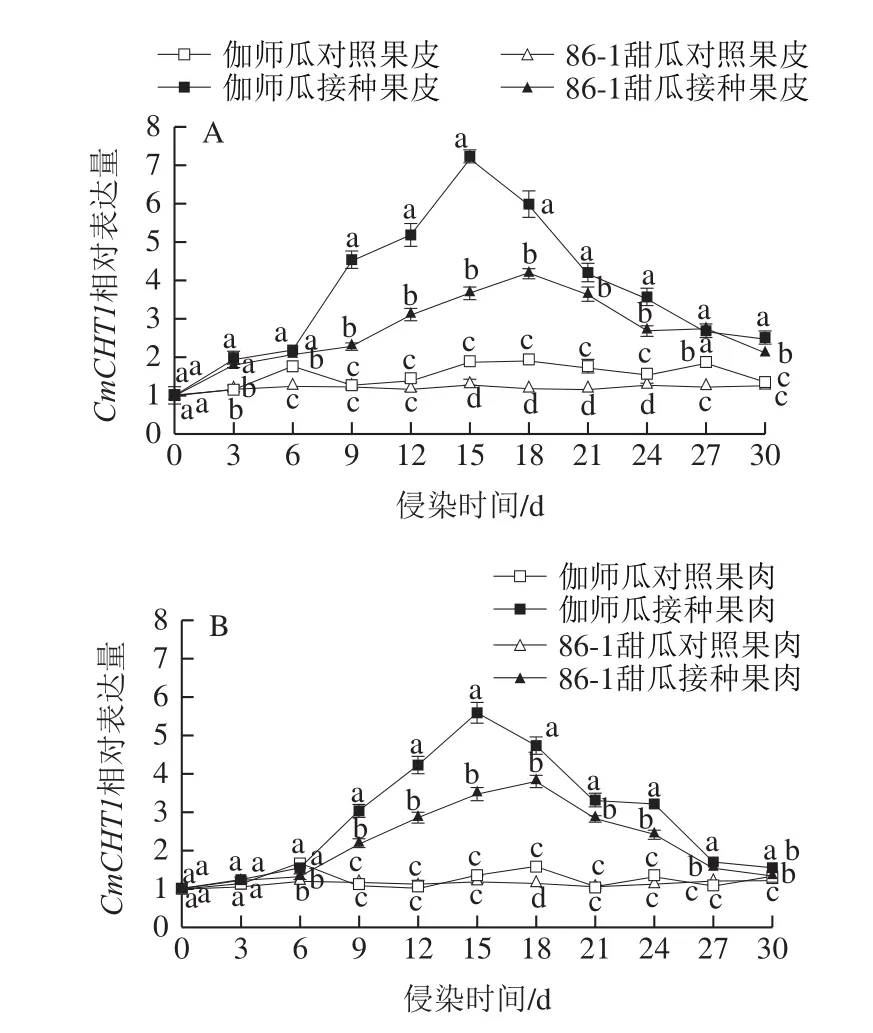
图6 链格孢侵染甜瓜果皮(A)和果肉(B)CmCHT1相对表达量变化Fig.6 Relative expression of CmCHT1 in melon peel (A) and pulp (B)infected by A.alternata
链格孢侵染采后伽师瓜和86-1甜瓜,果肉CmCHT1相对表达量随贮藏时间呈升高-降低的变化趋势(图6B)。伽师瓜果肉CmCHT1相对表达量始终高于86-1甜瓜,接种组始终高于对照组。潜伏期(0~6 d)伽师瓜和86-1甜瓜果肉CmCHT1相对表达量缓慢升高,与对照组差异不显著(P>0.05);侵染初期(9~15 d),伽师瓜和86-1甜瓜CmCHT1相对表达量迅速升高,伽师瓜CmCHT1相对表达量在第15天出现峰值为5.60,是对照组的4.17 倍,差异显著(P<0.05);侵染中期(15~24 d),86-1甜瓜CmCHT1相对表达量在第18天出现峰值为3.80,是对照组的3.32 倍,伽师瓜峰值是86-1甜瓜的1.47 倍;侵染末期(24~30 d),伽师瓜和86-1甜瓜果肉CmCHT1相对表达量降低,30 dCmCHT1相对表达量分别为1.56和1.33,是峰值的28.00%和35.00%。
链格孢侵染采后伽师瓜和86-1甜瓜,两种甜瓜果皮组织CmCHT1相对表达量均高于果肉组织,接种组高于对照组。
2.5 链格孢侵染对伽师瓜和86-1甜瓜CmCHT2相对表达量的变化
链格孢侵染采后伽师瓜和86-1甜瓜,果皮CmCHT2相对表达量随贮藏时间呈升高-降低的变化趋势(图7A)。伽师瓜果皮CmCHT2相对表达量始终高于86-1甜瓜,接种组始终高于对照组。潜伏期(0~6 d),伽师瓜和86-1甜瓜果皮CmCHT2相对表达量缓慢升高;侵染初期(9~15 d),伽师瓜和86-1甜瓜果皮CmCHT2相对表达量迅速升高,在第15天出现峰值,分别为5.19和3.67,是对照组的3.46 倍和2.83 倍,差异显著(P<0.05),伽师瓜是86-1甜瓜的1.41 倍;侵染中期(15~24 d)和侵染末期(24~30 d),伽师瓜和86-1甜瓜果皮CmCHT2相对表达量迅速降低,第30天CmCHT2相对表达量分别为1.86和1.27,是峰值的36%和35%。
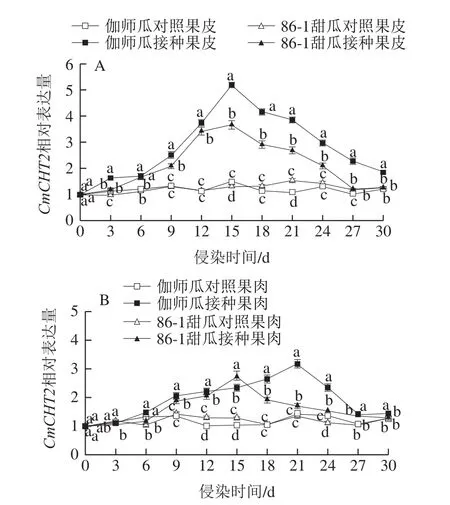
图7 链格孢侵染甜瓜果皮(A)和果肉(B)CmCHT2相对表达量变化Fig.7 Relative expression of CmCHT2 in melon peel (A) and pulp (B)infected by A.alternata
链格孢侵染采后伽师瓜和86-1甜瓜,果肉CmCHT2相对表达量随贮藏时间呈升高-降低的变化趋势(图7B)。伽师瓜果肉CmCHT2相对表达量始终高于86-1甜瓜(第15天除外),接种组始终高于对照组。潜伏期(0~6 d)伽师瓜和86-1甜瓜果肉CmCHT2相对表达量缓慢升高,与对照组差异不显著(P>0.05);侵染初期(9~15 d),伽师瓜和86-1甜瓜果肉CmCHT2相对表达量持续升高,86-1甜瓜果肉在第15天出现峰值为2.71,是对照组的2.71 倍;侵染中期(15~24 d),伽师瓜果肉在第21天出现峰值为3.18,是对照组的2.23 倍,伽师瓜峰值是86-1甜瓜的1.17 倍;侵染末期(24~30 d),伽师瓜和86-1甜瓜果肉CmCHT2相对表达量持续降低,30 dCmCHT2相对表达量分别是1.44和1.35,是峰值的45%和48%。
链格孢侵染采后伽师瓜和86-1甜瓜,两种甜瓜果皮组织CmCHT2相对表达量均高于果肉组织,接种组高于对照组。CmCHT1相对表达量在侵染初期至侵染中期较高,CmCHT2相对表达量在侵染中期表达量较高,表明病原菌在侵染初期至侵染中期诱导了CHT基因的表达。
2.6 链格孢侵染对伽师瓜和86-1甜瓜CmGLU相对表达量的变化
链格孢侵染采后伽师瓜和86-1甜瓜,果皮CmGLU相对表达量随贮藏时间呈升高-降低的变化趋势(图8A)。伽师瓜果皮CmGLU相对表达量始终高于86-1甜瓜,接种组始终高于对照组。潜伏期(0~6 d)伽师瓜和86-1甜瓜果皮CmGLU相对表达量缓慢升高;侵染初期(9~15 d)伽师瓜和86-1甜瓜果皮CmGLU相对表达量在第15天迅速升高,分别是其对照组的3.77 倍和2.71 倍,差异显著(P<0.05);侵染中期(15~24 d)伽师瓜和86-1甜瓜果皮CmGLU相对表达量在第18天和第21天最高,分别为5.77和4.47,分别是对照组的4.52 倍和3.60 倍,伽师瓜是86-1甜瓜的1.29 倍;侵染末期(24~30 d)伽师瓜和86-1甜瓜果皮CmGLU相对表达量降低,第30天CmGLU相对表达量分别为2.83和2.37,是峰值的49%和53%。
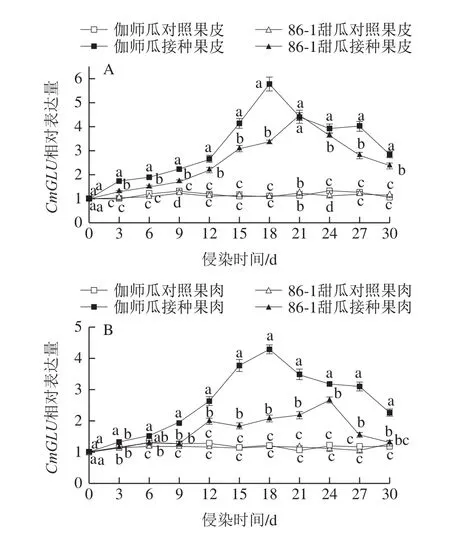
图8 链格孢侵染甜瓜果皮(A)和果肉(B)CmGLU相对表达量变化Fig.8 Relative expression of CmGLU in melon peel (A) and pulp (B)infected by A.alternata
链格孢侵染采后伽师瓜和86-1甜瓜,果肉CmGLU相对表达量随贮藏时间呈升高-降低的变化趋势(图8B)。伽师瓜果肉CmGLU相对表达量始终高于86-1甜瓜,接种组始终高于对照组,差异显著(P<0.05)。潜伏期(0~6 d)伽师瓜和86-1甜瓜果肉CmGLU相对表达量缓慢升高;侵染初期(9~15 d),伽师瓜和86-1甜瓜果肉CmGLU相对表达量持续升高;侵染中期(15~24 d),伽师瓜和86-1甜瓜果肉CmGLU相对表达量在第18天和第24天出现峰值,分别为4.29和2.68,是对照组的3.49 倍和2.37 倍;侵染末期(24~30 d)伽师瓜和86-1甜瓜果肉CmGLU相对表达量降低,第30天时CmGLU相对表达量分别为2.27和1.32,是最高峰值的53%和49%。
链格孢侵染采后伽师瓜和86-1甜瓜,两种甜瓜果皮组织CmGLU相对表达量均高于果肉组织,接种组高于对照组。CmGLU相对表达量在侵染中期至侵染后期表达量较高,表明病原菌在侵染中期至侵染末期诱导了GLU基因的表达。
2.7 链格孢侵染伽师瓜和86-1甜瓜CHT活性的变化
链格孢侵染采后伽师瓜和86-1甜瓜,果皮CHT活性随贮藏时间呈升高-降低的变化趋势(图9A),伽师瓜果皮CHT活性始终高于86-1甜瓜,接种组始终高于对照组,差异显著(P<0.05)。侵染中期(15~24 d)伽师瓜和86-1甜瓜分别于第18天和第21天出现CHT活性峰值,分别为166.65 U和89.49 U,是其对照组的2.23 倍和2.86 倍,差异显著(P<0.05)。
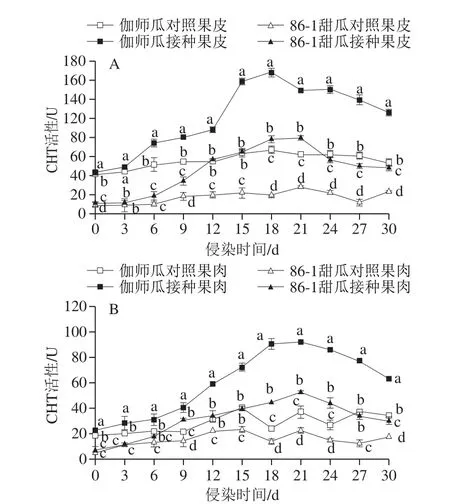
图9 链格孢侵染甜瓜果皮(A)和果肉(B)CHT活性变化规律Fig.9 Changes in CHT activity in melon peel (A) and pulp (B) infected by A.alternaria
链格孢侵染采后伽师瓜和86-1甜瓜,果肉CHT活性随贮藏时间呈升高-降低的变化趋势(图9B),伽师瓜果肉CHT活性始终高于86-1甜瓜,接种组始终高于对照组,差异显著(P<0.05)。侵染中期(15~24 d)伽师瓜和86-1甜瓜果肉CHT活性持续升高,第21天出现活性峰值,分别为92.46 U和53.10 U,是其对照组的2.48 倍和2.34 倍,差异显著(P<0.05)。
链格孢侵染采后伽师瓜,果皮组织CHT活性高于果肉,接种组高于对照组,差异显著(P<0.05)。侵染中期(15~24 d)果皮和果肉组织在第18天和第21天出现活性峰值,果皮是果肉组织活性峰值的1.80 倍,差异显著(P<0.05)。链格孢侵染采后86-1甜瓜,果皮组织CHT活性高于果肉,接种组高于对照组,差异显著(P<0.05)。侵染中期(15~24 d),果皮和果肉组织CHT活性在第21天出现峰值,果皮是果肉组织的1.69 倍,差异显著(P<0.05)。
2.8 链格孢侵染甜瓜果实GLU活性变化规律
链格孢侵染采后伽师瓜和86-1甜瓜,果皮GLU活性随贮藏时间呈升高-降低的变化趋势(图10A)。伽师瓜果皮GLU活性始终高于86-1甜瓜,接种组始终高于对照组,差异显著(P<0.05)。侵染中期(15~24 d),伽师瓜和86-1甜瓜于第18天和第21天出现GLU活性峰值27.73 U和14.73 U,是对照组的2.89 倍和2.86 倍,差异显著(P<0.05)。
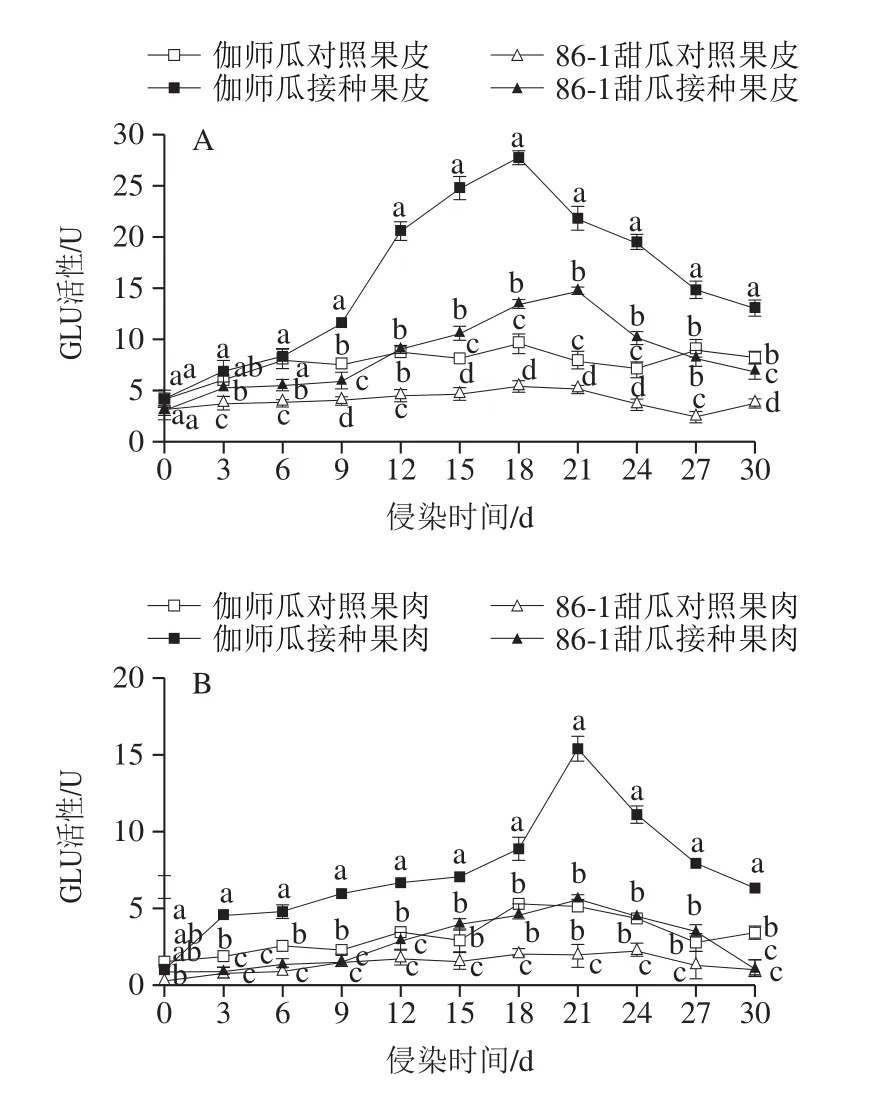
图10 链格孢侵染甜瓜果皮(A)和果肉(B)GLU活性变化规律Fig.10 Changes in GLU activity in melon peel (A) and pulp (B)infected by A.alternata
链格孢侵染采后伽师瓜和86-1甜瓜,果肉GLU活性随贮藏时间呈升高-降低的变化趋势(图10B)。伽师瓜果肉GLU活性始终高于86-1甜瓜,接种组始终高于对照组,差异显著(P<0.05)。潜伏期(0~6 d)果肉GLU活性缓慢升高,伽师瓜与对照组差异显著(P<0.05),86-1甜瓜与对照组差异不显著(P>0.05);侵染中期(15~24 d),伽师瓜和86-1甜瓜果肉GLU活性持续升高,第21天出现活性峰值分别为15.35 U和5.58 U,是对照组的2.98 倍和2.85 倍,差异显著(P<0.05)。
链格孢侵染采后伽师瓜,果皮组织GLU活性高于果肉,接种组高于对照组,差异显著(P<0.05)。侵染中期(15~24 d),果皮和果肉组织分别在第18天和第21天出现活性峰值,果皮是果肉组织活性峰值的1.76 倍,差异显著(P<0.05)。链格孢侵染采后86-1甜瓜,果皮组织GLU活性高于果肉,接种组高于对照组,差异显著(P<0.05)。侵染中期(15~24 d)果皮和果肉组织GLU活性在第21天出现活性峰值,果皮是果肉组织的2.64 倍,差异显著(P<0.05)。说明与86-1甜瓜相比,伽师瓜能更迅速启动防御反应。
3 讨 论
链格孢菌为卵形或椭圆形分生孢子,一些有细的浅棕色喙,单孢子培养物会产生黑褐色[20]。研究发现,采后自然发病(黑斑病:链格孢侵染)的甜瓜果实表皮褐色,有稍凹陷的圆斑,外有淡褐色晕环,有的内生轮纹,病斑呈黑褐色至黑色的霉状物,果肉坏死,黑色,海绵状,与健肉易分离[21]。本研究伽师瓜和86-1甜瓜病斑组织发病规律与其相似。本研究链格孢侵染采后甜瓜,伽师瓜病斑直径小于86-1甜瓜,果皮病斑直径小于果肉,说明较86-1甜瓜而言,伽师瓜具有更强的抵御链格孢侵染的能力,果皮比果肉组织具有更高的抗菌能力,与链格孢侵染对厚皮甜瓜抗菌物质及活性氧代谢相关酶活性研究结果相似[22-23]。
细胞壁是植物病原真菌进入寄主植物并与之直接接触的先锋结构[24]。通过病斑组织显微结构观察,发现链格孢侵染甜瓜中后期,果皮细胞壁增厚,果肉细胞壁部分解体,而与病斑组织交界处的果肉组织未出现肉眼可见病斑,但实际上已被链格孢分生孢子梗和分生孢子侵入。采后甜瓜果实一旦发生了黑斑病(链格孢侵染),病原菌会借助果实充足的营养环境,慢慢延伸扩散,导致霉菌毒素的积累,即使肉眼观察看似未被感染,但病菌毒素已扩散,从而导致其致病性和毒力[25]。研究发现,链格孢毒素在温州蜜橘果实中日益积累,除了在病斑周围,在非病斑部位也能检测出[26]。表明看似健康正常的果肉,也存在严重的食品安全风险,在鲜食和加工过程中削去了霉烂部分,菌丝极有可能已经侵入果实的内部。
植物通过细胞表面受体识别“植物-病原菌”相关分子模式并启动防卫反应[27-28],抵抗病原菌的侵入与扩展[29]。在正常情况下,植物体内的CHT和GLU基因以低水平表达,但在病原菌侵染、诱导物刺激及各种伤害下可诱导植物CHT和GLU基因表达,引起病原菌菌丝裂解表现出抗病性[10]。研究表明,霜霉病菌接种处理显著诱导了CHT基因在大白菜抗病品种中的表达[30],哈密瓜受到青霉菌侵染后,CHT基因在侵染前期发挥积极作用[31]。在本研究中,与对照组比较,受到链格孢侵染的伽师瓜和86-1甜瓜的果皮和果肉组织,CmCHT1、CmCHT2、CmGLU相对表达量都不同程度升高,表明病原菌刺激了病程相关蛋白CHT和GLU基因的表达,而在健康植物中不存在或者微弱表达。
CHT和GLU作为两类重要的病程相关蛋白[32-33],链格孢侵染采后伽师瓜和86-1甜瓜,伽师瓜CHT和GLU活性明显高于86-1甜瓜,果皮CHT和GLU活性高于果肉,在侵染中期和末期保持较高水平,说明病原菌在侵染中期和末期刺激了CHT和GLU的产生,使其提高自身活力降解病原菌细胞壁中的多糖,从而起到抗病作用。
在甜瓜收获时,农户为了缩短采摘时间,通常一人在田间摘下甜瓜,采取投、抛的方式运送至另一人手中,其果皮可能伴随着肉眼难以察觉的破坏,如完整的蜡质层、角质层被划伤,出现裂缝,而病原微生物能够通过这些伤口侵入果实内部,使甜瓜发生病害,在本研究中,通过显微结构观察果皮和果肉组织受病原菌侵染后病斑扩展情况,分析病程相关蛋白基因表达及酶活性变化规律,明确了果皮在抵抗病原菌侵染过程中的首要作用,因此在采收甜瓜时,应适当增加对甜瓜果皮结构的保护,减少甜瓜病害发生。
4 结 论
链格孢侵染采后甜瓜,伽师瓜和86-1甜瓜分别在第9天和第6天出现病斑,之后不断扩大,86-1甜瓜病斑直径始终大于伽师瓜,果肉大于果皮,侵染30 d,86-1甜瓜果肉和果皮的病斑直径是伽师瓜的1.28 倍和1.29 倍,伽师瓜抵抗链格孢侵染的能力强于86-1甜瓜。
链格孢侵入甜瓜后,果皮和果肉组织通过细胞壁增厚抵御链格孢侵染,果肉组织抵抗能力较弱,侵染末期果皮与果肉组织细胞内侵入大量菌丝体和分生孢子,部分细胞解体,无法辨认细胞结构。
链格孢侵染采后甜瓜,CmCHT1、CmCHT2、CmGLU相对表达量和CHT活性、GLU活性明显提高,呈升高-降低趋势,伽师瓜峰值均高于86-1甜瓜,果皮高于果肉,峰值多在15~21 d出现,因此相比于86-1甜瓜,伽师瓜能够更迅速响应链格孢菌侵染,果皮抵抗能力更强,能快速、大量产生抗病蛋白,在侵染中期(15~24 d)作用显著。证实病程相关蛋白在甜瓜抗链格孢侵染中的关键作用。

