气相色谱-负化学源电离-质谱法测定蔬菜中氟虫腈及其代谢物残留
高 霞,陈 辉,谭 敏,李玉秀,何泓霖
(1.湖南新程检测有限公司,湖南 株洲 412000;2.工业和信息化部电子第五研究所,广东 广州 510000)
氟虫腈商品名为锐劲特,是法国拜耳作物科学公司(原罗纳-普朗克公司)于1987年开发的苯基吡唑类光谱杀虫剂[1-3],由于氟虫腈具有杀虫谱广、杀虫效果好、时效长、不影响作物生长等优势曾于20世纪90年代后期在我国大范围推广和应用[4-5]。动物实验研究表明,大量摄入含一定浓度氟虫腈的食品会损伤消化系统、神经系统、肝脏、肾脏、甲状腺等[6-7]。氟虫腈在环境中稳定性较差,能代谢出成毒性更强的氟甲腈、氟虫腈砜和氟虫腈亚砜3 种代谢物[8],世界卫生组织将氟虫腈列为对人类有中等毒性化学品[9]。我国农业部、工业和信息化部、环境保护部于2009年联合发布的1157号公告中明确规定自2009年10月1日起,除卫生用、玉米等部分旱田种子包衣剂外,在我国境内停止销售和使用含氟虫腈成分的农药制剂[10]。我国于2020年2月15日实施的GB 2763—2019《食品中农药最大残留限量》中规定了氟虫腈在蔬菜中的最大残留限量为0.02 mg/kg,此最大残留限量为氟虫腈及其3 种代谢物之和,以氟虫腈表示[11]。国外方面,欧盟委员会于2020年5月18日实施的2019/1792号条例修订了氟虫腈在多种产品中的最大残留限量,修订后氟虫腈在蔬菜中的最大残留限量为0.005 mg/kg,此最大残留限量也为氟虫腈及其3 种代谢物之和。
目前测定食品中氟虫腈检测方法主要有液相色谱-串联质谱法[12-21]、气相色谱-电子电离源-质谱法[21-25]、气相色谱-负化学源电离-质谱法[21,26-27]和气相色谱-串联质谱法[21,28-30]。而目前的检测标准和报道文献方法中大多集中在氟虫腈原药检测上,也有部分对氟虫腈代谢物检测进行研究,但多集中在对动物源食品,且多采用液相色谱-串联质谱法、气相色谱-电子电离源-质谱法和气相色谱-串联质谱法,鲜有采用气相色谱-负化学源电离-质谱法检测蔬菜中氟虫腈及其代谢物的报道。GB 2763—2019规定蔬菜中氟虫腈采用SN/T 1982—2007《进出口食品中氟虫腈残留量检测方法 气相色谱-质谱法》检测,该方法采用的是气相色谱-负化学源电离-质谱法,但只检测氟虫腈原药,不涉及其代谢物氟甲腈、氟虫腈砜和氟虫腈亚砜。氟虫腈及其3 种代谢物分子结构中含有6 个氟原子、2 个氯原子和1 个氰基基团,具有较强的电负性。化学源电离是软电离方式,对基质和色谱柱流失没有响应,采用化学源检测负离子,相对电子电离源谱图更简单,选择性更好、辨识度更高,也能获得更高的检测灵敏度。
综上所述,建立蔬菜中氟虫腈及其代谢物残留量的气相色谱-负化学源电离-质谱检测方法迫在眉睫。本实验基于QuEChERS前处理方法,经过进一步优化,结合气相色谱-负化学源电离-质谱法对蔬菜中氟虫腈及其3 种代谢物氟甲腈、氟虫腈砜和氟虫腈亚砜的检测进行研究。结果表明,本方法简便、灵敏、准确,可以满足蔬菜中氟虫腈及其3 种代谢物的快速检测需求。
1 材料与方法
1.1 材料与试剂
菠菜、辣椒、豇豆、甘蓝、黄瓜 市购;氟虫腈、氟虫腈砜标准品(纯度≥96%) 德国Dr.Ehrenstorfer公司;氟甲腈、氟虫腈亚砜标准储备溶液(100 µg/mL,溶剂为丙酮) 农业部环境保护科研监测所;乙二胺-N-丙基硅烷(primary secondary amine,PSA,40~63 µm)、十八烷基硅烷键合硅胶(C18,40~63 µm)、石墨化碳黑(graphitized carbon black,GCB,120~400 目)、尼龙过滤膜(0.22 µm) 上海安谱实验科技股份有限公司;乙腈、丙酮(均为色谱级) 美国TEDIA公司;氯化钠、无水硫酸镁(均为分析纯) 国药集团化学试剂有限公司。
1.2 仪器与设备
TSQ7000气相色谱-质谱联用仪(配有Chromeleon 7分析软件) 美国Thermo Fisher公司;TG18均质器德国IKA公司;VORTEX-6涡旋混合器 江苏海门其林贝尔仪器制造有限公司;H2050R冷冻离心机 长沙湘仪离心机仪器有限公司;DC系列24位防腐型水浴氮吹仪上海安谱实验科技股份有限公司;Transferpette®移液器德国Brand公司。
1.3 方法
1.3.1 试样制备
取代表性样品约1 000 g,切碎后用均质器充分搅碎均匀,放入聚乙烯瓶中,于-20 ℃冰箱中保存。
1.3.2 样品前处理
准确称取10 g均质后样品于50 mL具塞离心管中,加入20 mL乙腈,涡旋混匀1 min,再振荡提取3 min,加入5 g MgSO4和2 g NaCl,剧烈振荡1 min,5 000 r/min离心1 min,取2 mL上清液于预先加入50 mg PSA、25 mg C18、25 mg GCB和100 mg MgSO4的离心管中,剧烈振荡1 min,10 000 r/min离心1 min,取上清液1 mL于40 ℃水浴中氮气吹干,加入1 mL丙酮,涡旋溶解,经0.22 µm微孔滤膜过滤,待气相色谱-质谱联用仪测定。
1.3.3 标准溶液配制
标准储备溶液的配制:分别准确称取氟虫腈和氟虫腈砜适量,以丙酮为溶剂,配制质量浓度为100 µg/mL的氟虫腈和氟虫腈砜标准储备溶液,于-20 ℃低温保存。
混合标准中间液:分别准确吸取氟虫腈、氟甲腈、氟虫腈砜和氟虫腈亚砜标准储备溶液各1 mL,用丙酮稀释至100 mL,配制成质量浓度为1 µg/mL的混合标准中间液,于-20 ℃低温保存。
空白基质提取液:样品在1.3.2节进行前处理后进行仪器分析,当氟虫腈及其3 种代谢物的定性和定量离子信噪比均小于3时,可确定样品为空白基质,空白基质按照1.3.2节前处理,获得空白基质提取液。
基质混合标准溶液的配制:准确吸取适量混合标准中间液,用空白基质提取液稀释成质量浓度分别为0.2、0.5、1.0、2.5、5.0 µg/L和10.0 µg/L的基质混合标准溶液,供气相色谱-质谱联用仪测定。
1.3.4 气相色谱-质谱条件
1.3.4.1 气相色谱条件
TR-5MS色谱柱(30 m×0.25 mm,0.25 µm);进样口温度250 ℃;进样模式:不分流进样;进样体积1 µL;载气为高纯氦气;载气流速1 mL/min;程序升温:初始温度100 ℃,保持1 min,以80 ℃/min升至220 ℃,保持1 min,再以10 ℃/min升至280 ℃,保持1 min。
1.3.4.2 质谱条件
传输线温度250 ℃;离子源温度150 ℃;四极杆温度150 ℃;负化学源电离;选择离子监测;溶剂延迟3 min;反应气:甲烷(纯度≥99.999%);反应气流速1.25 mL/min。氟虫腈及其代谢物的检测参数见表1。
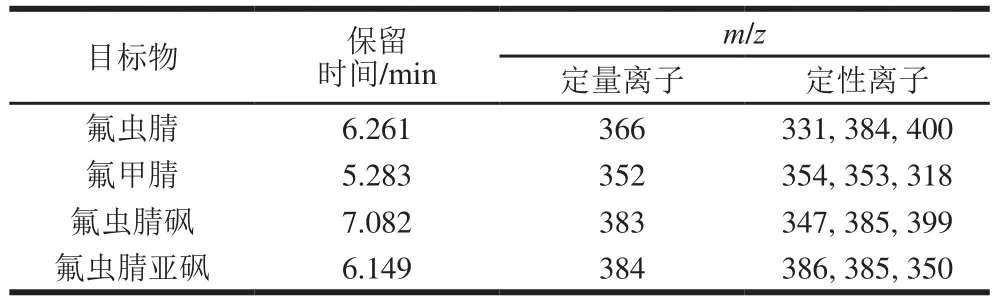
表1 氟虫腈及其代谢物的检测参数Table 1 Chromatographic and MS parameters for fipronil and its metabolites
1.4 数据处理
采用气相色谱-质谱联用仪配备的定量分析软件Chromeleon 7和Microsoft Excel对检测结果进行分析和统计。
2 结果与分析
2.1 氟虫腈及其代谢物的检测参数优化
2.1.1 色谱柱的选择
尝试相同规格(30 m×0.25 mm,0.25 µm)不同固定相的石英毛细管色谱柱,包括TG-1MS色谱柱(100%二甲基聚硅氧烷)、TG-5MS色谱柱(5%苯基/95%二甲基聚硅氧烷)和TR-5MS色谱柱(5%苯基聚硅氧烷),结果发现氟虫腈及其3 种代谢物在3 种色谱柱上均有保留,但在TR-5MS上峰形较好(图1),因此选择TR-5MS作为本实验分析用色谱柱。
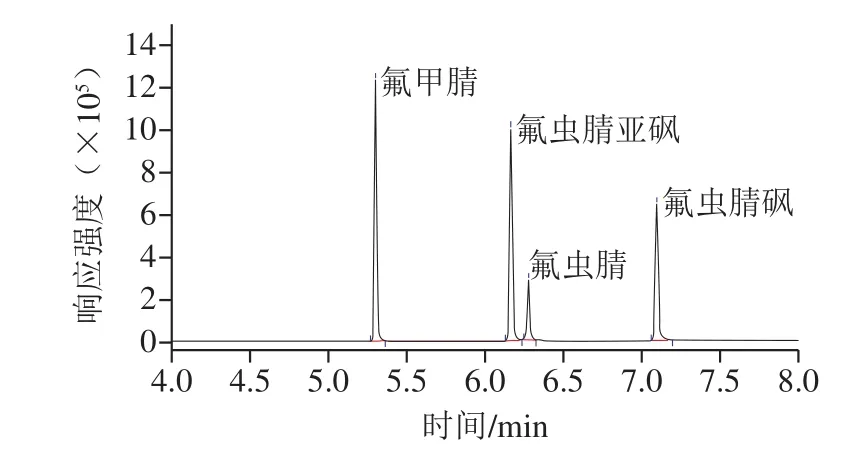
图1 氟虫腈及其代谢物总离子流色谱图Fig.1 Total ion current chromatogram of fipronil and its metabolites
2.1.2 质谱参数的确定
以负化学源电离为质谱源,采用全扫描离子模式扫描氟虫腈及其3 种代谢物的特征离子,质量扫描范围设置为m/z100~500,氟虫腈、氟甲腈、氟虫腈砜和氟虫腈亚砜的全扫描质谱图见图2。根据各化合物的气相色谱-质谱图确定特征碎片离子(表1)并建立选择离子监测方法进行后续分析。
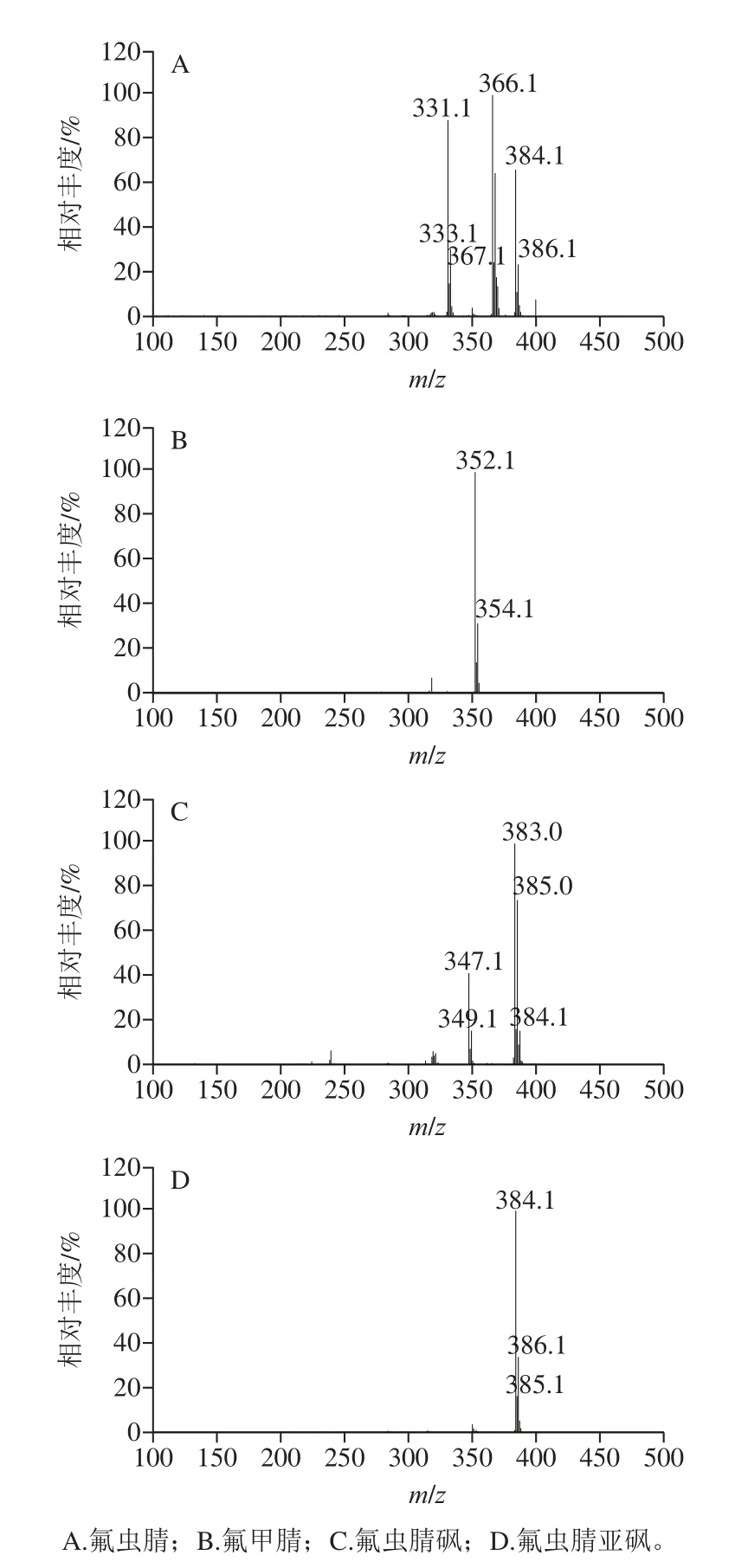
图2 氟虫腈及其代谢物全扫描质谱图Fig.2 Full-scan mass spectra of fipronil and its metabolites
2.2 前处理方法优化
2.2.1 提取溶剂的选择
农残检测中,常用提取溶剂有乙腈、丙酮、乙酸乙酯等,本实验以添加量为5.0 µg/kg的黄瓜为研究对象,对比乙腈、酸化乙腈(1%乙酸)、丙酮、乙酸乙酯和正己烷作为提取溶剂对氟虫腈及其3 种代谢物的提取效果,结果见图3。乙腈和酸化乙腈对4 种化合物的提取回收率高于丙酮、乙酸乙酯和正己烷,乙腈和酸化乙腈对氟虫腈、氟甲腈和氟虫腈亚砜的提取回收率接近,均为100%左右,但乙腈对氟虫腈砜的提取回收率优于酸化乙腈,故本研究选用乙腈为提取溶剂。
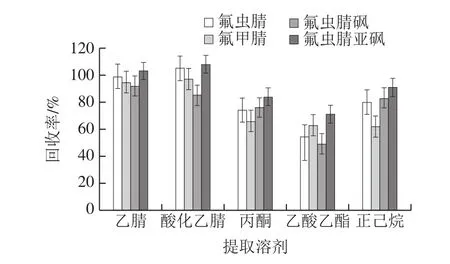
图3 提取溶剂对回收率的影响Fig.3 Effect of extraction solvents on recoveries of fipronil and its metabolites
2.2.2 提取溶剂用量的确定
以黄瓜为研究对象,准确称量10.0 g样品,添加量为5.0 μg/kg时,分别考察乙腈用量为10、15、20、25、30 mL时对农药残留的提取效果,结果见图4。采用20 mL乙腈能达到充分提取目标分析物的目的,继续增加乙腈用量,提取效果未见明显改善。
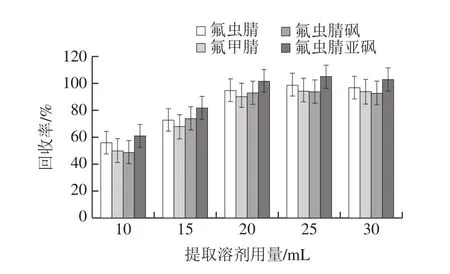
图4 提取溶剂用量对回收率的影响Fig.4 Effect of extraction solvent volume on recoveries of fipronil and its metabolites
2.2.3 净化方法的优化
蔬菜样品经乙腈提取后,会有有机酸、色素、蜡质、维生素等杂质进入提取液中,本研究采用农药残留检测常用的QuEChERS净化方法对提取液进行净化,QuEChERS常用吸附剂有PSA、C18和GCB等,PSA通过阴离子交换吸附脂肪酸、有机酸、极性色素以及糖类等干扰物,C18可除去非极性的干扰物如脂类、花青素、蜡质等,GCB作为弱极性或非极性吸附剂,能有效去除疏水性化合物,如叶绿素、叶黄素、类胡萝卜素等色素和甾醇等。为探讨PSA、C18和GCB的用量对氟虫腈及其代谢物回收率影响及无水MgSO4对净化液的除水效果,以2 mL添加量为5.0 µg/kg黄瓜基质的提取离心后的上清液为研究对象,PSA选取25、50、100 mg三水平,C18选取12.5、25、50 mg三水平,GCB选取12.5、25、50 mg三水平,无水MgSO4选取100、150、200 mg三水平做正交试验,结果见表2、3。
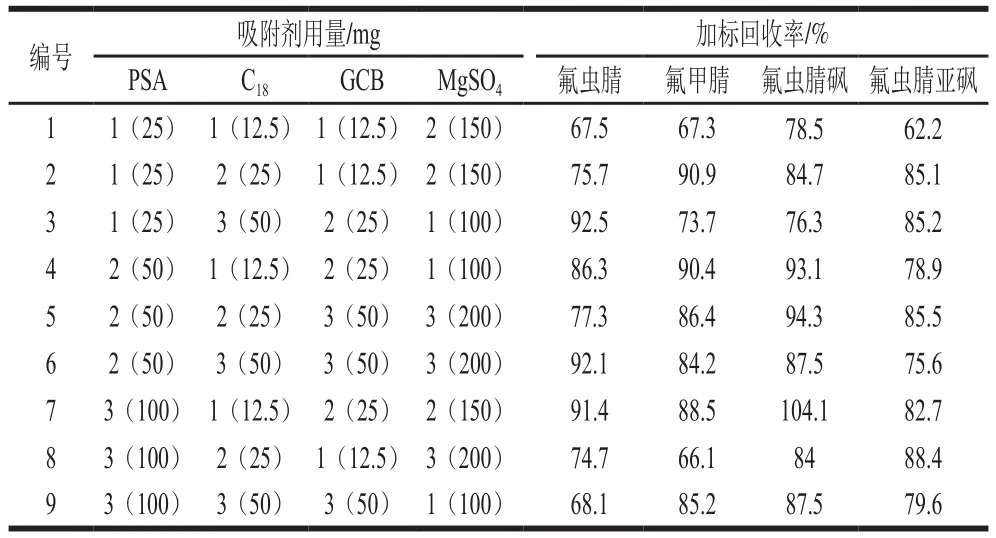
表2 L9(34)正交试验设计及结果(n=3)Table 2 Orthogonal array design with experimental results for optimization of sorbent combinations (n= 3)
由表3可以看出,PSA、C18、GCB和MgSO4的平均极差值分别为8.3%、7.3%、10.1%和4.1%,4 个因素对加标回收率的主次影响顺序为GCB、PSA、C18和MgSO4,从表3四种吸附剂各水平下整体平均回收率可以看出各因素的最好水平分别为PSA水平2,GCB水平2、C18水平2、MgSO4水平1,即4 种吸附剂的最佳组合为PSA 50 mg、GCB 25 mg、C1825 mg、MgSO4100 mg,此组合并未出现在正交试验表中,通过验证实验,氟虫腈、氟甲腈、氟虫腈砜和氟虫腈亚砜的加标回收率分别为93.4%、94.6%、98.1%和99.3%,整体优于表2中数据。
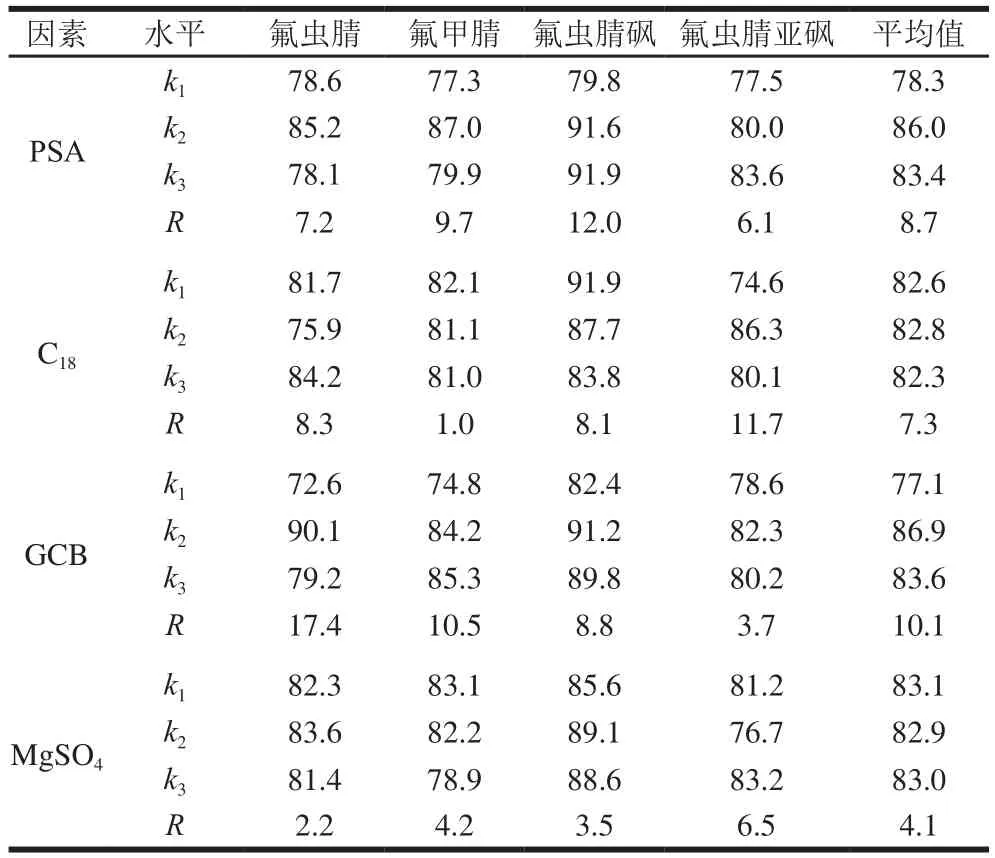
表3 正交试验结果分析Table 3 Result analysis of orthogonal array design%
2.3 基质效应
基质效应为基质匹配标准曲线的斜率与溶剂标准标准曲线的斜率两者比值,比值越接近1,则基质效应越小。本研究考察氟虫腈及其3 种代谢物在菠菜、辣椒、豇豆、甘蓝和黄瓜中的基质效应,结果见表4。氟虫腈及其3 种代谢物在5 种蔬菜中存在不同程度的基质效应,氟虫腈及其3 种代谢物中氟虫腈的基质效应最大、氟甲腈的基质效应最小,5 种蔬菜中菠菜的基质效应最大、黄瓜的基质效应最小。为克服基质效应,本研究采用基质匹配标准曲线法定量。
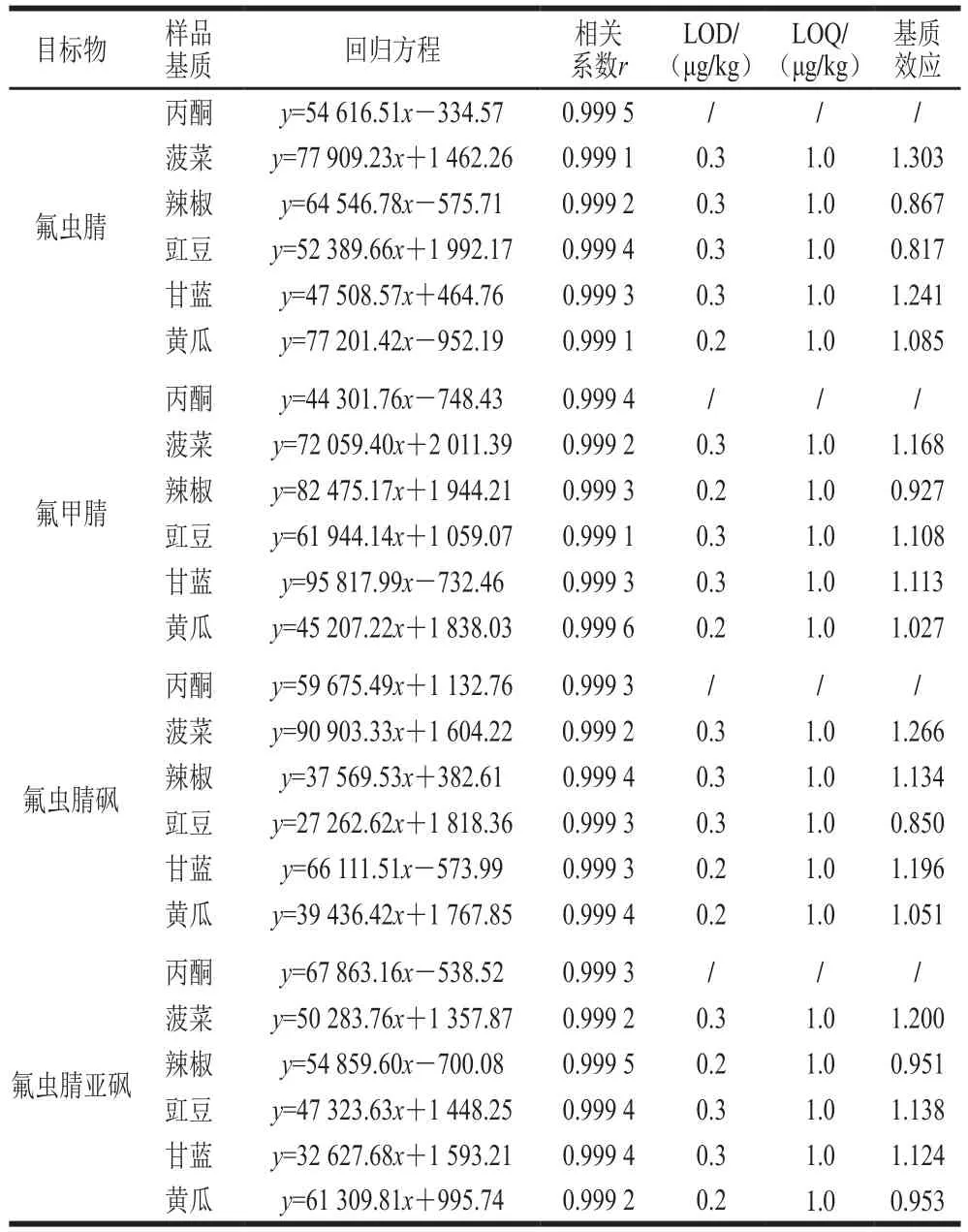
表4 氟虫腈及代谢物的线性方程、相关系数、线性范围、LOD和LOQTable 4 Calibration equations, coefficients of determination, liner ranges, LODs and LOQs for fipronil and its metabolites
2.4 方法学评价
2.4.1 线性范围、LOD和LOQ结果
在优化的分析条件下,配制氟虫腈及其代谢物质量浓度分别为0.2、0.5、1.0、2.5、5.0、10.0 µg/L的基质混合标准溶液,经气相色谱-质谱联用仪测定后,以农药定量离子峰面积为纵坐标,农药基质标准溶液质量浓度为横坐标,绘制标准曲线。以添加回收样品峰响应值为3 倍信噪比为方法检出限(limit of detection,LOD),以10 倍信噪比为方法定量限(limit of quantitation,LOQ)。如表4所示,氟虫腈及其代谢物在0.2~10.0 µg/L线性范围内,线性关系良好,线性相关系数均大于0.999,LOD为0.2~0.3 μg/kg,LOQ为1.0 μg/kg,低于GB 2763—2019标准和欧盟委员会(EU)2019/1792号条例规定的氟虫腈在蔬菜中的最大残留限量。
2.4.2 加标回收率和精密度结果
在菠菜、辣椒、豇豆、甘蓝和黄瓜5 种空白样品中添加适量氟虫腈及其代谢物标准溶液,使添加水平分别为LOQ、5 倍LOQ和10 倍LOQ。每个添加水平进行6 次平行实验。采用基质匹配标准曲线进行定量分析,结果见表5。4 种化合物的平均加标回收率在88.9%~105.8%之间,相对标准偏差(relative standard deviation,RSD)在2.2%~7.6%之间,方法具有较好的回收率和重复性。证明前处理方法及气相色谱-负化学源电离-质谱法灵敏、准确、高效,适用于各种类别蔬菜中4 种农药残留的同时测定。
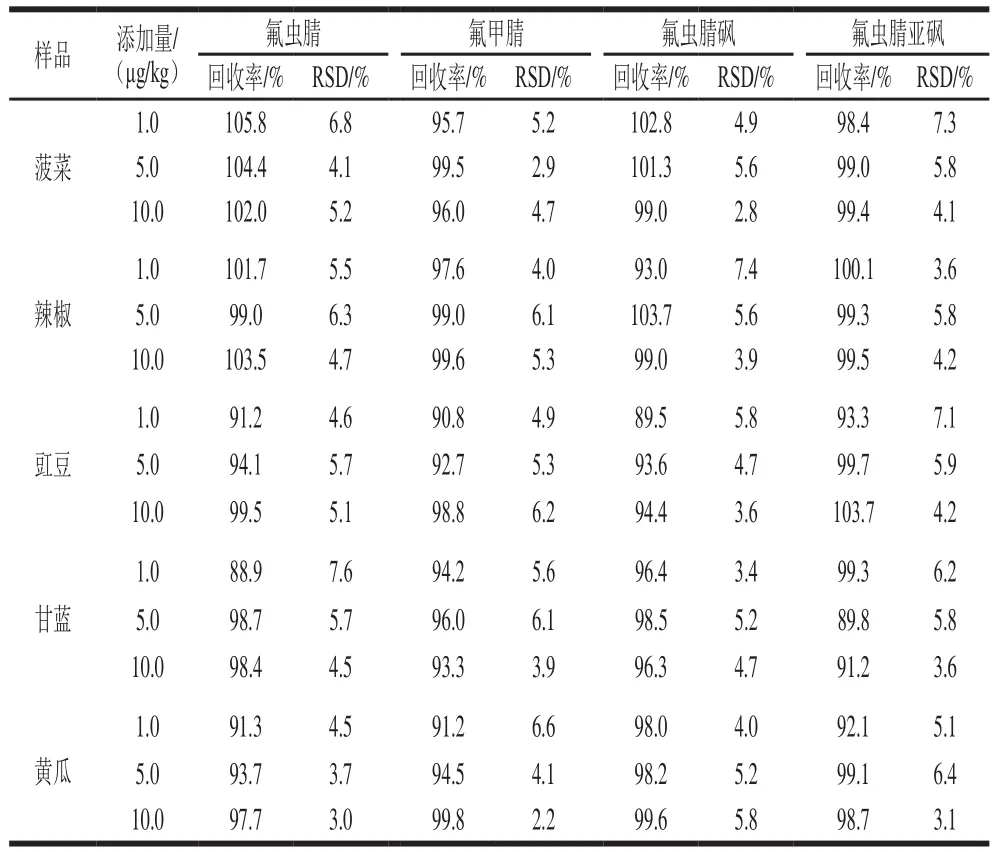
表5 5 种蔬菜基质中4 种农药的平均回收率和精密度(n=6)Table 5 Average spiked recoveries and precision for fipronil and its metabolites in five vegetables (n= 6)
2.5 实际样品检测
应用本方法测定了市售菠菜、辣椒、豇豆、甘蓝和黄瓜5 种蔬菜中的氟虫腈及其代谢物残留,在一批豇豆样品中检出了氟虫腈和氟虫腈亚砜,含量分别为64.2 µg/kg和3.1 µg/kg,二者之和以氟虫腈表示为66.7 µg/kg,超过GB 2763—2019规定的氟虫腈在蔬菜中0.02 mg/kg的最大残留限量,为不合格样品。图5为检出氟虫腈和氟虫腈亚砜残留的阳性豇豆样品的总离子流色谱图。
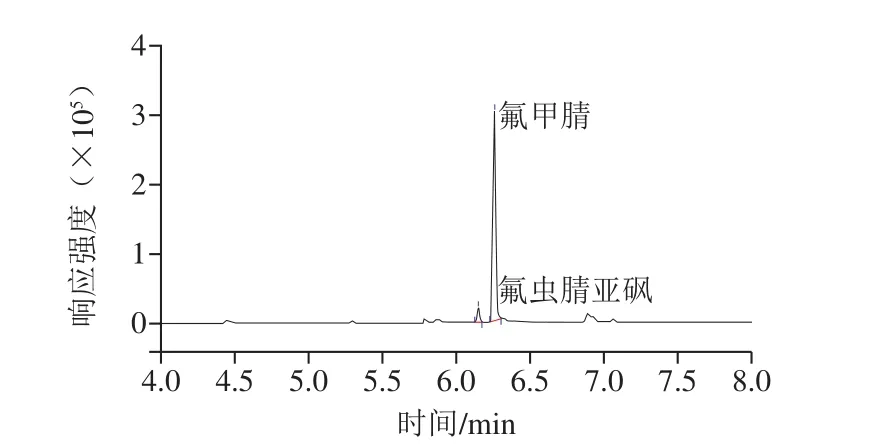
图5 阳性豇豆样品中氟虫腈及其代谢物总离子流色谱图Fig.5 TIC chromatogram of fipronil and its metabolites in positive cowpea samples
3 结 论
本研究建立了气相色谱-负化学源电离-质谱法测定蔬菜中氟虫腈及其3 种代谢物残留的检测方法。与标准方法及已有报道相比,本方法涵盖了GB 2763—2019及欧盟委员会限量规定中的氟虫腈的全部残留标志物检测,本方法样品前处理简便快速、回收率高,LOQ及精密度均能满足痕量分析要求,可用以蔬菜中氟虫腈及其代谢物残留量的测定。

