浅谈药品质量标准的建立和有效期的评估
石水萍 梁芳芳
DOI:10.16660/j.cnki.1674-098X.2102-5640-6830
摘 要:近十几年,中国制药行业快速发展,随着大众及药监部门对公众健康及安全用药的重视,药品的安全性、有效性和质量可控性越来越被制药企业所关注。结合药品申报经验及药品日常质量控制情况,药企在药品质量标准的建立及有效期的评估中,仍存在一些普遍性问题。本文对如何通过工艺能力和质量指标诠释药品的特性,以及如何通过稳定性研究建立合理的有效期,做了一些分析、汇总和总结,浅析如何更好地制定药品的质量标准及有效期。
关键词:制药企业 质量标准 有效期 评估
中图分类号:R95 文献标识码:A 文章编号:1674-098X(2021)03(c)-0186-03
Establishment of Drug Quality Standard and Evaluation of Validity
SHI Shuiping LIANG Fangfang
(Xinchang Pharmaceutical Factory of Zhejiang Pharmaceutical Co., Ltd., Xinchang, Zhejiang Province, 312500 China)
Abstract: In recent years, China's pharmaceutical industry has developed rapidly. With the public and drug administration departments paying more attention to public health and safe drug use, pharmaceutical companies pay more and more attention to the safety, effectiveness and quality control of drugs. Combined with the experience of drug declaration and the daily quality control of drugs, there are still some common problems in the establishment of drug quality standards and the evaluation of validity period in pharmaceutical enterprises. This paper makes some analysis, summary and summary on how to interpret the characteristics of drugs through process capability and quality indicators, and how to establish a reasonable period of validity through stability research, so as to analyze how to better formulate the quality standard and period of validity of drugs.
Key Words: Pharmaceutical enterprises; Quality standard; Validity; Assessment
藥品,作为一种用于预防、治疗或诊断人类疾病的特殊物质,除了外观,使用者是无法辨别其内在质量的。这样一来,制药企业如何评价、通过哪些项目、设定怎样的指标来诠释药品的安全性、有效性和稳定性,就显得尤为重要。
药品的质量标准,正是在药物开发、研究、生产过程中制定出来的,用于判定药品这些特性的重要指标,直接关系到药品的放行和使用。如何确保出厂药品以及货架期内药品的质量,关键因素之一就是建立合理的质量标准及制定合理的有效期。
1 对质量标准的理解
质量标准是由一系列的检测、分析方法的参照和适当的可接受标准(限度值、范围或其他检测中描述的标准)组成,是国家对药品质量、规格及检验方法所做的技术规定,是药品生产、采购、使用、检验和药监部门共同遵循的法定依据[1]。
因此,好的质量标准的制定,不仅要考虑药品本身特性,还要考虑分析方法、生产工艺过程的控制、原辅料、稳定性等各方面因素,这样综合制定的一个合理的、适当的标准,才能够切实确保药品质量,确保患者的用药安全和有效。
质量标准制订时,首先应收集和掌握药物在国内外药典中是否有收载、文献中是否有相关的研究,包括分析方法、安全性、有效性、杂质谱、结构确证等资料。其次,应掌握在工艺过程中的中间体和使用到的一些溶剂情况。
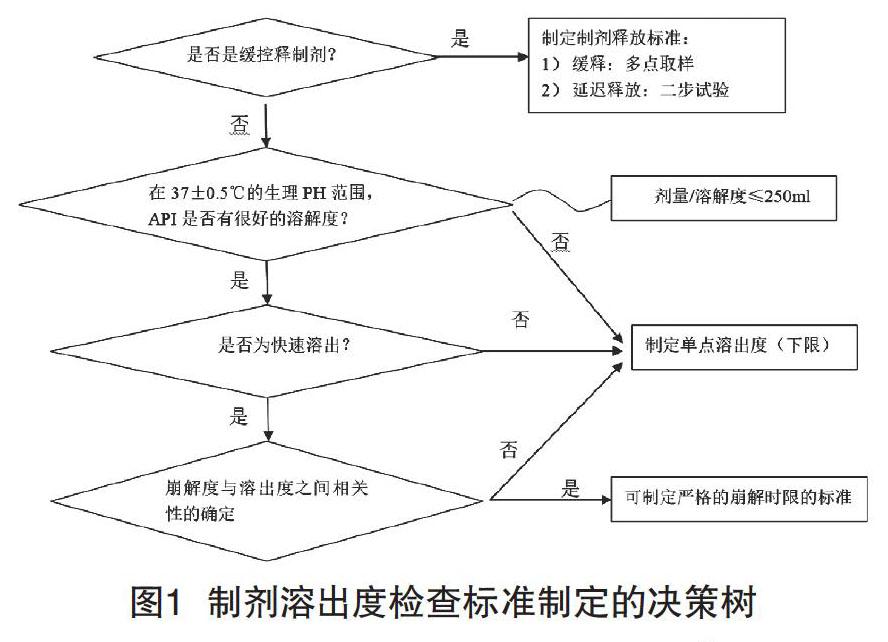
在药物研发过程中,从小试开始,应不断积累各方面检测数据,并通过工艺的摸索和变动,得到更多的药物质量属性变化的数据。其中还应关注原辅料带入的杂质、工艺杂质和降解杂质等。中试阶段,经过多批次数据的积累,逐渐确定了处方和工艺,结合前期研发数据及中试检测数据,能够初步建立质量标准,可以对确定处方和工艺的中试批开展预稳定性研究。到了放大试生产,不仅需要关注工艺控制能力,还需要收集和分析工艺波动情况下,各质量属性数据的波动情况。在此期间形成最终的质量标准及验证过的分析方法,用于工艺验证[2],如图1所示。
2 质量标准的检验项目及分析方法
质量标准的检验项目可以分为常规性检验及专属性检验。常规性检验是基于指示药物性质的一些共有的检测项目,如性状、鉴别、含量、有关物质等。专属性检验则依赖于药物剂型或工艺或化合物本身的特征,并非共性因素,如:注射剂中的摩尔渗透压、无菌检测、晶型不稳定产品的多晶型检测、口服制剂的含量均匀度等[3]。
对于分析方法,如果药典方法适用,应首选药典方法并验证。如果采用了文献报道,应确认该方法能够重现并适用,并确认该方法是否具有改进的空间,最终通过验证并使用。当完全无药典和文献可供参考的情况下,只能自行开发。自行开发的分析方法,要注意方法自身的变异应能够被控制,分析方法应能够识别产品的变异[4]。
对质量标准中的项目进行分析,基于对产品安全性和有效性的影响程度,得到关键质量属性,即CQA,这些项目应是质量研究的重点。
3 法规因素及指南
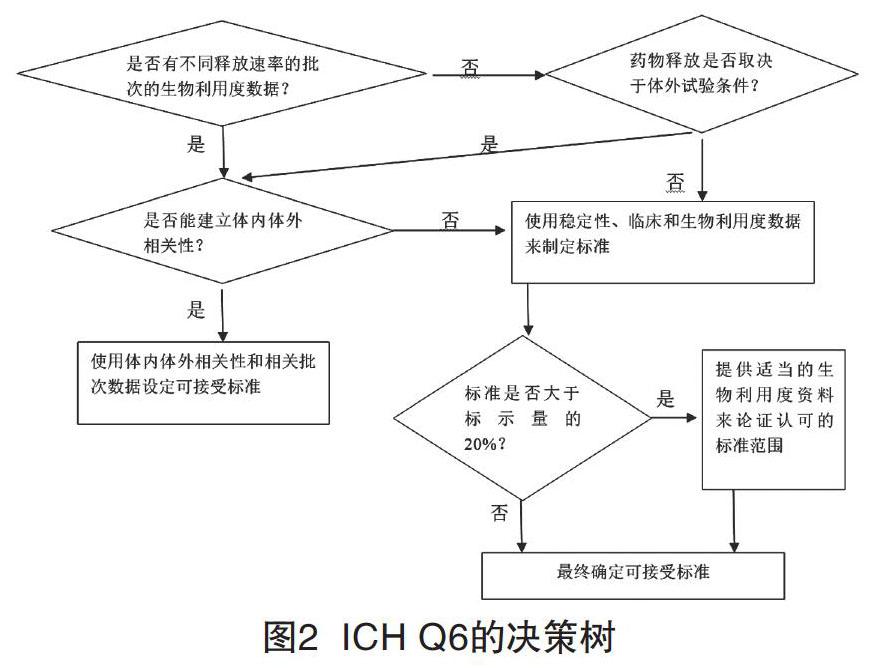
以如何确定口服固体制剂是否需要设置溶出度可接受标准为例,可通过下面的决策来确定。
如图2,ICH中,对于药品质量标准的制定、杂质研究等,在药品研发、临床、商业化生产及产品整个生命周期均有规定。如表1。
法规的变化是动态的,应时刻关注法规的动向及药典的变化,及时对已有的质量标准进行评估及变更。
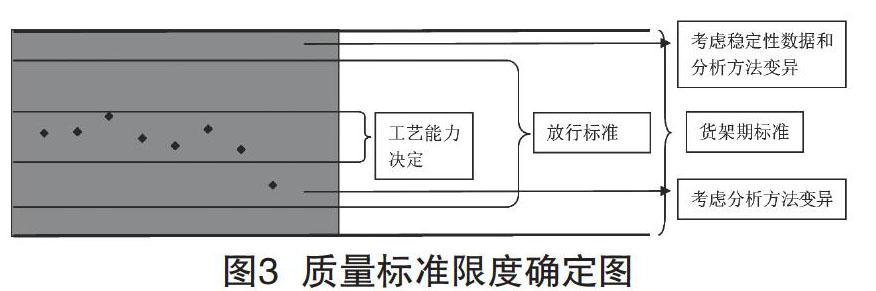
4 质量标准限度的制定
质量标准限度的制定,除了基于药典和文献的限度外,还应考虑工艺过程的控制能力、稳定性过程中项目的变化情况以及分析方法的误差。
(1)工艺过程控制能力:标准的建立要基于数据统计,积累一定批次的检测数据,考察工艺变异带来的检测数据的波动情况,对得到的数据进行统计分析,设定一定的容忍区间,例如±3σ。因此,在工艺生产过程中,应该注重控制过程,减少变异性,确保产品合格。
(2)稳定性项目的变化情况:制定合适的标准限度,确保放行产品和货架期内产品都能够符合标准。因此,是否需要制定内控放行标准,应取决于该药物稳定性期间项目的变化情况。
(3)分析方法误差:标準限度制定时还应关注分析方法本身的误差,但这部分误差可能在总误差中占比很小。
(4)其他:有的质量标准限度的确定,还要考虑到一些临床数据和生物利用度数据。如某一缓控释制剂应如何确定合适的标准范围。
因此,制订一个药物的质量标准时,应当明确哪些项目是该做的,哪些是不该做的,哪些是频率性检测,并且应理解为什么要做,以便于确定究竟哪些项目应当列入最终申报的质量标准中。
综上,可以用图3来表达质量标准限度的确定。
5 有效期的评估
有效期是药品在储存及销售期间的一项重要指标,有效期的长短,除了影响药品货架期内的安全性和有效性,还影响制药企业的销售及公众用药的便利性。因此,制定合理的有效期,对于药品来说是至关重要的[5]。
在原料药或制剂的复检期/有效期的评估工作中,可以借鉴ICH Q1E数据评估的决策树(见图4),冷冻制剂除外。当我们理解了这个决策树,就能够清楚在药物的质量研究过程中,如何使用和分析稳定性数据来合理的推测药物的有效期/复检期[6]。
其中,Y=预定的复检期或有效期;X=长期数据所覆盖的时间长度。
我们需要明确的是变化与变异的不同,也应当分析实验数据究竟是数据的变动,还是反应系统的变异。当无法评判或没有证据说明数据的波动是工艺变异造成时,只能考虑是分析方法的变异。
对于一个新品种产品或一项仿制药产品,可以基于良好的稳定性数据,初步建立适当的有效期,但往往由于某些因素,制定有效期的支持性数据并不能完全覆盖整个有效期的时间区,因此,还可以在上市后的持续稳定性研究期间,继续延长稳定性研究的时间,当积累一定数据后,仍然可以申请延长有效期。
以上针对质量标准的建立及有效期的评估,本文只做了浅显的归纳,旨在抛砖引玉,重在呼吁制药人员在药物质量标准制定的过程中,应慎重考虑多方面因素。
参考文献
[1] 丛鑫.药品质量标准中的安全性检查进展分析[J].智慧健康,2019,5(24):28-29.
[2] 廉克普.对药品质量控制与质量标准的分析[J].健康之路,2017,16(10):210.
[3] 苏凯.QL制药公司药品质量管理优化[D].济南:山东师范大学,2020.
[4] 谢炳全.DX公司质量管理体系改进研究[D].南昌:江西财经大学,2019.
[5] 邹玉梅.药品生产企业质量管理体系现状分析及改进思路[J].中国新技术新产品,2019(19):107-108.
[6] 董汶桥.过程管控为核心的制药工程质量控制途径[J].中国市场,2020(33):90-91.

