两株解淀粉芽孢杆菌的鉴定及对抗多菌灵可可球二孢菌的拮抗作用
董国然, 沙理堂, 周闯, 符可芯, 杨叶
(海南大学植物保护学院, 海口 570228)
芒果(MangiferaindicaL.)为漆树科芒果属,是一种热带亚热带重要的经济作物。我国是世界第二大芒果生产国,产量仅次于印度。海南是我国热带水果种植大省,芒果的种植面积在该省所有水果中排名第一。芒果花果期和贮存期发生的病害严重影响芒果的产量及品质[1]。其中,蒂腐病是芒果贮存期的一种主要病害。该病原菌导致果实迅速腐烂,在芒果贮藏和运输等环节造成巨大的经济损失,严重制约芒果产业的发展[2-4]。海南芒果蒂腐病病原菌主要有3种,分别是可可球二孢菌(BotryodiplodiatheobromaePat.=Lasiodiplodiatheobromae)、芒果拟茎点霉(PhomopsismangiferaeAhmad)和多米尼加小穴壳菌(DothiorelladominicanaPet.etCif.),其中可可球二孢是海南芒果蒂腐病第一大病原菌。
目前,在水果采前进行化学防治仍是应用最为广泛的防治措施,但长期使用化学农药,导致药剂残留污染和病原菌抗药性等问题日益突出[5]。因此绿色、环保的生物防治受到广泛关注。在果蔬采后病害防控方面,生物防治成为研究热点之一,包括利用拮抗微生物、植物天然产物以及抗病基因工程技术等[6]。拮抗微生物主要包括拮抗真菌、细菌和放线菌等,而拮抗细菌因其繁殖速度快,适应能力强等特点,大大简化了生化分析过程和代谢产物难于获取的问题,在生物防治方面极具优越性。其中,芽孢杆菌属(Bacillusspp.)在自然界中广泛存在,多个菌种因对人畜无害、且能有效降低植物病害的发生率,从而备受关注。自Johnson等[7]报道了枯草芽孢杆菌(B.subtilis)在植物病害防治中的应用后,利用芽孢杆菌属研制生防菌剂受到越来越多科研工作者的关注。1985年,枯草芽孢杆菌的首个商业产品出现,对镰刀菌(Fusariumsp.)和丝核菌(Rhizoctoniasp.)等土传病原菌具有显著的防治效果[8]。随后多个国家也陆续研发出芽孢杆菌生防菌剂防治多种植物病害,包括枯草芽孢杆菌、短小芽孢杆菌(B.pumilus)、蜡样芽孢杆菌(B.cereus)和解淀粉芽孢杆菌(B.amyloliquefaciens)等[9-14]。但是,拮抗菌在田间应用时易受自然环境影响,存在防治有效期短、竞争存活能力有限和防治病害效果不稳定等特点,限制了生防菌在田间的大规模应用[15]。因此,分离筛选出广谱抑菌、适应力强、遗传稳定性高的拮抗菌株仍是目前生物防治的研究重点。
通过长期对海南地区芒果蒂腐病防治及芒果蒂腐病病原菌可可球二孢抗药性监测,证实海南芒果蒂腐病病原菌可可球二孢已对苯并咪唑类杀菌剂多菌灵、甲氧基丙烯酸酯类杀菌剂嘧菌酯和吡唑醚菌酯均产生抗药性[16-18]。目前对该病原菌的防治仍以化学防治为主。面对日趋严重的抗药性问题,积极探寻新的防治方法,亟需研发防治产生抗药性病菌的药剂。生物防治因低毒、安全和不易使病原菌产生抗药性的特点而备受关注。因此,本研究对筛选出的2株拮抗菌进行形态、生理生化和分子鉴定,研究拮抗菌的抑菌活性和抑菌谱及其对具有不同抗药性的可可球二孢菌的抑制作用。综合评价2株生防菌的生物活性及生防潜力,为芒果蒂腐病的有效防治提供参考。
1 材料与方法
1.1 供试材料
1.1.1供试菌株 编号HBW和HBR的拮抗菌株为海南大学植物保护学院杀菌剂生物学实验室分离,保存在-80 ℃冰箱。
供试植物病原真菌有可可球二孢菌、冬瓜炭疽菌(Colletotrichumorbiculare)、辣椒炭疽菌(C.capsici)、芒果炭疽菌(C.gloeosporioides)、橡胶胶孢炭疽菌(C.gloeosporioides)、香蕉枯萎菌(Fusariumoxysporumf. sp.cubense)、草莓灰霉菌(Botrytiscinerea)、小麦赤霉菌(F.graminearum)、橡胶棒孢菌(Corynesporacassiicola)和橡胶麻点菌(Drechsleraheveae)。可可球二孢菌共12个菌株,其中,YZTN10601、JSJH10101、DTN83108为多菌灵敏感菌株(sensitivity,S);JSJH30204、JSJH30205、JSTN10102、CJJH10201为多菌灵中抗菌株(middle resisitance,MR);SYTN12603、JH21617、YCHJ80202、HLTN10402、CJTN22602为多菌灵高抗菌株(high resistance,HR)。
1.1.2供试培养基 LB液体培养基:蛋白胨10 g·L-1、酵母提取物5 g·L-1、氯化钠10 g·L-1,pH 7.0~7.2。
PDA培养基:马铃薯200 g·L-1、琼脂15 g·L-1、葡萄糖20 g·L-1、自然pH。
NA培养基:蛋白胨10 g·L-1、牛肉膏3 g·L-1、氯化钠5 g·L-1、琼脂15 g·L-1、pH 7.2~7.4。
1.1.3供试药剂和试剂 97.2%多菌灵原药(海南正业中农高科股份有限公司)用0.1 mol·L-1稀盐酸溶解后,用0.1%吐温-80溶液定容,配制成2 000 mg·L-1母液备用;450 g·L-1咪鲜胺水乳剂(山东省邹平县绿大药液有限公司)用无菌水稀释成450 mg·kg-1的咪鲜胺水溶液。
1.2 试验方法
1.2.1拮抗菌形态观察及生理生化特征检测
采用平板划线法和梯度稀释分离法获取单菌落。根据菌落形态,挑选平板内圆形、凸起、粘稠、透明的单菌落,将其移接至试管斜面培养基上,30 ℃培养24 h,置于4 ℃冰箱保存备用。
采用平板划线法将保存备用的HBW和HBR菌株接种到PDA平板上,28 ℃培养16 h后,从固体平板上挑取单个菌落进行革兰氏染色,观察菌体和芽孢的形态。菌株生理生化特征的试验操作方法及其结果分析参照《常见细菌鉴定手册》[19]。
1.2.2拮抗菌分子鉴定 用DNA提取试剂盒[DP302-02,天根生化科技(北京)有限公司]提取拮抗菌DNA,以此DNA为模板,采用16S通用引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R (5′-GGTTACCTTGTTACGACTT-3′)进行PCR扩增。PCR反应条件:95 ℃ 5 min;95 ℃ 30 s,57 ℃ 30 s,72 ℃ 1 min,34个循环;72 ℃ 5 min。初步鉴定后参照曹凤明等[20]和刘勇等[21]的方法,采用枯草芽孢杆菌特异性引物BSL72(5′-CGTAGAGCCACTTGAGCG-3′)和BSR328(5′-CTGCCGTTACAGTTCCTT-3′),以及解淀粉芽孢杆菌特异性引物L100(5′-AAATCTGCCCGT-ATCGTCG-3′)和R836(5′-GCGTCACGGCGRATC-TCAA-3′)进行PCR扩增。PCR反应条件:94 ℃ 3 min;94 ℃ 40 s,61.7 ℃ 40 s,72 ℃ 25 s,30个循环;72 ℃ 10 min。
扩增产物送广州天一辉远生物科技有限公司进行测序,在GenBank中进行BLAST相似性比对分析,利用ClustalX 1.8软件对多个已知菌株的基因序列进行多重比较,用MEGA 4.0软件中的Neighbor-Joining算法构建系统发育树,确定该菌株的系统发育学地位。
1.2.3拮抗菌对10种植物病原真菌的拮抗活性测定 采用平板对峙培养法,在PDA平板中央分别接种直径为5 mm的各供试病菌,同时在距离菌块3 cm处沿对称的四个方向各接种一环拮抗细菌,对照组不接种,每个处理重复3次,28 ℃恒温培养72 h。采用十字交叉法测量可可球二孢菌菌落直径,计算拮抗菌的拮抗活性,试验重复2次以上。
抑菌率=
1.2.4拮抗菌及其培养滤液对多菌灵抗性可可球二孢菌的拮抗活性测定 一是采用平板对峙培养法测定拮抗菌对12株不同抗药水平的可可球二孢的拮抗活性,计算抑菌率,详细方法同1.2.3。二是采用生长速率法测定拮抗菌无菌培养滤液对12株不同抗药水平可可球二孢的拮抗活性。
无菌培养滤液,从HBW和HBR菌株的单菌落上各挑取一环,分别接入装有4 mL LB液体培养基的试管中,30 ℃ 180 r·min-1振荡培养12 h后,移入装有100 mL LB液体培养基的250 mL锥形瓶中,30 ℃ 180 r·min-1振荡培养48 h后,将培养液装入100 mL无菌离心管,5 000 r·min-1离心30 min,上清液经0.22 μm微孔滤膜过滤除菌,得到无菌的发酵滤液。将无菌发酵滤液划线涂抹于PDA培养基,28 ℃恒温培养24 h,观察是否长菌。
确定获得无菌发酵滤液后,采取生长速率法测定拮抗菌可可球二孢菌的拮抗活性。具体方法如下:无菌发酵滤液设置5%、10%和20% 的浓度梯度,空白对照用等量的LB液体培养基代替发酵滤液,制成不同浓度的含药平板,分别将12株可可球二孢菌块接种于培养皿中央,每个处理重复3次。接种后放入28 ℃恒温培养箱培养36 h后,参照1.2.3进行拮抗活性的测定和计算。
1.3 数据统计与分析
采用Excel 2019、DPS、ClustalX 1.8、MEGA 4.0软件对试验数据进行统计分析。
2 结果与分析
2.1 拮抗菌的鉴定
2.1.1形态学和生理生化鉴定 菌株HBW和HBR在PDA培养基上培养1 d后,形成的单菌落均为圆形或近圆形,前期菌落表面光滑润泽、不透明、乳白色;后期菌落边缘呈明显锯齿状,表面粗糙且带粉状。革兰氏染色结果显示2株拮抗菌株均为阳性。显微镜下观察,菌体为短杆状,芽孢呈椭圆形,端生,并且一端染色一端透明;HBW菌株的菌体大小约为0.8 μm×2.1 μm,HBR菌株的菌体大小约为0.7 μm×1.9 μm (图1)。HBR菌株与可可球二孢菌株在同一个平板内对峙培养3 d后,靠近可可球二孢的HBR菌株的菌落边缘均会出现红色(图2),而HBW菌株与可可球二孢菌株对峙培养的平板中未发现此现象。
拮抗菌株HBW和HBR的生理生化检测结果见表1,2株拮抗菌均能分解利用蔗糖、葡糖糖、和淀粉等碳源,均能在4 ℃、pH 5~7、5%和7% NaCl浓度环境下生长。淀粉水解、过氧化氢酶、蔗糖发酵、葡糖糖发酵、柠檬酸盐利用和硝酸盐还原试验均呈阳性,V.P.、吲哚、脲酶、甲基红和明胶液化试验呈阴性。由此表明,拮抗菌株HBW和HBR符合解淀粉芽胞杆菌的生理生化特征,结合菌落形态及菌体特征[19],初步判断拮抗菌HBW和HBR为解淀粉芽孢杆菌(B.amyloliquefaciens)。

表1 拮抗菌的生理生化鉴定Table 1 Identification of antagonistic bacteria by physiological and biochemical methods
2.1.2分子鉴定 2株拮抗菌株利用16S rDNA通用引物进行PCR扩增,均得到长度为1 452 bp的序列片段,将16S rDNA序列进行BLAST分析,发现HBR和HBW与解淀粉芽孢杆菌和枯草芽孢杆菌的相似性达到99.7%以上;系统发育树显示HBR和HBW菌株与解淀粉芽孢杆菌(B.amyloliquefaciens)亲缘关系最近(图3)。采用枯草芽孢杆菌特异性引物(BSL72/BSR328)扩增无产物;但用解淀粉芽孢杆菌特异性引物(L100/R836)扩增后分别获得长度为746和734 bp的PCR产物,序列经BLAST比对发现与解淀粉芽孢杆菌的相似性均达99.5%以上。
2.2 拮抗活性
2.2.1HBW和HBR对10种植物病原真菌的拮抗活性 采用平板对峙培养法测定拮抗菌对10种常见植物病原真菌的拮抗活性。结果(表2)表明,拮抗菌HBW和HBR对10种常见植物病原真菌均表现出较为明显的拮抗活性,除橡胶棒孢菌及小麦赤霉菌外,对其余8种病原真菌抑制率均大于50%,其中对草莓灰霉菌的抑制率最高,为87%。
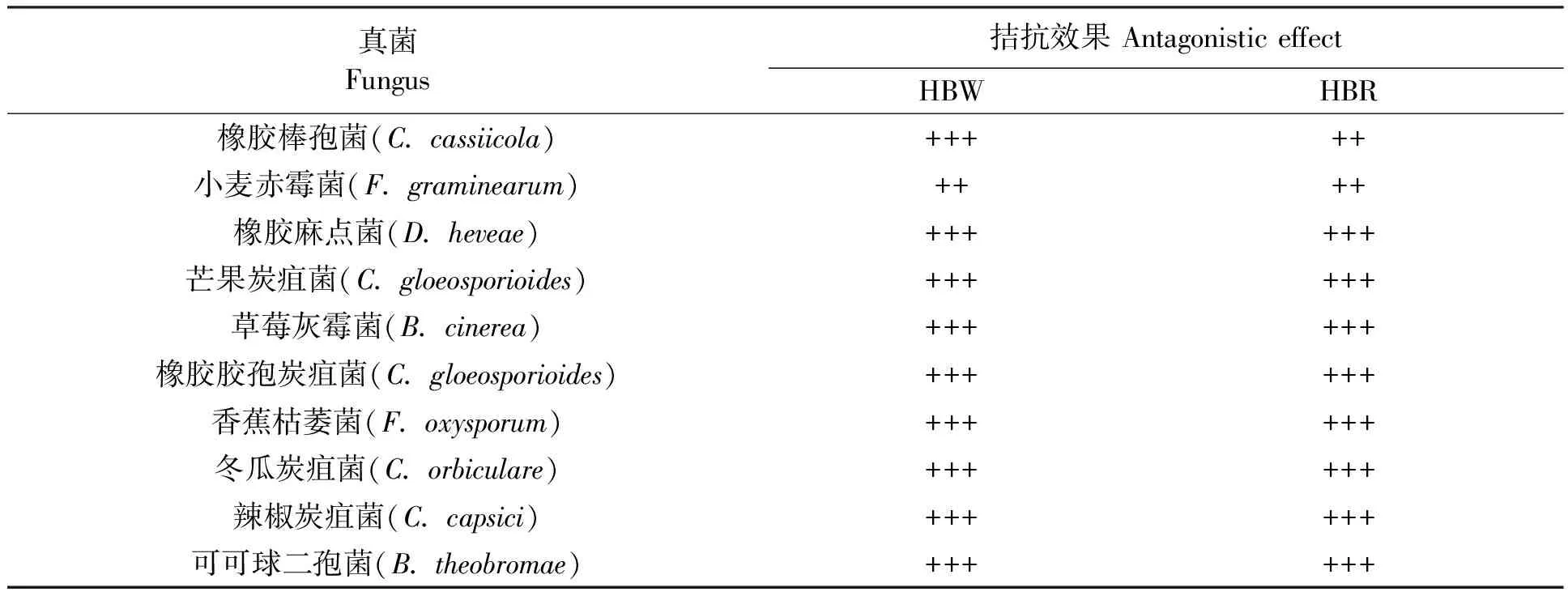
表2 拮抗菌株HBW和HBR对10种植物病原真菌的拮抗效果Table 2 Antagonistic effect of HBW and HBR strains against 10 kinds of plant fungal pathogens
2.2.2HBW和HBR对抗多菌灵可可球二孢菌的抑菌活性 拮抗菌HBW和HBR菌株对所有供试可可球二孢菌株均有明显的抑制作用(表3)。2个菌株的拮抗活性相近,HBW对12个菌株的抑制率为48.24%~70.59%;HBR对12个菌株的抑制率为48.24%~67.06%。其中,2种拮抗菌均对敏感菌株DTN83108的抑制率较高;对高抗菌株HLTN10402的抑制率较低,两者之间差异显著(P<0.05),而其他菌株之间多数差异不显著。

表3 拮抗细菌HBW和HBR对12株芒果可可球二孢菌的抑菌活性Table 3 Inhibitory activities of HBW and HBR on 12 isolates of Botryodiplodia theobromae
2.2.3HBW和HBR的无菌培养滤液活性测定 HBW和HBR菌株的无菌培养滤液对具有不同多菌灵抗性的可可球二孢菌均有良好的拮抗效果,2个菌株的抑菌活性相似(图4)。拮抗菌HBW 5%浓度培养滤液对不同多菌灵抗性水平菌株的抑制率为51.76%~100%;10%浓度滤液的抑制率为58.82%~100%;20%浓度滤液的抑制率为77.65%~100%。拮抗菌HBR 5%浓度培养滤液对不同多菌灵抗性水平菌株的抑制率为55.29%~89.41%;10%浓度滤液的抑制率为62.35%~100%;20%浓度滤液的抑制率为74.12%~100%。即拮抗菌培养滤液的浓度为5%时,最低抑制率也超过50%;当培养滤液浓度为20%时,抑制率最高可达100%(表4)。多重比较发现,菌株DTN83108最为敏感,与其他菌株间多存在显著差异(P<0.05)。总的来说,每种浓度处理下,同一抗性水平菌株间存在显著性差异,不同抗性水平菌株间也存在显著性差异(P<0.05),但这种差异主要还是个体不同所致,与菌株对多菌灵的抗性水平无关。

表4 拮抗菌发酵滤液对12株可可球二孢的抑制作用Table 4 Inhibition rate of culture filtrate of HBW and HBR on 12 isolates of Botryodiplodia theobromae
3 讨论
拮抗菌HBW和HBR经鉴定均为解淀粉芽孢杆菌,2个菌株就形态学、生理生化特征以及分子特征都较为相似,最大的区别在于HBR菌株与可可球二孢菌对峙培养3 d后,靠近可可球二孢菌丝的菌落边缘呈现红色,而在HBW菌株中未出现此现象。HBR菌株与其他植物病原菌对峙培养时,偶尔也有菌落边缘出现红色的现象,这可能与病原真菌和HBR菌株的互作有关,具体原因还需进一步验证。Reva等[22]研究也指出,解淀粉芽孢杆菌的一些菌株会形成红色的菌落,但是这类色素在解淀粉芽孢杆菌和芽孢杆菌中比较少见。
目前,国内外已经筛选出多种对果蔬采后病害具有明显防治效果的细菌、酵母菌和小型丝状真菌[23-26]。本研究中解淀粉芽孢杆菌HBW和HBR菌株对可可球二孢菌引起的芒果蒂腐、冬瓜炭疽、小麦赤霉等常见植物病原菌具有良好的拮抗效果,抑菌范围广。且对多菌灵杀菌剂产生严重抗药性的可可球二孢也具有良好的抑制活性,尤其是无菌培养滤液的抑制效果突出,20%浓度的无菌滤液最高防效可达100%。Che等[27]报道,短小芽孢杆菌FJAT-0809-GLX无菌培养滤液对可可球二孢菌引起的苹果果实黑斑病的防治效果优于菌液。Zhao等[28]研究指出,解淀粉芽孢杆菌的细胞培养液对果蔬采后细菌软腐病的防效优于无菌培养滤液。此外,也有发现解淀粉芽孢杆菌对采后番茄灰霉病及葡萄灰霉病[29-30]等病害具有显著拮抗作用,其发酵滤液还具有增加番茄幼苗鲜重、提高番茄质量及产量等效应;詹喜[31]研究发现枯草芽孢杆菌BS-Z菌株的代谢产物对指状青霉有明显的抑制作用;Arrebola等[32]发现,解淀粉芽孢杆菌及其代谢产物对7种柑橘采后真菌病原菌有拮抗活性;谢晚彬等[33]研究发现,解淀粉芽孢杆菌对香蕉枯萎病具有显著的防治效果,通过分析该菌生防基因,发现该菌产生防效的原因与合成脂肽抗生素有关。因此,结合已有报道,推断HBW和HBR菌株的发酵滤液中可能存在某种代谢产物对植物病原菌生长产生抑制作用,对代谢产物的成分、作用机理仍需进一步研究。
解淀粉芽孢杆菌是公认对人类安全的微生物,目前,在农业生产中广泛应用,具有易培养、易贮藏及易在土壤或植物中定殖的能力。除用于植物病害防控及果蔬保鲜外,还可作为植物肥料主要成分,促进作物生长,改善作物品质和修复环境污染等[9, 29, 31]。由于海南地区芒果致病菌的抗药性问题日益突出,因此,利用生物菌对芒果采后病害进行生物防治,尤其是对化学杀菌剂产生抗药性的病菌防治具有重要意义。除采后病害防治外,生防菌在果蔬采前的应用也愈来愈受到重视,果蔬采前的生物防治可以作为果蔬采后贮藏过程中免受多种伤害的一种有效防治策略。在生产应用中,还可利用生防菌与化学药剂混合使用的方法以提高防效[34-35],或利用不同防治靶标或不同拮抗能力的微生物混合使用,以提高对病害的防效[36]。本研究首次将解淀粉芽孢杆菌用于抑制芒果蒂腐病菌可可球二孢菌,为生物药剂的研发及大田防治奠定了基础。

