包装方式对牛排贮藏期间微生物数量和演替的影响
杨鸿博,杨啸吟,张一敏,梁荣蓉,罗 欣,王芳芳,毛衍伟
(山东农业大学食品科学与工程学院,山东 泰安 271018)
牛肉营养丰富,蛋白质和水分含量高[1]。因此,牛肉在贮藏和销售过程中,极易滋生微生物,导致肉色褐变、产生异味等品质问题,缩短了产品的货架期[2-3]。气调包装(modified atmosphere packaging,MAP)是一种有效的牛肉保鲜技术,能够较好地保持牛肉品质并延长其货架期[4]。80%(体积分数,下同)O2和20% CO2是气调包装中最常见的气体组成方式,其中O2和CO2分别起到护色和抑菌作用。然而,高浓度的氧气会造成脂质和蛋白质氧化以及好氧菌的大量增殖,从而导致牛肉品质下降。Yang Xiaoyin等[5]探究了不同气调包装方式对雪花牛排货架期和品质的影响,结果表明80% O2气调包装的牛排在前4 d呈现出诱人的鲜红色,但在第4天之后开始发生褐变和氧化,从而缩短了牛排的货架期。真空包装(vacuum package,VP)能很大程度减少氧气对牛肉品质的影响,但是缺氧环境使牛肉呈现暗紫色,且真空包装造成的汁液损失会大大降低消费者的购买欲[6]。因此,如何在延长牛肉货架期的基础上减少高氧包装对牛肉造成的不良影响是当前肉类科学中的亟待解决的问题。
50% O2气调包装(50% O2+30% CO2+20% N2)是一种新设计的气调包装,其主要目的是在保证良好肉色的前提下,尽量延缓肉类的氧化和腐败[4]。Lücke等[7]指出,只要使O2体积分数达到40%~50%便可以达到良好的护色效果,Zakrys-Waliwander等[8]也证明与其他含氧量相比,50% O2气调包装中的牛排具有更好的风味和嫩度。Emser等[4]发现CO2、O2、N2比例不同的气调包装对牛肉糜贮藏期间的微生物数有重大影响,50% O2气调包装下牛肉糜的颜色和微生物数量控制得最好。与此同时,牛肉在贮藏过程中经历了一系列微生物的动态演替,不同的气体组成对微生物群落的选择作用不同[9],而微生物的组成和演替是影响牛肉品质和货架期的重要因素。然而,目前缺乏对50% O2气调包装牛排贮藏过程中微生物演替及其与肉品质关系的研究。因此,本研究对比了50% O2气调包装和真空包装对牛肉贮藏期间微生物数量、细菌群落组成和演替的影响,并通过宏基因组的功能分析探讨了不同包装方式下微生物引起的肉类腐败机制,为明确不同包装方式下冷鲜牛肉的腐败机理、根据不同包装方式下微生物组成和演替开发有效的抑菌技术提供参考,从而进一步延长产品货架期、提高产品品质。
1 材料与方法
1.1 材料与试剂
在山东省某商业屠宰场选出20 头24 月龄杂交公牛(鲁西黄牛×西门塔尔),按GB/T 19477—2018《畜禽屠宰操作规程 牛》屠宰。宰后48 h,取肉牛左半胴体的背最长肌,真空包装后放在泡沫箱的碎冰上打包,3 h左右运至实验室。
PCA培养基、MRS培养基、VRBGA培养基、CFC培养基、STAA培养基 北京陆桥技术股份有限公司;蛋白胨、氯化钠 国药集团化学试剂有限公司;DNA提取试剂盒 天津迦美惠众科技有限公司;核酸纯化试剂盒美国Beckman Coulter公司;PicoGreen dsDNA定量检测试剂盒 美国Invitrogen公司;20丝真空包装袋 深圳喜之龙包装制品有限公司;TQBC-0775气调包装盒、Lid 1050阻隔膜 希悦尔(中国)有限公司。
1.2 仪器与设备
气调包装机 中国大江机械设备有限公司;Seven2Go pH计、数字天平 瑞士梅特勒-托利多公司;SP62色差计 美国爱色丽公司;真空包装机 德国Haggenmüller GmbH公司;微孔板分光光度计 美国BioTek公司;离心机 德国Eppendorf公司;蒸汽压力灭菌锅 厦门致微仪器有限公司;Nano DropTM1000紫外-可见分光光度计、生物安全柜 美国赛默飞世尔科技公司。
1.3 方法
1.3.1 样品采集和处理
将背最长肌去除真空包装后分割成9 块3 cm厚的牛排,在每条背最长肌中随机取出一块牛排,定义为贮藏0 d的样本,剩余的牛排在室温下分别进行真空包装(VP处理组)和50% O2气调包装(MAP处理组,50% O2+30% CO2+20% N2),然后于0~4 ℃条件下贮藏,分别在贮藏的0、3、7、14、21 d进行取样分析。
1.3.2 pH值和色泽的测定
色泽指标由亮度(L*值)、红度(a*值)和黄度(b*值)表示,使用色差计进行测定。测定前使用白色和黑色标准板对色差计进行校正,牛排去除包装后在室温下发色30 min,每块牛排样品在擦干表面水分之后测定5 个不同的位置,分别记录每个位置的数据。用pH计(提前用pH值分别为4.00和7.00的标准缓冲液在4 ℃下进行校正)测定牛排的pH值,探头插入深度约为3 cm,连续测定5 次。
1.3.3 微生物指标测定
微生物指标测定参考Yang Xiaoyin等[5]的方法。每块牛排样品获取25 g表面肉样,加入225 mL无菌蛋白胨生理盐水溶液在拍打均质机中室温均质90 s。样品使用体积分数0.1%无菌蛋白胨溶液进行连续稀释,挑选适当的稀释梯度进行微生物培养,培养条件如表1所示。

表1 微生物计数采用的培养基及培养条件Table 1 Culture media and culture conditions used for microbial counting
1.3.4 微生物多样性分析
收集1.3.3节均质后的溶液30 mL进行过滤,然后在4 ℃下10 000×g离心5 min。弃上清液,将含DNA的沉淀溶于1.5 mL 0.15 mol/L的NaCl溶液中,4 ℃下12 000×g离心5 min。使用DNA提取试剂盒提取DNA。采用338F(5’-ACTCCTACGGGAGGCAGCA-3’)和806R(5’-GGACTACHVGGGTWTCTAAT-3’)引物对细菌16S rDNA的V3~V4可变区进行聚合酶链式反应(polymerase chain reaction,PCR)扩增,扩增参数:98 ℃预变性2 min;98 ℃变性15 s,55 ℃退火30 s,72 ℃延伸30 s,25~30 个循环;最终72 ℃延伸5 min。PCR产物经质量分数2%琼脂糖凝胶电泳检测,并用PCR纯化试剂盒进行纯化。
使用Illumina Mi Seq PE250平台对提取的DNA进行测序,并截去Barcode序列和PCR扩增引物序列。以97%的相似度将DNA测序数据聚类成操作分类单元(operational taxonomy unit,OTU)并筛选出代表序列。通过SILVA数据库(http://www.arb-siLva.de/)对OTU代表序列进行对比,在分类学上划分OTU。
1.4 数据处理与分析
除特殊说明外,指标测定均设3 次平行,结果以平均值±标准差表示。分析肉色、pH值、微生物指标时,以包装方式和贮藏时间及其交互作用为固定效应,牛胴体为随机效应,采用SPSS一般线性模型单变量进行差异显著性分析,多重比较采用Tukey’s法,P<0.05表明数据之间具有显著性差异。
对于微生物多样性结果,对97%相似度的OTU分析其Alpha多样性(Chao 1、ACE和Shannon指数)和Beta多样性。利用样品之间物种的进化信息及物种的丰度信息进行Unifrac分析,将得到的样品之间距离矩阵信息进行主成分分析和热图分析。对测序分析得到的OTU丰度数据进行均一化处理,从细菌的基因组信息得到对应的基因信息及注释信息,再结合均一化的OTU丰度来预测样品中可能存在的各级京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路信息。
2 结果与分析
2.1 牛排贮藏过程中pH值的变化
分析结果表明,包装方式与贮藏时间的交互作用对pH值无显著影响(P>0.05)。由图1可知,两组牛排贮藏初期pH值较为稳定,贮藏7 d后pH值升高,到第21天时pH值显著高于0~7 d(P<0.05)。Karabagias等[10]认为贮藏后期pH值升高可能是蛋白质分解产生NH3和胺类化合物等碱性物质所致,这种现象在一定程度上反映了肉的腐败。

图1 真空包装和50% O2气调包装下牛排pH值的变化趋势Fig. 1 Evolution of pH during storage of beef steaks in vacuum and modified atmosphere
2.2 牛排贮藏过程中色泽的变化
肉色是评价肉品质最直观的指标,也是消费者购买肉时评价肉品新鲜度的首要指标,牛排的褐变通常会让消费者联想到肉的腐败,导致拒绝购买[11]。
在整个贮藏期间,包装方式与贮藏时间交互作用对L*值无显著影响(P>0.05),但贮藏时间对L*值有显著影响(P<0.05)。两组排骨在贮藏过程中L*值呈显著增加的趋势(表2),这是因为贮藏过程中往往伴随着肌肉纤维收缩和蛋白质降解等现象,这会导致肌肉颜色变浅、肌细胞胞外空间增加,且肌细胞胞外空间增加会导致产生更多的光散射和反射,从而使L*值增加[12-14]。

表2 真空包装和50% O2气调包装下牛排色泽的变化趋势Table 2 Evolution of color parameters during storage of beef steaks in vacuum and modified atmosphere
肉的颜色主要由氧合肌红蛋白(oxymyoglobin,Oxy-Mb)、脱氧肌红蛋白(deoxymyoglobin,Deo-Mb)和高铁肌红蛋白(metmyoglobin,Met-Mb)的浓度和比例决定[15]。表2结果表明,包装方式对a*值和b*值均有显著影响(P<0.05)。相比于真空包装组,50% O2气调包装牛排具有更高的a*值和b*值,这是因为50% O2的含氧环境有利于形成Oxy-Mb,使肉呈现鲜红色[16]。Esmer[4]和Raines[17]等研究也指出a*值的降低反映了肉红色的损失,与Met-Mb的形成以及肉色从鲜红色转变为棕褐色密切相关。O’Sullivan等[18]的研究表明,b*值与肉类褐变以及肉类感官评定中的评分呈负相关性,b*值的下降表明Met-Mb的形成。研究认为,气调包装的牛排,如果贮藏后期包装中氧的浓度下降,当牛排表面的氧分压降低到有利于Met-Mb形成的范围时,可以加速Met-Mb的积累[19]。Bevilacqua等[20]认为一旦菌落总数超过7(lg(CFU/g)),肉表面的氧分压就会由于微生物的呼吸耗氧而快速降低,从而加速肉的褐变。真空包装牛排虽然不存在氧浓度降低的问题,但是其本身很低的氧分压以及后期快速增长的微生物数量同样有影响。
2.3 牛排贮藏过程中微生物的变化
如表3所示,在本研究中,各微生物的数量在牛排贮藏期间均呈现上升趋势。新鲜牛排的初始菌落总数为3.71(lg(CFU/g)),属于正常水平[8]。菌落总数、乳酸菌数和假单胞菌数在前7 d内整体上无显著变化,7 d之后显著增加(P<0.05)。50% O2气调包装组菌落总数贮藏期间低于真空包装组,且在贮藏末期具有显著性差异(P<0.05)。

表3 真空包装和50% O2气调包装牛排贮藏期间微生物的变化Table 3 Evolution of microbial counts during storage of beef steaks in vacuum and modified atmosphere lg(CFU/g)
乳酸菌是一类兼性厌氧革兰氏阳性菌,无论有氧无氧条件都可生存[8]。许多研究表明,高浓度的二氧化碳对乳酸菌没有显著的抑制作用,所以乳酸菌通常能适应气调包装环境,这也使得乳酸菌成为气调包装肉中菌群的重要组成部分[21]。然而在本研究中,贮藏14 d后50% O2气调包装牛排中的乳酸菌数显著低于真空包装组(P<0.05)。这可能是因为高浓度的氧在微生物体内产生大量的活性氧自由基,导致微生物蛋白氧化损伤,对微生物产生毒害作用,致使微生物死亡[22]。
假单胞菌是专性好氧革兰氏阴性菌,是生肉有氧冷藏条件下的优势菌群。但在本研究贮藏后期,50% O2气调包装牛排中的假单胞菌数显著低于真空包装组(P<0.05)。Lorenzo等[23]发现真空包装和80% O2气调包装的马驹肉中假单胞菌数差异不显著(P>0.05),而30% O2气调包装组(30% O2+70% CO2)肉中的假单胞菌数显著低于真空包装和80% O2气调包装组样品(P<0.05),这与本研究结果类似。CO2浓度对膜流动性、细胞内酶促反应过程以及代谢反应等有直接影响[24-27]。CO2的溶解可能是气调包装抑制假单胞菌生长的主要原因之一。总而言之,O2和CO2对假单胞菌的生长都有影响,但50% O2气调包装抑制假单胞菌的主要原因还需要进一步研究。
热死环丝菌是一种兼性厌氧微生物,是气调包装肉类和海鲜产品的优势菌群[28]。随着贮藏时间的延长,热死环丝菌数显著上升(P<0.05),两种包装的热死环丝菌数在整个贮藏时间内差异不显著(P>0.05)。Lopez-Galvez等[29]研究表明,当氧气体积分数高于0.2%时,CO2对热死环丝菌的抑制效果会显著降低,另一项研究则显示,真空包装中残留的氧气可以促进热死环丝菌的生长[30]。总体看来,50% O2气调包装和真空包装对热死环丝菌的抑菌作用差异不显著(P>0.05),影响其在肉中生长和代谢的因素也较为复杂,需要进一步研究探索。
肠杆菌科是一类兼性厌氧革兰氏阴性菌,其中的大肠菌群数常作为检测肉类被粪便污染程度的指标。贮藏前7 d,两种包装的肠杆菌数略有增加,但差异不显著(P>0.05);7 d之后,肠杆菌数显著增加(P<0.05)。Berruga等[31]发现,只有当CO2体积分数高于40%时,CO2才能抑制肠杆菌的生长。因此,CO2对肠杆菌的抑菌作用需要进一步研究。此外,本研究中肠杆菌科初始数量为3.26(lg(CFU/g)),高于之前的研究结果[31],这可能也是导致气调包装对肠杆菌科抑制不显著的重要原因。
2.4 牛排贮藏过程中微生物多样性分析结果
如表4所示,真空包装组样本的有效测序量在43 810~52 919之间,而50% O2气调包装组样本的有效测序量则在43 058~57 881之间。此外,本研究还分析了OTU数、ACE指数、Chao1指数和Shannon指数。其中OTU数与微生物种类相关,OTU数越多则表明测序样品中的微生物种类越多。ACE指数和Chao1指数反映了样品中微生物群落的物种丰度,单指群落中物种的数量,而不考虑群落中每个物种的丰度分布情况。与ACE指数和Chao1指数不同,Shannon指数则反映群落的多样性。一般Chao1指数、ACE指数和Shannon指数越高,说明样品的微生物多样性越丰富。
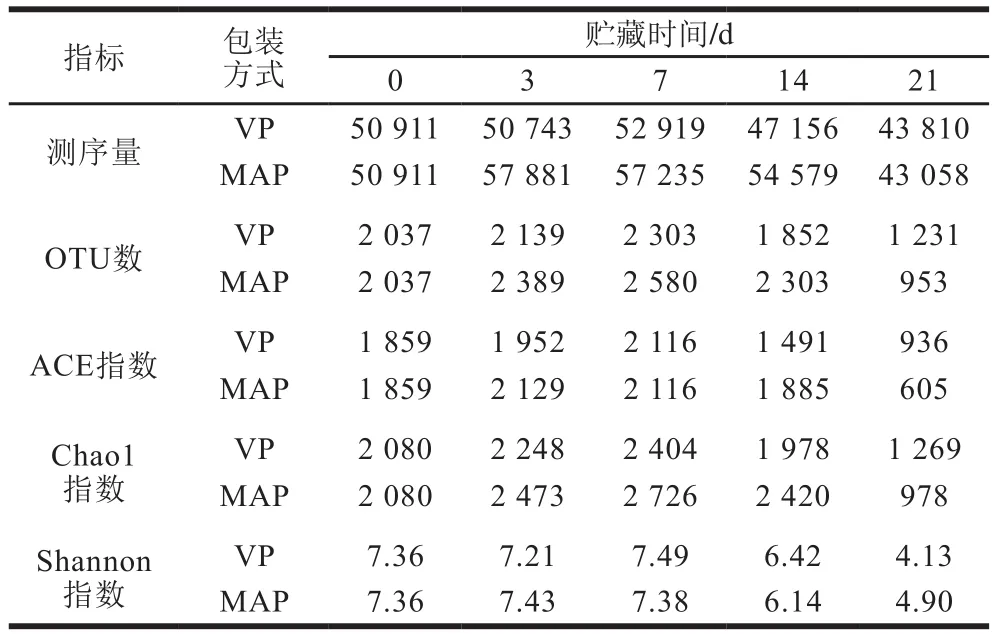
表4 贮藏期间气调包装与真空包装牛排测序的微生物群落物种丰度及多样性Table 4 Species richness and diversity of bacterial community in beef steaks during storage in vacuum and modified atmosphere
整个贮藏期间,气调包装和真空包装牛排测序样本的OTU数、Chao1指数、ACE指数和Shannon指数均呈先上升后下降的趋势,这意味着随着贮藏时间的延长,两种包装环境下的微生物多样性先升高再降低。这是因为肉中的初始微生物种类繁多,在适应环境之后会大量增殖;但随着贮藏时间延长,一部分微生物在竞争中取得优势大量繁殖并抑制了其他微生物的生长,最终成为优势菌群[32]。此外,50% O2气调包装组在贮藏21 d时的OTU数、ACE指数和Chao1指数均低于真空包装组,这表明贮藏结束时50% O2气调包装牛排的微生物多样性要小于真空包装组。
对不同贮藏时间的真空包装和气调包装牛排中的微生物基因进行测序,共检测到37 个门的微生物,其中相对丰度大于1%的有变形菌门(Proteobacteria)、放线菌门(Acfinobacteria)、拟杆菌门(Bacteroidetes)和异常球菌-栖热菌门(Deinococcus-Thermus)。由图2A可知,在贮藏前14 d,无论真空包装还是50% O2气调包装的牛排中,最主要的菌群都是变形菌门(相对丰度均大于50%),但是到贮藏期结束时,该菌群被厚壁菌门(Firmicutes)代替,厚壁菌门成为气调包装和真空包装牛排中的优势菌群,这可能是由于贮藏14 d之后热死环丝菌和乳酸菌快速增殖所致,这两个菌属都属于厚壁菌门。

图2 贮藏期间气调包装和真空包装牛排微生物群落的相对丰度Fig. 2 Relative abundance of bacterial community in beef steaks during storage in vacuum and modified atmosphere
由图2B可知,在属水平上,初始微生物群落主要由不动杆菌属(Acinetobacter)(15.24%)、苍白杆菌属(Ochrobactrum)(9.00%)、栖热菌属(Thermus)(8.05%)和金黄杆菌属(Chryseobacterium)(4.31%)等组成。这些微生物主要来源于肉牛的养殖环境和牛排生产的屠宰加工环境,例如土壤、水源和屠宰器械等污染源[33-34]。肉食杆菌(Carnobacterium)是一种异源发酵菌,能产生与真空包装肉品腐败有关的丁酸和硫化物。在本研究的真空包装组中,肉食杆菌属相对丰度在前7 d增长并不明显,但从第14天开始迅速增加并于第21天达到最大值(62.5%),成为最主要的优势菌。这说明肉食杆菌在贮藏后期的真空包装中具有更大的竞争优势,这也与之前的研究结论[35]类似。
不同于真空包装组,50% O2气调包装组的优势菌群演变趋势更为复杂,前7 d各种菌的相对丰度差异并不明显,假单胞菌属(Pseudomonas)和不动杆菌属相对丰度较高;但从第14天开始,环丝菌属(Brochothrix)相对丰度迅速上升。在贮藏后期(21 d),环丝菌属(Brochothrix)(41.9%)、沙雷氏菌属(Serratia)(22.0%)和乳杆菌属(Lactobacillus)(15.8%)成为50% O2气调包装组的优势菌群,这3 种菌的比例超过了79%。热死环丝菌通常被认为是含氧包装肉类的主要腐败微生物[36]。本研究中,虽然环丝菌属在初始菌中的相对丰度很低,但随着贮藏时间的延长,当其他微生物的生长消耗了包装内的氧气造成局部低氧时,热死环丝菌能首先利用葡萄糖作为生长基质并快速生长[37]。因此,随着贮藏时间延长,环丝菌属相对丰度越来越高,最终成为了50% O2气调包装贮藏后期的最大优势菌群。乳杆菌属同样是50% O2气调包装组贮藏后期的优势菌群之一,随着其优势地位的增强还会对其他菌群产生抑制作用,但在本研究中即使到了贮藏末期其相对丰度仍大大低于环丝菌属,并不能对环丝菌属起到很大的抑制作用。沙雷氏菌属属于肠杆菌科,常见于气调包装的生肉中,其与动物生活的环境密切相关,所以很容易进入肉类加工生产链中。Carrizosa等[9]发现沙雷氏菌是导致高氧包装肉类腐败的优势菌群之一,与本研究得出的结果类似。
本研究对气调包装和真空包装牛排的微生物DNA测序数据进行了主成分分析和热图分析,进一步揭示了其在贮藏期间的微生物群落结构变化。从主成分分析结果(图3)可以看出,第一主成分(PC1)、第二主成分(PC2)的贡献率分别为56.20%、26.29%,二者之和大于80%。贮藏前7 d,真空包装和50% O2气调包装牛排中的微生物群落结构并无明显不同,14 d之后两种包装牛排中的微生物群落结构开始出现较大差异。这表明贮藏7 d后优势菌群发生了变化,最终导致肉品腐败的关键微生物可能也发生了改变。
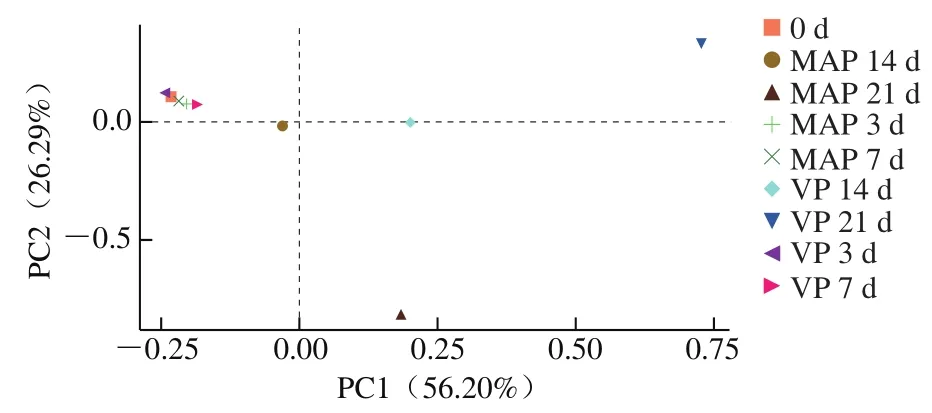
图3 气调包装和真空包装牛排贮藏期间微生物群落的主成分分析Fig. 3 Principal component analysis plot for the microbial community in beef steaks during storage in vacuum and modified atmosphere
通过热图分析(图4)可知,50% O2气调包装中环丝菌属、沙雷氏菌属和乳杆菌属聚类在一起,且这3 种菌对应的OTUs相对含量在整个群落OTUs中最高,表明它们是50% O2气调包装牛排贮藏期间的主要优势菌群。肉食杆菌属和哈夫尼菌属在真空包装组中被聚类到了一起,这表明它们是真空包装牛排贮藏后期的优势菌群。类似的,热图分析把前7 d的所有样本聚类在了一起,14 d后的样本聚类在了一起,这表明7~14 d的贮藏过程中牛排的微生物菌落结构发生了重大改变,这也与主成分分析结果相同。

图4 气调包装与真空包装牛排贮藏期间的微生物群落热图分析Fig. 4 Heat map showing the microbial community composition of beef steaks during storage in vacuum and modified atmosphere
微生物代谢对肉腐败的影响与肉贮藏环境密切相关。与肉腐败相关的微生物大多优先利用葡萄糖,并产生代谢物。本实验对气调包装与真空包装牛排中的微生物群落进行了宏基因组功能预测,研究了贮藏期间牛排的腐败过程及机制。从图5可以看出,在贮藏过程中,与碳水化合物代谢相关基因和蛋白质代谢相关基因的数量明显高于其他代谢过程。贮藏前7 d,两种包装下牛排中的微生物的蛋白质代谢基因数量差异并不明显。而贮藏到第21天时,相比于真空包装组,50% O2气调包装牛排中的微生物群落中,涉及碳水化合物代谢的基因数量更低,涉及蛋白质代谢的基因数量更多。这说明贮藏后期,50% O2气调包装牛排中微生物群落具有比真空包装牛排中微生物群落更低的糖代谢水平和更高的蛋白质降解能力。

图5 气调包装和真空包装牛排在贮藏期间微生物群落的代谢功能预测Fig. 5 Predicted metabolic function of the microbial community in beef steaks stored in different packages for different periods of time
肉食杆菌通常会出现在贮藏初期的真空包装牛排中,并在其微生物菌群结构中占主导地位,但随着贮藏时间延长通常会被其他乳酸菌所取代[38]。但是,Casaburi等[39]发现肉食杆菌是真空包装冷鲜牛排贮藏末期的主要优势菌群,且相对丰度达到了80%,与本研究结果十分相似。作为乳酸菌的特殊分支,肉食杆菌属是一类可以分解多种碳水化合物为自身代谢供能的细菌[40],图5也表明贮藏后期真空包装组牛排中微生物群落的碳水化合物代谢水平较高,这与肉食杆菌是真空包装牛排贮藏后期的主要优势菌群密切相关。
不同于肉食杆菌,在肉贮藏初期热死环丝菌仅能代谢葡萄糖,当葡萄糖消耗完之后会转而分解蛋白质,利用氨基酸来供能[39]。因为贮藏后期50% O2气调包装牛排中微生物的蛋白质代谢水平高于真空包装组,这表明在贮藏期间50% O2气调包装牛排中微生物对于蛋白质的代谢大于真空包装组。Braun等[41]研究指出,热死环丝菌的胞外分泌物含有较高的蛋白酶活性,这表明热死环丝菌具有较高的蛋白质分解能力,能够降解蛋白质为自身供能,这或许是50% O2气调包装微生物群落具有更高蛋白质降解能力的原因。
3 结 论
与真空包装相比,50% O2气调包装具有更好的护色能力和抑菌效果。随着贮藏时间的延长,气调包装和真空包装牛排中的微生物从贮藏初期的变形菌门转变为贮藏后期的厚壁菌门。在属水平上,牛排的初始微生物群落主要由不动杆菌属、苍白杆菌属、栖热菌属和金黄杆菌属组成,随着贮藏时间的延长,肉食杆菌属成为真空包装牛排中的优势菌群,而环丝菌属、沙雷氏菌属和乳杆菌属成为50% O2气调包装牛排的优势菌群;贮藏7~14 d是牛排中微生物种类产生变化的关键时间点。与真空包装牛排相比,50% O2气调包装牛排中的微生物群落具有较低的糖代谢和较高的蛋白质代谢能力。本研究明确了50% O2气调包装对贮藏过程中牛排品质和微生物的影响,探明了50% O2气调包装和真空包装贮藏过程中微生物的演替、微生物演替关键时间点和代谢异同,为开发牛排贮藏技术提供了科学参考。

