低磷胁迫对崖州硬皮豆生长及酸性磷酸酶活性的影响
黄 杰, 张郎织, 邢玉芬, 邹晓燕, 刘国道, 虞道耿*, 陈志坚*
(1. 中国热带农业科学院热带作物品种资源研究所/农业农村部华南作物基因资源与种质创制重点实验室, 海南 海口 571101;2. 海南大学热带作物学院, 海南 海口 570228)
磷(Phosphorus,P)是植物生长发育所必需的大量营养元素之一,是组成脱氧核糖核酸、腺苷三磷酸和脂质等物质的重要元素[1-2]。并且,磷参与植株光合作用、呼吸作用、能量代谢和信号传递等关键的生理生化过程,调控植物正常的生长发育[3-5]。在自然界中,土壤中的磷主要以难溶性无机磷和有机磷形式存在,不能被植物直接吸收和利用[6]。因此,缺磷胁迫会导致植物出现一系列的症状,如植株矮小,生长缓慢,叶色暗绿和根系发育受阻等,从而严重限制了作物的生长和产量[7]。在传统农业生产中,虽然通过施用磷肥可以有效的促进作物生长和增加产量,但是,过量施肥可能会导致磷肥流失、水体富营养化和土壤生产力降低等问题[8]。因此,培育磷高效吸收和利用的作物品种是降低磷肥投入的重要举措。
为了适应低磷胁迫环境,植物在进化过程中形成了多种调节磷吸收和磷平衡的策略。例如,通过改变根系形态和构型增加与土壤的接触面积[9-10]、通过诱导高亲和磷转运蛋白的表达来提高根系对土壤磷的吸收[11]、通过分泌有机酸和酸性磷酸酶(Acid phosphatase,ACP)来活化利用土壤难溶性有机磷[12-13]、通过调控磷信号网络维持细胞磷平衡[14]。ACP是一种能水解单磷酸酯键释放无机磷的水解酶类,其活性的提高被认为是植物适应低磷胁迫的重要机制[15]。一般认为,植物根系分泌的酸性磷酸酶能够水解土壤有机磷,增加植物对土壤有机磷的利用[16]。另外,酸性磷酸酶也能活化利用植物组织中的有机磷,促进磷的再利用[17]。研究表明,低磷胁迫显著增加了水稻(Oryzasativa)、大豆(Glycinemax)、鹰嘴豆(Cicerarietnum)和拟南芥(Arabidopsisthaliana)等植物的酸性磷酸酶活性,从而有助于促进植物对磷的活化利用[18-21]。
‘崖州硬皮豆’(‘Macrotylomauniflorum(Lam.) Verdc. Yazhou’)为豆科硬皮豆属一年生草本植物,茎叶柔软,适口性好,营养价值高,是草食家畜的优质饲料。‘崖州硬皮豆’于2015年通过全国草品种审定委员会审定登记为地方品种。‘崖州硬皮豆’具有根系发达、抗旱和耐贫瘠等特点,被认为是优良的豆科绿肥,也是常规和基因工程育种的潜在材料[22]。然而,以往研究主要对硬皮豆的生物学特性和栽培技术进行了摸索,对硬皮豆响应低磷胁迫的研究未见报道,对其适应低磷胁迫的生理机制了解甚少。因此,本研究以‘崖州硬皮豆’为材料,通过分析不同外源磷浓度处理对硬皮豆生长和酸性磷酸酶活性等生理特性的影响,以探讨硬皮豆响应低磷胁迫的可能机制。
1 材料与方法
1.1 试验材料
‘崖州硬皮豆’种子由中国热带农业科学院热带作物品种资源研究所热带牧草研究室提供。
1.2 试验方法
1.2.1植物材料培养与处理 参考贾怡丹等[23]方法,将硬皮豆种子在湿润的滤纸上萌发5 d后,长成的幼苗在1/2 Hoagland营养液中预培养15 d,对幼苗进行3个不同磷浓度水培处理[24],磷浓度分别为5 μM,100 μM和250 μM KH2PO4,每个处理包括4个生物学重复。处理21 d后,收获地上部和根部样品,测定生物量、根系性状、磷含量和酸性磷酸酶活性。样品于75℃烘干,待烘干到恒重时测定干重和磷含量。收取成熟叶片和根系材料,用液氮速冻,用于测定细胞壁磷含量以及酸性磷酸酶活性。
1.2.2叶片及根系性状分析 通过扫描仪12000XL(EPSON,中国)扫描叶片和根系图片,采用图像分析软件WinRhizo Pro(Regent Instruments,加拿大)计算叶面积、总根长、根表面积和根体积[25]。
1.2.3植株磷含量测定 将硬皮豆地上部和根系样品置于烘箱中105℃杀青30 min,75℃烘干至恒重,将样品磨碎,称取0.1 g干样,加入3 mL浓硫酸静置过夜,375℃消煮2 h,然后参照Murphy和Riley[26]方法测定磷含量,即取500 μL上清液,加入0.5 mL钼锑抗显色液,再用ddH2O定容到5 mL,室温反应30 min后,于分光光度计(Hitachi,日本)中测定OD700吸光值。
1.2.4可溶性磷含量测定 称取0.16 g地上部或根部系样品,加入预冷的1.2 mL 100 mM Tris-HCl(pH 7.0)提取液,充分研磨,4℃下12 000 rpm离心20 min,收集上清液。然后参照Murphy和Riley[26]用钼锑抗显色法测定磷含量。
1.2.5细胞壁分离和细胞壁磷含量测定 参考Zhu等[27]方法分离细胞壁,并作适当修改,即称取0.15 g叶片和根系样品,加入预冷的1 mL 75%乙醇充分研磨破碎组织细胞,冰浴20 min,4℃下12 000 rpm离心15 min后,去上清,收集沉淀。然后,依次用预冷的丙酮、乙醇/三氯甲烷混合液(v/v=1/1)、甲醇洗涤沉淀。每一步洗涤完成后,4℃下12 000 rpm离心15 min,并最终收集沉淀为细胞壁提取物。称取5 mg细胞壁提取物,加入1 mL 2 mM HCl,于摇床上震荡混匀48 h。4℃下14 000 rpm离心30 min,收集上清液。取100 μL上清液用钼锑抗显色法测定细胞壁磷含量。细胞壁磷含量以单位鲜重细胞壁(mg CW)所含的磷(μg P)来计算。
1.2.6细胞壁蛋白的提取以及酸性磷酸酶(ACP)活性测定 参照Farhadi等[21]方法提取细胞壁蛋白,称取0.16 g样品,加入预冷的1.5 mL 25 mM TES/KOH缓冲液(含10 mM MgCl2,1 mM EDTA,1 mM二硫酥糖醇,1% Triton X-100,1%聚乙烯吡咯烷酮,pH 7.4)充分研磨,4℃下14 000 rpm离心30 min收集沉淀,然后用TES/KOH缓冲液重复洗涤沉淀3次。4℃下14 000 rpm离心30 min收集沉淀。加入预冷的1.5 mL 0.5 mM醋酸/NaOH缓冲液(含0.2 M CaCl2,pH4.6)充分研磨,4℃下18 000 rpm离心30 min,收集蛋白上清液。参照Mehdi等[13]方法测定ACP活性,取100 μL蛋白上清液,加入1.8 mL磷酸酶底物缓冲液,缓冲液含有45 mM醋酸/醋酸钠(pH 5.0)和1 mM对硝基苯磷酸环己胺(ρ-NPP),补充ddH2O至反应体积2 mL,充分混匀,37℃反应15 min,然后加入1 mL 1 M NaOH溶液终止反应。12 000 rpm离心5 min,收集上清液,测定OD405吸光值,ACP活性以每分钟每毫克蛋白水解ρ-NPP的量(μmol)计算。
1.3 数据统计分析
数据采用Microsoft Excel 2010进行平均数和标准误计算,采用SPSS数据分析软件(V23.0,SPSS Institute,美国)进行方差分析。
2 结果与分析
2.1 不同磷浓度处理对硬皮豆地上部生长的影响
从图1A可以看出,相对100 μM和250 μM磷处理,5 μM低磷处理抑制了硬皮豆地上部的生长和发育,主要表现为植株矮小、复叶数减少、叶片发育受阻。与100 μM和250 μM磷处理相比较,低磷(5 μM)处理下的硬皮豆株高分别降低31.2%和19.7%,复叶数减少47.4%和60%,叶面积减少28.4%和22.4%(图1B-D)。另外,在100 μM磷处理下的株高和叶面积最大,而250 μM磷处理下的复叶数最多(图1B-D)。以上结果表明,5 μM低磷胁迫显著抑制了硬皮豆地上部的生长,而100~250 μM磷浓度处理能维持硬皮豆正常生长。
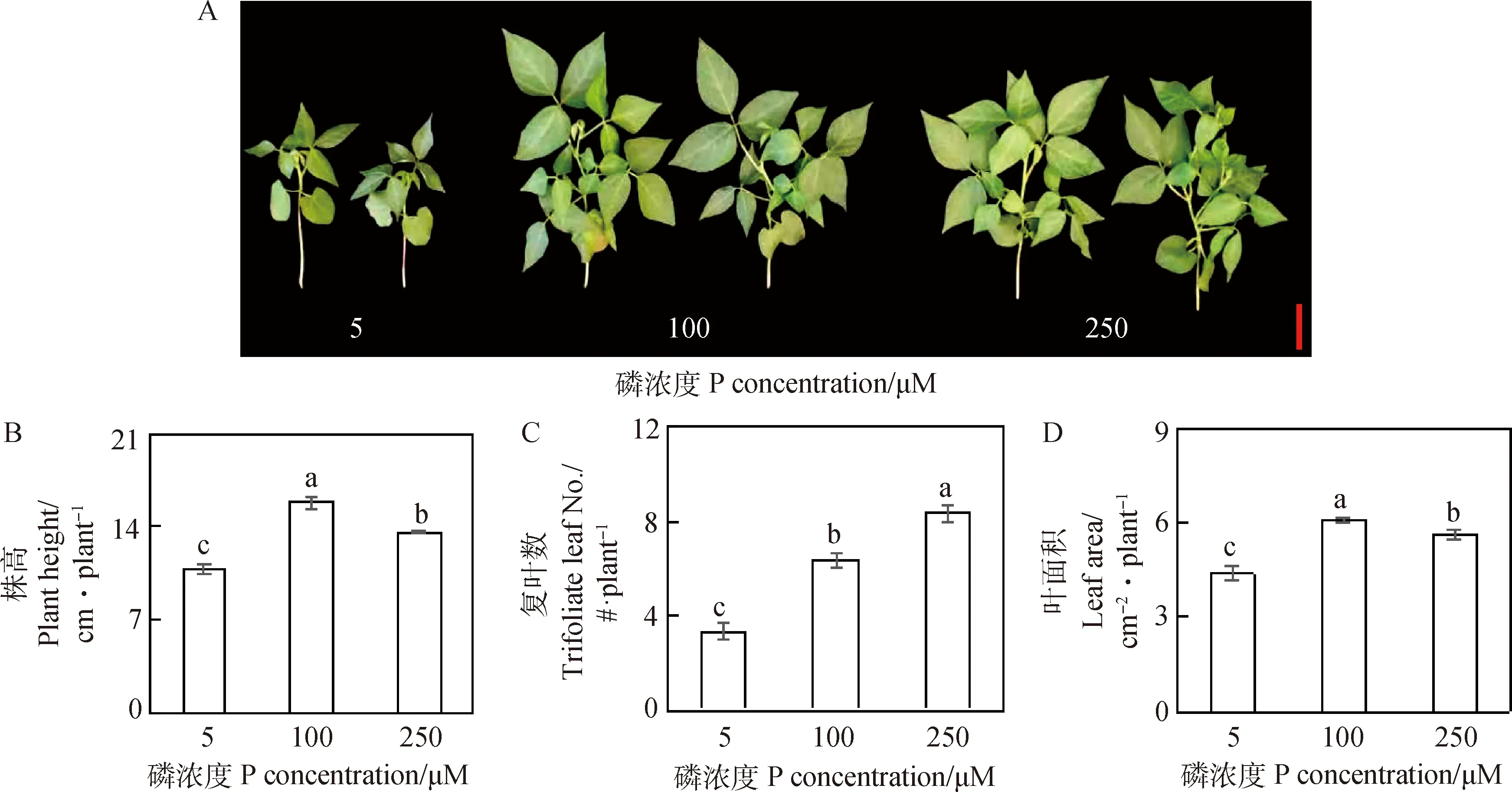
图1 不同磷浓度处理对硬皮豆地上部生长的影响
2.2 不同磷浓度处理对硬皮豆根系生长的影响
由图2A所示,5 μM磷处理抑制了硬皮豆根系的生长,主要抑制了总根长、根表面积和根体积。与100 μM和250 μM磷处理相比,5 μM磷处理下硬皮豆总根长分别下降30.7%和35.9%,根表面积减少32.4%和36.8%,根体积下降31.9%和37.9%(图2B-D)。然而,5 μM磷处理促进了硬皮豆主根的生长,5 μM磷处理下的主根长是100 μM和250 μM磷处理下的1.2 倍(图2E)。
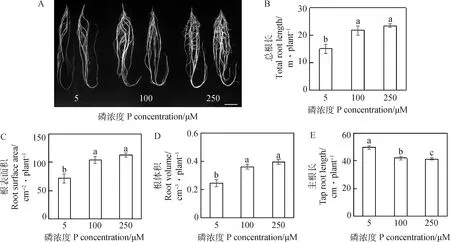
图2 不同磷浓度处理对硬皮豆根系生长的影响
2.3 不同磷处理对硬皮豆干重及磷含量的影响
由图3所示,5 μM低磷处理显著降低了硬皮豆地上部和根部干重。在5 μM磷处理下,硬皮豆地上部和根部干重分别只有250 μM磷处理下的37.7%和68.9%,而硬皮豆地上部或根部干重在100 μM和250 μM磷处理下,差异不显著(图3A和B)。此外,5 μM磷处理显著降低了地上部和根部磷含量。与250 μM磷处理相比,5 μM磷处理下的地上部和根系含量分别减少了80.3%和77.3%(图3C和D)。100 μM和250 μM磷处理间,地上部磷含量差异不显著;然而,在250 μM磷处理下根部的磷含量是100 μM磷处理下的1.4倍(图3C和D)。
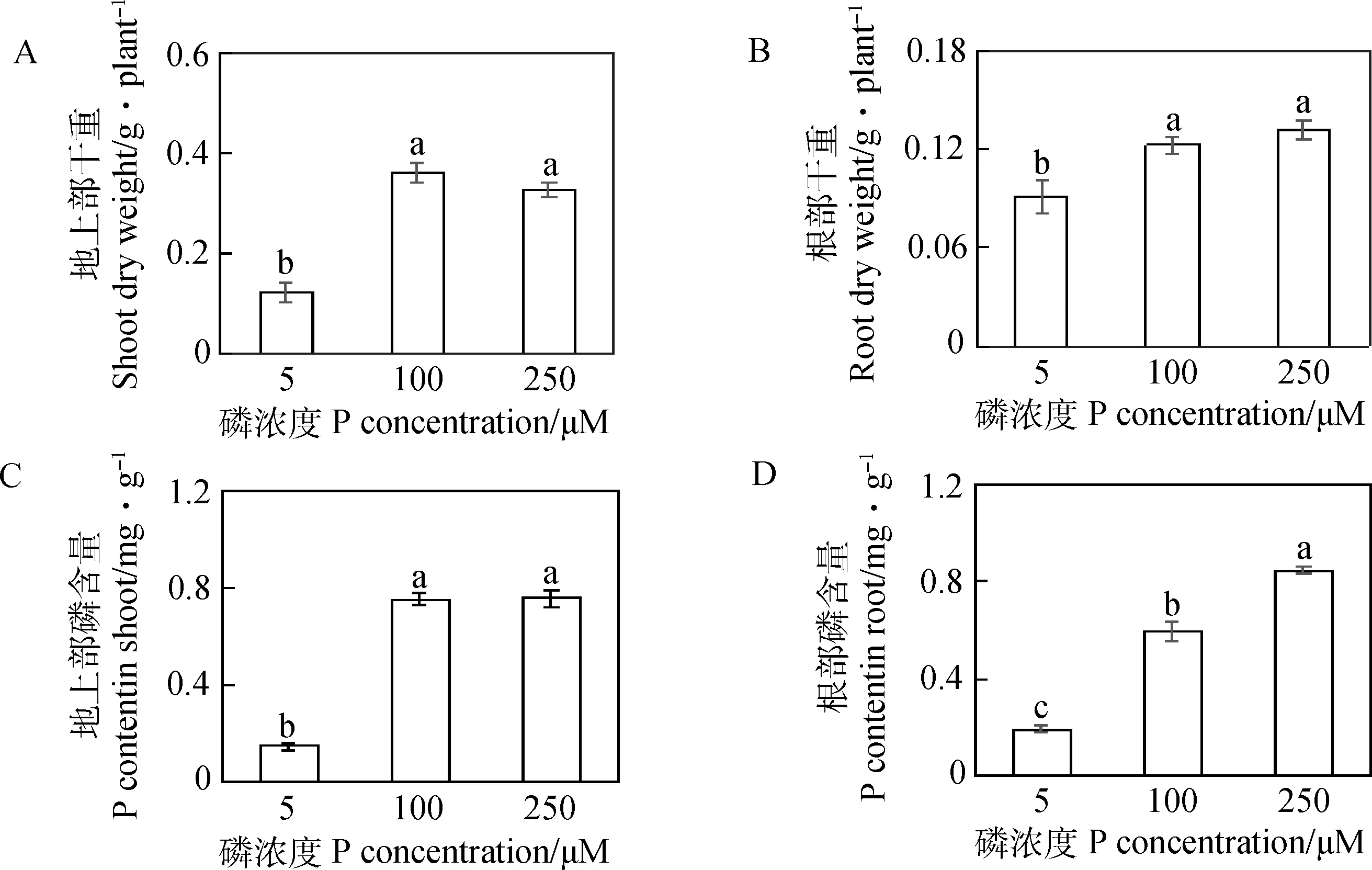
图3 不同磷处理对硬皮干重及磷浓度的影响
2.4 不同磷浓度处理对硬皮豆叶片和根系可溶性磷及细胞壁磷浓度的影响
本研究进一步比较分析了不同磷浓度处理对硬皮豆叶片和根系可溶性磷及细胞壁磷浓度的影响。结果表明,5 μM低磷处理显著降低了硬皮豆叶片和根系的可溶性磷浓度(图4)。5 μM磷处理下的叶片和根系可溶性磷浓度分别为250 μM磷处理下的10.4%和9.7%,然而,叶片或根系可溶性磷浓度在100 μM和250 μM磷处理下差异不显著(图4A和B)。同样,5 μM磷处理显著降低了叶片和根系细胞壁磷浓度。5 μM磷处理下的叶片和根系细胞壁浓度分别为250 μM磷处理下的2.1%和20.9%(图4C和D)。此外,250 μM磷处理下叶片和根系细胞壁磷浓度显著高于100 μM磷处理下的叶片和根系细胞壁磷浓度(图4C和D)。

图4 不同磷处理对硬皮豆可溶性磷及细胞壁磷浓度的影响
2.5 不同磷浓度处理对硬皮豆叶片和根系及其细胞壁ACP活性的影响
由图5A和B可知,随着磷处理浓度的增加,硬皮豆叶片和根系总ACP活性逐渐降低,5 μM磷处理显著提高了叶片和根系ACP活性。在5 μM磷处理下,叶片、根系ACP活性分别是100 μM和250 μM磷处理下的1.4,1.6倍和1.4,1.5倍。硬皮豆叶片和根系细胞壁ACP活性随磷处理浓度的增加而降低。在5 μM磷处理下,叶片细胞壁ACP活性最高,是250 μM磷条件下的1.2倍,而根系细胞壁ACP活性是250 μM磷条件下的1.3倍(图5C和D)。
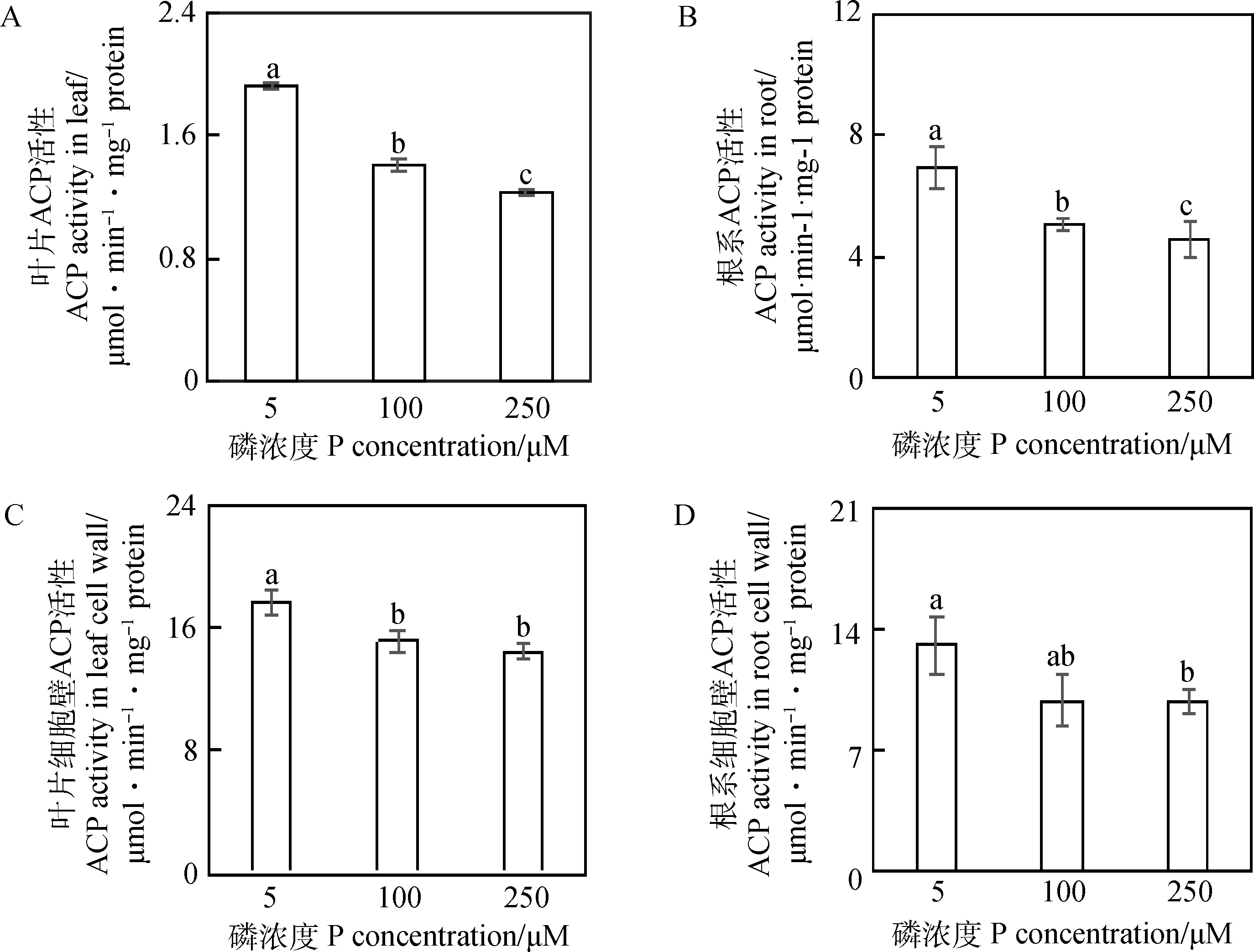
图5 不同磷处理对崖州硬皮豆叶片和根系及其细胞壁ACP活性的影响
3 讨论
磷是维持植物正常生长发育所必需的营养元素之一,低磷胁迫抑制植物的生长和产量。本研究发现,相对100 μM和250 μM磷处理,5 μM低磷处理显著抑制了硬皮豆的生长,降低了株高、复叶数和叶面积,并降低了植株干重(图1-2)。同样,低磷处理也抑制了小麦(Triticumaestivum)[28]、柳枝稷(Panicumvirgatum)[29]和玉米(Zeamays)[30]的生长,说明硬皮豆的生长受到外源磷有效性的影响。另外,100 μM和250 μM外源磷处理下硬皮豆地上部的磷含量差异不显著,但是,100 μM磷处理下根部的磷含量显著低于250 μM磷处理下的磷含量(图3)。在玉米(Zeamays)中的研究也发现,磷被根系吸收后会向叶片转运,并在叶片中积累[31]。因此,在低磷胁迫下,硬皮豆根系吸收的磷可能被转运至地上部,优先满足地上部生长对磷素的需求。
在应对低磷胁迫过程中,植物形成了如改变根系形态构型等适应性机制,进而增加了对土壤磷的吸收和利用[9]。研究发现,在大豆和玉米中,低磷胁迫会促进主根的生长来扩大根系与土壤的接触面积,从而提高磷的吸收效率[32-33],而白羽扇豆(Lupinusalbus)会通过减少主根长度,增加侧根数量和密度,并形成排根来应对低磷胁迫[34]。同样,本研究发现,虽然5 μM低磷处理抑制了硬皮豆总根长、根表面积和根体积,但是,低磷处理促进了主根的生长(图2),这可能有利于硬皮豆吸收更多的磷。
在低磷胁迫下,植物可以通过分泌酸性磷酸酶来活化利用土壤和植物组织中的有机磷,从而增加细胞磷有效性[19]。本研究发现,低磷处理显著提高了硬皮豆叶片和根系总ACP活性(图5)。同样,低磷胁迫也显著增加了水稻、大豆和鹰嘴豆等植物的ACP活性[18-20]。另外,随着叶片和根系细胞壁磷有效性的降低,硬皮豆叶片和根系细胞壁ACP活性显著提高(图4和5),暗示硬皮豆组织中的细胞壁磷可能被活化,并进一步被代谢活动所利用。在柱花草(Stylosanthesguianensis)中的研究发现,低磷胁迫显著增加了叶片和根系细胞壁的ACP活性,且磷高效柱花草基因型中细胞壁ACP活性显著高于磷低效柱花草基因型[35]。并且,在大豆和拟南芥中已经鉴定到了多个细胞壁定位的ACP[19,36]。因此,增加ACP活性可能是硬皮豆适应低磷胁迫的重要生理变化。
4 结论
综上所述,本研究发现低磷胁迫抑制了硬皮豆的株高、复叶数、叶面积等,并降低了植株磷含量和细胞壁磷浓度,从而抑制植株的生长。在低磷胁迫条件下,硬皮豆可以通过促进主根生长、提高叶片和根系总酸性磷酸酶活性,以及增加叶片和根系细胞壁的酸性磷酸酶活性来适应低磷胁迫环境。增加酸性磷酸酶活性可能有利于硬皮豆对细胞中贮存磷的活化利用,从而满足植株生长对磷元素的需求。本研究结果为选育磷高效利用的硬皮豆新品种提供了重要的理论依据。

