谷子RNA干扰相关酶类基因家族的鉴定与分析
张司雯,邓 欣,王 龙,罗皓天,王禹茜,王 月,李清竹,王红艳
(辽宁大学生命科学院/ 植物表观遗传与进化实验室,辽宁沈阳 110036)
RNA 干扰(RNA interference,RNAi)现象普遍存在于动物和植物中,是一种在进化上高度保守的基因表达调节机制。其是在3种核心酶类的作用下,利用双链RNA(double-stranded RNA,dsRNA)诱导形成的小RNA(small RNA, sRNA),对目标序列的mRNA进行降解从而特异性地阻断或抑制相应基因表达的过程[1-2]。与RNA 干扰相关的酶类主要包含三大类:Dicer 酶、Argonautes(AGO)蛋白家族、RNA 依赖的RNA 聚合酶(RNA-dependent RNA polymerases,RDRs),分别参与RNA 干扰过程中的启动阶段、效应阶段和扩增阶段[3-4]。其中,RNA 干扰的启动阶段需要通过多种途径产生dsRNA,例如DNA的双向转录途径、自身互补的RNA 折叠途径或异常合成的mRNA 的RNA 依赖性转录途径等[5]。然后,互补的dsRNA 被具有RNaseⅢ型活性Dicers蛋白加工成长度为21~26个核苷酸的小干扰RNA(small interfering RNA, siRNA)或微小RNA (microRNA,miRNA)。其中一条RNA 通过AGO蛋白与沉默效应复合物(RNA-induced silencing complex,RISC)结合,使这些复合物序列具有特异性的导向功能,从而找到与sRNA 互补的靶RNA,进而通过阻断翻译或裂解靶mRNA 而导致靶基因的沉默或阻遏。这些sRNA 还可以通过将组蛋白和/或DNA 甲基转移酶募集到靶基因的调控序列中介导转录基因沉默[5-6]。
目前已知的所有动植物中均存在Dicer、AGO和RDR 基因的多个拷贝,并且部分基因的功能已被阐明[4]。以禾本科为例,水稻(Oryza sativa)中含有8个DCL类基因,分别是OsDCL1a、OsDCL1b、OsDCL1c、OsDCL2a、OsDCL2b、OsDCL3a、OsDCL3b、OsDCL4[4,7]。其中,OsDCL1在水稻miRNA 的加工过程中起到了十分重要的作用[8]。OsDCL3a和OsDCL3b的dsRB(double-stranded RNA‐binding)结构域差异很大,因此有学者建议将其归类为完全不同的第五类Dicer 蛋白[7]。OsDCL4负责正常植物发育所需的21个核苷酸的反式作用干扰小RNA(trans-acting siRNA, ta-siRNA)的加工[8-9],且与水稻穗部的sRNA 生成有关[10]。
AGO蛋白家族是RNA 诱导的沉默复合物中的重要组成部分,该沉默复合物基于序列互补性使目标转录本沉默。水稻中鉴定出了19 种AGO基因[4],在RNAi 和相关途径中起着至关重要的作用,并调节植物的生长和发育[11]。如水稻中的AGO2已经有研究表明在冷胁迫、盐胁迫和干旱胁迫的响应过程中特异上调表达[12]。AGO1和AGO18具有协同抗病毒的能力[13]。OsAGO7控制水稻叶片向上卷曲[14]。此外,OsMEL1是一种独特的AGO蛋白,可能通过由H3K9甲基化介导的染色质修饰来调节生殖细胞的减数分裂以及雌雄配子的正常发育。OsMEL1是否直接与调节性sRNA 相互作用以在染色质上产生所需的改变尚不清楚[4]。水稻SHL2、SHL4/SHO2和SHO1分别编码拟南芥(Arabidopsis thaliana)RNA 依赖性RNA 聚合酶6、AGO7和DICER-like 4的直系同源物,其突变通过ta-siRNA 影响叶片发育以及茎尖分生组织(shoot apical meristem,SAM)的完全缺失或异常形成[15]。OsPNH1作为AGO蛋白家族中的一员,与SAM和叶片的发育有关[16]。
RNA 依赖性RNA 聚合酶(RDRs)由RDR 基因编码,在发育调控、维持基因组完整性和防御外源核酸等方面发挥着重要作用[17]。高等植物已经进化出多个依赖于RNA 的RDRs,其与Dicers(DCL)蛋白共同作用,产生具有特殊分子功能的不同种类的sRNA[10]。水稻中已经报道5个RDRs相关基因[4]。拟南芥中RDR1、RDR2或RDR6功能的丧失可以增强植物对RNA 和DNA 病毒的敏感性[18],水稻中OsRDR6介导的RNAi 途径也与植物对病毒的防御反应以及植物对细菌和真菌病原体的防御有关[19]。
谷子(Setaria italica)是适合于干旱地区种植的重要粮食作物和饲料作物。因其基因组较小(约515 Mb),是二倍体C4类禾本科植物,自花授粉,易栽培,生育周期及繁殖期短,且与水稻基因组具有良好的共线性,因此经常被视作分子遗传学研究的模式作物[20-21]。近年来,随着组学技术的发展,越来越多的谷子品种的基因组测序工作已经完成,如xiaomi、Zhanggu、Yugu1、TT8等[22-24],并开发出了多种谷子功能组学综合数据库,如SIFGD和MDSi等[22,25],但是对于谷子表观遗传学的研究仍然较少。因此,本研究以谷子RNA 干扰相关酶类基因为研究对象,通过对两个代表性的谷子品种(xiaomi和Yugu1)进行全基因组筛查与比较基因组学的研究,获得谷子DCL 酶、AGO蛋白家族和RDR 类基因家族所有成员的序列信息,构建系统进化树,并对其进行保守结构域分析和不同组织器官的特异性表达分析,为更深入地开展谷子表观遗传学研究提供理论依据。
1 材料与方法
1.1 供试材料
本试验选取谷子测序品种xiaomi和Yugu1(豫谷1)为研究对象,其基因组信息可在MDSi(http://foxtail-millet.biocloud.net/home)和Phytozome (https://phytozome.jgi.doe.gov/pz/portal.html)中得到。
1.2 试验方法
1.2.1谷子RNA 干扰相关酶类基因的探寻
水稻基因组中RNA 干扰相关酶类基因的氨基酸序列通过文献报道[4]和RGAP(http://rice.plantbio logy.msu.edu/)网站搜索得到,将这些基因序列本身或序列名称在NCBI上校正,再与Phytozome[26]和MDSi[22]网站谷子数据库进行比对,选取相似度最高且E值最低的序列作为谷子中RNA 干扰相关酶类基因的候选序列。
1.2.2蛋白质序列理化性质分析
谷子RNA 干扰相关酶类基因的蛋白质理化性质[氨基酸数、分子量、理论等电点、分子式、脂肪指数、亲水性的平均值(Grand average of hydropathicity,GRAVY)等]的分析使用Protparam (https://web.expasy.org/protparam/)在线工具完成。
1.2.3亚细胞定位预测及分析
利用BUSCA 亚细胞定位网站(http://busca.bioc omp.unibo.it/)对谷子RNA 干扰相关酶类基因的蛋白质序列进行亚细胞定位分析。
1.2.4系统进化树的构建
运 用MEGA X (Molecular Evolutionary Genetics Analysis)软 件 邻 接 法(neighbor-joining method, NJ)对谷子和水稻的DCL 类、AGO类、RDR 类蛋白质序列进行系统进化树分析,boot strap设置为1000,Model/Method 设置为p-distance,其余采用默认参数进行,得到的进化树输出结果在EvolView(https://www.evolgenius.info/evolview/#login)中进行美化。
1.2.5保守结构域分析
使用HMMER (https://www.ebi.ac.uk/Tools/hmmer/)对谷子和水稻RNA 干扰酶类基因的氨基酸序列进行分析,使用AI CS6 (Adobe illustrator CS6)进行绘图。
1.2.6谷子RNA 干扰酶类基因的蛋白质保守基序鉴定及分析
利用MEME 在线网站(http://meme-suite.org/)对谷子RNA 干扰酶类基因的蛋白质序列进行保守基序(Motif)分析。
1.2.7组织特异性表达分析
用于探索xiaomi 谷子中RNA 干扰相关酶类基因的不同组织的表达模式的转录组表达数据在MDSi中获得。Yugu1谷子中RNA 干扰相关酶类基因的不同组织的表达模式的转录组数据在SIFGD上获得(原始序列号为SRR442161、SRR442162、SRR442163、SRR442164)[24-25]。 所 得 的FPKM(Fragments per Kilobase of exon model per million mapped fragments)值在TBtools[27]中的Heatmap中进行可视化,Log Scale 中的Base设置为2.0,LogWith设置为1.0。
2 结果与分析
2.1 谷子RNA 干扰相关酶类基因家族的探寻及基本特征分析
通过同源性探索,共获得24个谷子RNA 干扰相关酶类基因家族序列(表1),其中DCL 类7个(包括SiDCL1a、SiDCL1b、SiDCL1c、SiDCL2、SiDCL3a、SiDCL3b、SiSHO1),AGO类13个(包 括SiAGO1b、SiAGO1c、SiAGO1d、SiAGO2、SiAGO4a、SiAGO4b、SiAGO12、SiMEL1、SiAGO14、SiAGO16、SiSHL4、SiAGO18、SiPNH1),RDR 类4个(包 括SiRDR1、SiRDR2、SiRDR3、SiSHL2)。水稻中3个AGO基因(OsAGO3、OsAGO15、OsAGO17)在谷子中未找到同源序列,在这里不做研究。
通过对24个谷子RNA 干扰相关酶类蛋白序列的分析发现(表1),谷子与水稻的这些同源序列在长度上相近,并且相似性较高,在xiaomi 基因组中,同源序列相似性略高,从53% (SiRDR3/OsRDR3)~91%(SiPNH1/OsPNH1),在Yugu1基因组中,同源序列相似性从50% (SiAGO18/OsAGO18)~91% (SiPNH1/OsPNH1),并且谷子品种间同源基因的整体相似性差异不大,说明谷子间以及谷子与水稻间的这些基因在进化上相对保守,行使的功能较为重要。此外,水稻中的多个蛋白序列,如OsDCL2a和OsDCL2b、OsAGO1a和OsAGO1b、OsAGO13和OsMEL1、OsAGO11和OsAGO12、OsRDR3和OsRDR4与谷子比对后,只能对应到谷子的同一个序列。
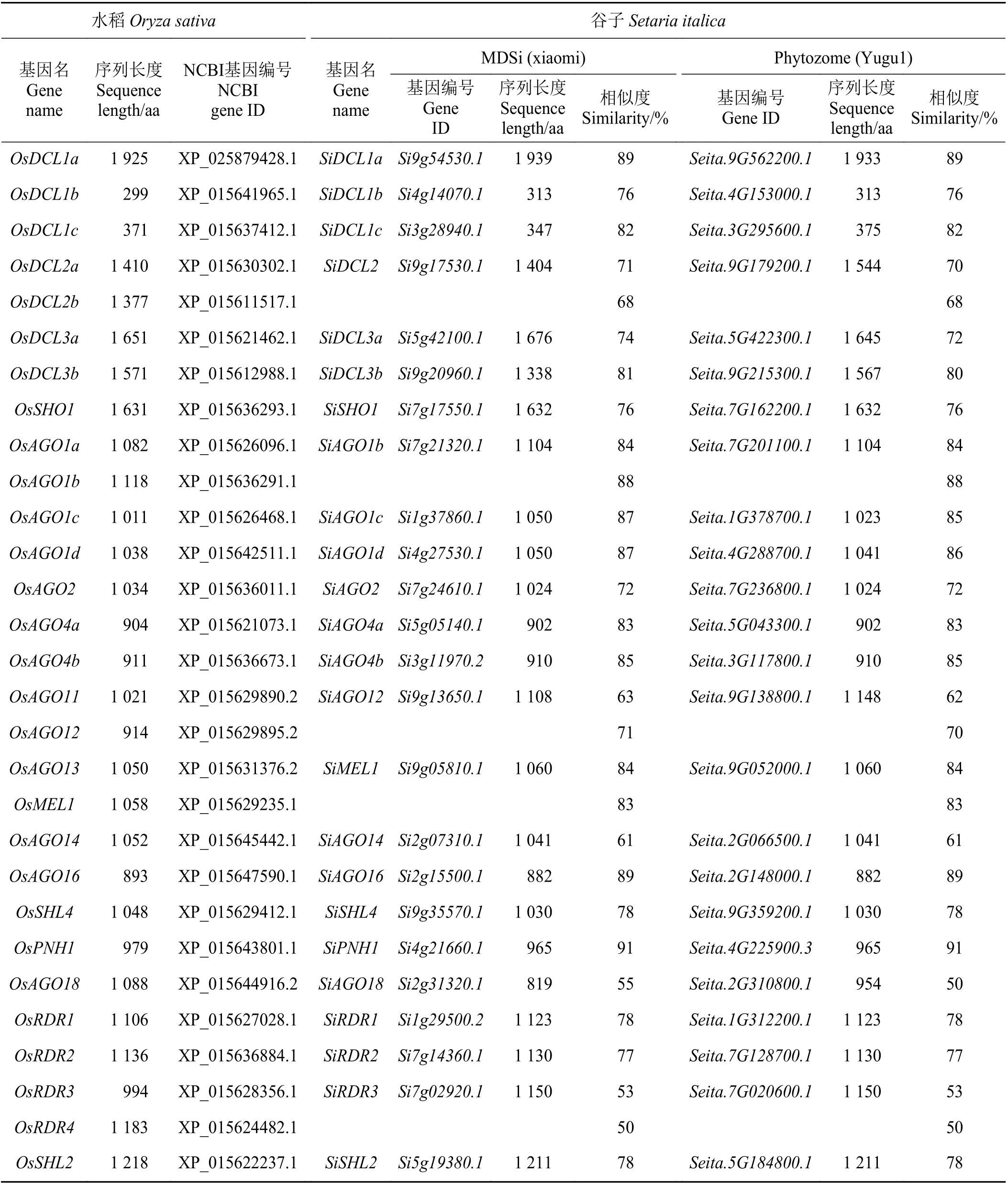
表1 谷子与水稻中RNA 干扰相关酶类基因比较分析Table 1 Comparativeanalysisof RNA interference-related enzyme genesin Setaria italica and Oryza sativa
通过对谷子RNA 干扰相关酶类蛋白序列的理化性质的分析发现(表2),氨基酸数从313(SiDCL1b)~1 933 (SiDCL1a),分 子 量在35 044.76(SiDCL1b)~216 227.3 Da(SiDCL1a),理论等电点在5.01(SiDCL1b)~9.55 (SiAGO12),说明这其中既有酸性蛋白质又有碱性蛋白质,带负电荷的残基总数(Asp +Glu)在43 (SiDCL1c)~257 (SiDCL1a),带正电荷的残基总数(Arg+Lys)在36(SiDCL1b)~241(SiDCL1a),原子总数在4 913(SiDCL1b)~30 290(SiDCL1a),脂肪指 数 在73.1 (SiAGO1b)~94.66 (SiDCL3b),GRAVY在−0.536(SiAGO1b)~−0.172(SiDCL2),除SiAGO1b是亲水性蛋白质外,其余均为两性蛋白质。

表2 谷子RNA 干扰相关酶类基因的蛋白质理化性质分析Table 2 Protein physical and chemical properties analysis of Setaria italica RNA interference-related enzyme genes
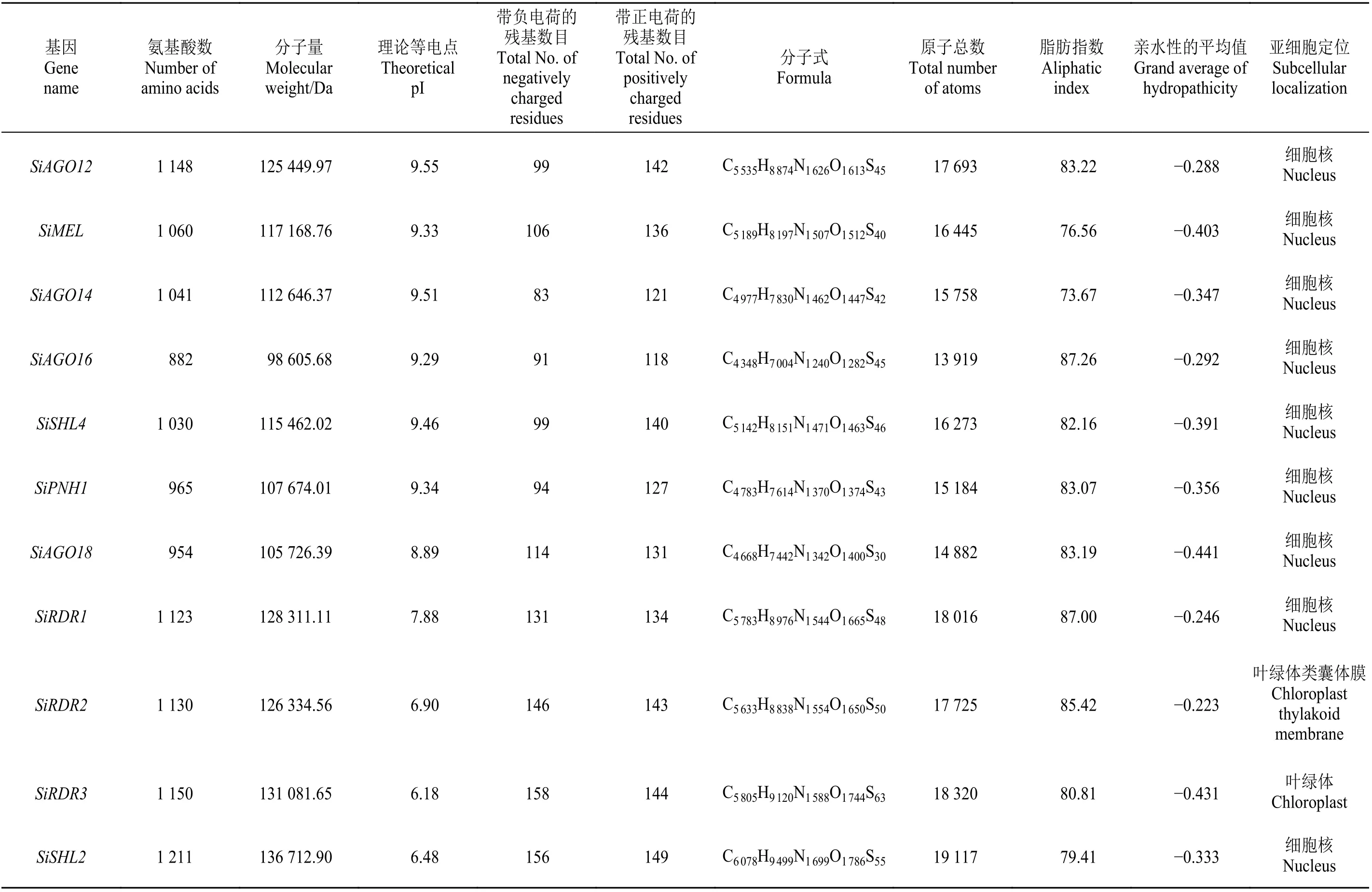
续表 2Table 2 (Continued)
通过对谷子RNA 干扰相关酶类基因的蛋白质序列进行亚细胞定位分析发现(表2),除SiRDR2位于叶绿体类囊体膜、SiRDR3位于叶绿体外,其余均位于细胞核,这说明这些酶类基因会在不同的亚细胞结构中发挥不同的功能。
2.2 谷子和水稻RNA 干扰相关酶类基因系统进化树分析
为探究谷子和水稻RNA 干扰相关酶类基因的系统进化关系,对筛选出的谷子和水稻RNA 干扰相关酶类蛋白进行系统进化树构建,结果发现(图1),RNA 干扰相关酶类基因共分为3个进化支。第一个进化支包括所有的Dicer 家族和SHO1:Si/OsDCL1a、Si/OsDCL1b、Si/OsDCL1c、SiDCL2、Si/OsDCL3a、Si/OsDCL3b、Si/OsSHO1、OsDCL2a、OsDCL2b。第二个进化支包括所有的RDR 家族和SHL2:Si/OsRDR1、Si/OsRDR2、Si/OsRDR3、OsRDR4、Si/OsSHL2。第三个进化支包括所有的AGO蛋白家族以及MEL1、SHL4、PNH1:Si/OsAGO1b、OsAGO1a、Si/OsAGO1c、Si/OsAGO1d、Si/OsAGO2、OsAGO3、Si/OsAGO4a、Si/OsAGO4b、Si/OsAGO12、OsAGO11、OsAGO13、Si/OsAGO14、OsAGO15、Si/OsMEL1、Si/OsAGO16、Si/OsSHL4、Si/OsPNH1、OsAGO17、Si/OsAGO18。
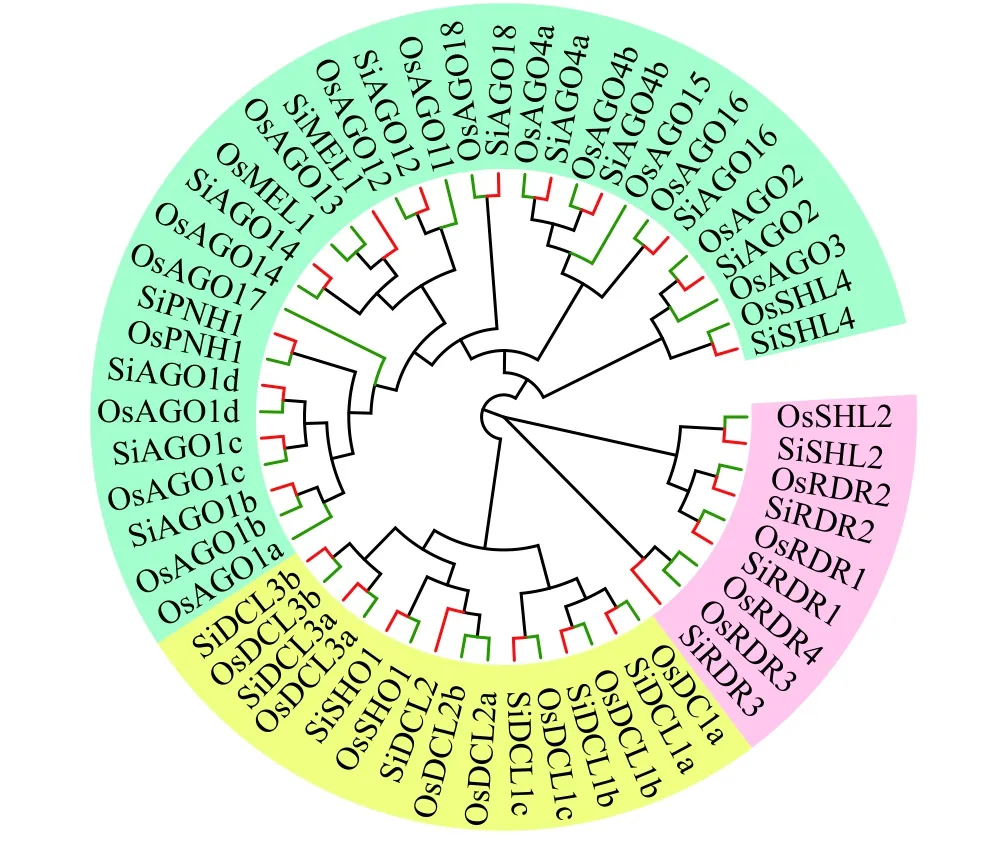
图1 谷子和水稻RNA 干扰相关酶类基因的系统进化树Figure 1 Phylogenetic tree for the RNA interference-related enzyme genes in Setaria italica and Oryza sativa
2.3 谷子和水稻RNA 干扰相关酶类基因的保守结构域分析
DCL酶类是RNAⅢ家族成员,通过对谷子和水稻DCL酶的保守结构域分析发现(图2),Si/OsDCL1a、SiDCL2、OsDCL2a、OsDCL2b、SiDCL3a、Si/OsDCL3b、OsSHO1中含有与RNAⅢ家族相同的结构域,即DEAD、Helicase_C、Dicer_dimer、PAZ和Ribonuclease_3结构域。此外,SiSHO1和OsDCL3a 还有一个特有的ResⅢ结构域,是Res亚基中的Ⅲ型限制酶,参与DNA 合成和ATP合成,具有水解酶活性。Dsrm 结构域仅存在于SiDCL1a、Si/OsDCL1b、Si/OsDCL1c、OsDCL2b、Si/OsSHO1中;Si/OsDCL1b、Si/OsDCL1c与其他DCL酶相比只含有Dsrm 和Ribonuclease_3结构域。
谷子和水稻的AGO蛋白家族除OsAGO13和OsAGO17外至少具有ArgoN、ArgoL1、PAZ和Piwi 4 个结构域(图2),除SiSHL4和OsAGO3之外,还均具有ArgoL2结构域。在Si/OsAGO1、OsAGO4b、OsAGO11、Si/OsAGO12、OsAGO13、Si/OsAGO14、OsAGO18、Si/OsMEL1和Si/OsPNH1中还均具有共同的Argomid 结构域,而Gly-rich_Ago1结构域只存在于OsAGO1a、Si/OsAGO1b和SiAGO1d 中。SiMEL1在进化树和结构域的结果中均与其他AGO基因聚为一类并与其他AGO酶类基因具有相同的结构域。
在RDR 家族蛋白质结构域的探索中(图2),发现谷子和水稻的RDR 酶类均包含RdRP结构域。

图2 谷子和水稻RNA 干扰相关酶类的氨基酸结构域分析Figure 2 Analysis of the amino acid domains of enzymesrelated to RNA interference in Setaria italica and Oryza sativa
2.4 谷子RNA 干扰相关酶类基因蛋白质保守基序分析
谷子RNA 干扰相关酶类基因的蛋白保守结构域主要包含5个保守基序:Motif1、Motif2、Motif3、Motif4、Motif5,并且在大多数的谷子RNA 干扰酶类基因中均存在,说明其基序是高度保守的(图3)。基序1的序列为RJIFYRDGVSEGQFT;基序2的序列为CHPTEFDFYLC;基序3 的序列为SRPAHYHVL YDENGF;基序4的序列为VPPAYYAHLAA;基序5的序列为GQWNMMNKKMVNGGKIRKWAC。从图中分析得出,谷子RNA 干扰酶类基因的蛋白序列均含有这5个保守基序,说明这5个基序在谷子RNA 干扰酶类基因蛋白的进化中是高度保守的。
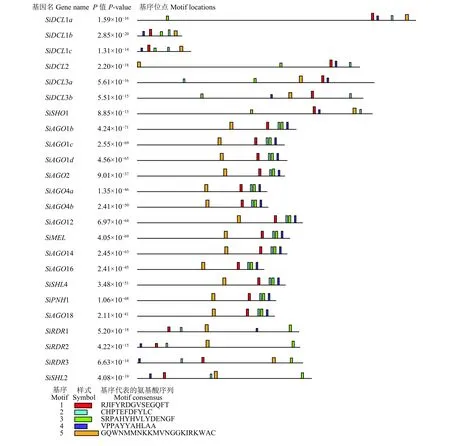
图3 谷子RNA 干扰相关酶类基因蛋白质保守基序分析Figure 3 Analysis of protein conservative motifs in Setaria italica RNA interference-related enzyme genes
2.5 谷子RNA 干扰相关酶类基因组织特异性表达分析
为了探索RNA 干扰相关酶类基因对谷子生长发育的影响,本研究对xiaomi 的6个发育时期(包括3周龄叶片、孕穗期的倒二叶、抽穗2 d 的穗、授粉时期的穗、灌浆期的穗和茎)以及Yugu1的穗、叶、茎、根4种组织器官的转录组数据进行分析,结果表明(图4)两者转录组显示的结果有一定的一致性也有各自的特点。xiaomi 中1个基因(SiDCL3b)在所有组织中均未检测到表达,同时该基因在Yugu1中也仅在穗中检测到低量表达,在Yugu1中未检测到表达的SiRDR3在xiaomi 中检测到的表达量也较低。在xiaomi和Yugu1中分别有5 个基因(SiDCL3a、SiAGO16、SiSHL4、SiRDR3、SiSHL2)和11个 基 因(SiDCL1a、SiDCL1b、SiDCL3b、SiSHO1、SiAGO12、SiAGO14、SiAGO16、SiSHL4、SiRDR2、SiRDR3、SiSHL2)在所有组织中检测到较低表达[FPKM <7,即log2(FPKM +1)<3]。在xiaomi 和Yugu1中 分 别 有7 个 基 因(SiAGO1b、SiAGO1c、SiAGO1d、SiAGO2、SiAGO4a、SiAGO18、SiPNH1)和6个 基 因(SiAGO1b、SiAGO1c、SiAGO4a、SiPNH1、SiAGO18、SiRDR1)至少在一种组织中出现高表达[FPKM>20,即log2(FPKM+1)>4.39],且xiaomi中SiAGO18仅在灌浆期的穗中特异性高表达,在Yugu1中SiAGO18相对其他时期在穗中表达量最高,SiAGO1b在4种组织中的表达量均最高,暗示了这些基因在组织发育中的关键调控作用。同时,在所分析的xiaomi 的6个组织中,所有基因在生长3周的叶片中的表达量最低,在所有时期的穗以及灌浆期的茎中表达量较高,且分别有11、4、5、2个基因在抽穗2 d 的穗、授粉时期的穗、灌浆期的穗和灌浆期的茎中的表达达到了最高值。在所分析的Yugu1中AGO蛋白家族基因在4种组织中均有较高水平的表达,说明在RNA 干扰过程中,AGO酶类基因处于核心位置[4],谷子RNA 干扰相关酶类基因在穗和茎中相比其他组织中的表达量更高,这与其在穗和茎的生长发育中发挥的重要调节作用有关[15]。

图4 谷子RNA 干扰相关酶类基因组织特异性表达分析Figure 4 Transcriptome analysisof RNA interference-related enzyme genesin different Setaria italica tissues
3 讨论与结论
由DCL、AGO和RDRs三类家族成员介导的RNAi 是一个重要的生理调控过程,在植物营养和生殖生长过程,特别是在SAM 的发育以及从SAM 到花分生组织的转变过程中具有重要作用[4]。但是,谷子中的这些基因尚未见报道。xiaomi作为一种超早熟材料,因其具有生长周期短、基因组数据精准、转录组数据全面,并已成功建立出高效稳定的再生体系和遗传转化体系等特点,对谷子的功能基因组研究和功能基因利用起到重要的指导作用[22],而Yugu1是第一个谷子基因组测序的品种,在谷子分子生物学和基因组学研究中具有重要的参考价值。因此,本研究选取这两个代表性的谷子品种,对其RNA 干扰相关酶类基因家族进行了全基因组鉴定。本研究共挖掘出24个谷子RNA 干扰相关酶类基因,包括DCL 类7个,AGO类13个,RDR 类4个。分析并注释了这些基因的长度、相似度及氨基酸序列号,水稻中的多个蛋白序列与谷子比对后,只能对应到谷子的同一个序列。说明谷子在进化过程中既与水稻保持了共线性又有其自身进化的特点[21,28]。并通过对24个蛋白质序列的理化性质分析以及亚细胞定位预测,以确定不同基因间的相互关系。通过系统发育树分析了各个基因家族之间的进化关系,Dicer 酶可催化dsRNA 产生小RNA,是重要的RNA 酶Ⅲ家族成员之一[29]。在植物中,RDR 参与了RNA 介导的DNA 甲基化途径(RNA-directed DNA methylation,RdDM),RdDM途径不仅在突变、印记、基因调控和植物发育中起到重要作用,同时也影响转座子沉默、基因组的稳定性以及植物的胁迫反应[30]。AGO蛋白作为效应复合物的核心,在RNA 干扰中发挥重要作用[29]。进化树结果揭示了谷子各基因家族成员的进化过程及这些基因的多样性。值得注意的是,谷子RNA 干扰相关酶类基因在Yugu1基因组中只是注释成Dicer、AGO、RDR 基因,并没有对其进行细化,而本研究结果则是对Phytozome数据库的丰富和补充。同时,根据进化树结果可以看出,水稻和谷子的直系同源(orthologous)基因(如OsDCL3a 和SiDCL3a)在进化树上先聚为一支,再与旁系同源(paralogous)基因(OsDCL3b和SiDCL3b)聚为一大支,验证了谷子和水稻在进化上的关系和地位。
在对谷子RNA 干扰相关酶类基因家族的保守基序分析中发现这24个基因均含有5个共同的保守基序,说明这些基序在进化过程中相对保守。
在对谷子和水稻RNA 干扰相关酶类基因家族的保守结构域分析中发现,所有的DCL 酶、AGO蛋白家族、RDR 类家族各自具有共同的保守结构域。具有相同结构域的基因在功能上相似,行使相同的功能。DCL酶类家族中除氨基酸长度较短的Si/OsDCL1b、Si/OsDCL1c外,均 具 有Helicase_C、Dicer_dimer、PAZ和Ribonuclease_3 4种结构域;AGO酶类基因所包含的4种结构域中,PAZ和Piwi结构域是核心AGO蛋白家族最主要的功能域,PAZ 有助于siRNA 3′末端的结合,而Piwi 则将siRNA 的5′末端与靶RNA 结合[4]。水稻MEL1主要位于生殖细胞的细胞质中,在减数分裂前生殖细胞的发育和减数分裂的进程中具有特定的功能[31]。RDR 酶类家族中主要包含RdRP结构域。因此,在对SiSHL2和SiSHL4进行归类时,由于SiSHL2与SiRDR1、SiRDR2具有相同的结构域,其被定义为RDR 酶类相关基因,而SiSHL4是AGO酶类基因,可以看出,虽然它们在命名上相近,却分别属于不同的基因家族,在分类时需要特别注意。谷子与水稻同源基因间保守结构域有细微差别,说明谷子和水稻在进化的过程中即有相同点又分别保持了自身的特点[28]。
虽然在组织特异性表达分析时选用xiaomi 对其他谷子品种来说具有局限性,但是也具有一定的启示作用。在水稻中已报道RNA 干扰途径在生长发育、花期转变中的调节作用[32-34],本研究也发现了这一点。高表达[FPKM> 20,即log2(FPKM+1)>4.39]的RNA 干扰相关酶类基因在亚细胞定位预测中均定位在了细胞核中,而已有报道显示细胞核中存在的生长素信号途径有助于解释植物生长发育的调控机制[35]。谷子RNA 干扰相关酶类基因在不同组织器官中的转录组分析显示,xiaomi中3种酶类基因家族在谷子3周龄叶片中表达水平较低,在孕穗期的倒二叶中表达量次之,而在所有发育时期的穗和灌浆期的茎中表达量较高,分别有45.8%、16.7%、20.8%和8.3%的基因在抽穗2 d 的穗、授粉时期的穗、灌浆期的穗和灌浆期的茎中的表达达到了最高值,说明在谷子的穗和茎中生成小RNA 途径更活跃,暗示其在谷子SAM 的发育以及从SAM到花分生组织的转变过程中的重要作用,有待于后续深入研究。在Yugu1中不同组织器官的转录组分析结果显示,3种酶类基因家族在谷子叶片和根中的表达水平相对较低,而在穗和茎中的表达量较高,说明在谷子的穗和茎中生成小RNA 途径更活跃。除此之外,SiDCL1c、SiDCL2、SiRDR1和SiAGO1b在各组织器官中的表达量均为同家族成员中的最高值,说明这些基因在RNA 干扰过程中可能发挥着重要作用。
本研究对谷子的RNA 干扰相关酶类基因家族进行了挖掘和鉴定,共挖掘出24个谷子RNA 干扰相关酶类基因,其中DCL 类7个,AGO类13个,RDR 类4个,并对其进行了蛋白质理化性质分析、亚细胞定位预测、系统发育分析、蛋白质保守基序分析、保守结构域分析表明谷子RNA 干扰相关酶类基因在谷子营养和生长发育的过程中发挥着重要作用,对谷子两个品种的不同组织器官中的表达分析表明RNA 干扰酶类基因中AGO酶类基因的作用较为关键,在穗和茎的生长发育中RNA 干扰酶类基因发挥着关键作用,研究结果将对谷子功能基因组研究提供新的参考,对开展谷子分子表观遗传学研究提供重要理论基础。

