基于MRI 影像组学模型与临床模型预测乳腺癌新辅助化疗病理完全缓解效能分析
程凤燕 杨志企 廖玉婷 杨佳达 陈湘光 范伟雄 陈小凤
乳腺癌是女性发病率和死亡率最高的恶性肿瘤[1-2]。术前新辅助化疗(neoadjuvant chemotherapy,NAC)是早期和进展期乳腺癌的标准治疗方案,其目的是使肿瘤降期,提高手术切除率及保乳率[3],同时还可尽快了解肿瘤对化疗药物的敏感性,为术后化疗药物选择提供依据[4]。研究[5]证实NAC 疗效与预后相关,且病理完全缓解(pathological complete response,PCR)者的预后优于病理部分缓解(pathologic partial response,PPR)者。目前预测乳腺癌NAC 疗效方法虽然较多,但仍缺乏可以有效预测PCR 的单一指标。影像组学作为一种高通量提取影像特征的技术,可通过挖掘影像数据对肿瘤特性进行分析,进而预测肿瘤对治疗的反应和病人预后[6]。目前有关基于动态增强MRI(dynamic contrast enhanced MRI,DCE-MRI)、扩散加权成像(DWI)及两者联合的影像组学模型预测乳腺癌NAC-PCR 的研究,国内外已有相关报道[7-8],但各模型间的对比研究尚少。尽管多参数MRI 影像组学模型的预测效能较单参数MRI 影像组学模型更高[8],但多参数模型的数据处理较单参数模型更为复杂、繁琐,不适合临床应用推广。因此,本研究拟通过比较基于DCE-MRI、表观扩散系数(ADC)图的影像组学模型及基于临床特征的临床模型在预测乳腺癌NAC-PCR 效能方面的差异,为临床筛选一种简单、方便及可靠的预测方法。
1 资料与方法
1.1 一般资料 回顾性收集2016 年1 月—2018年8 月在梅州市人民医院行乳腺癌NAC 治疗的91例女性病人,年龄 29~68 岁,平均(48.45±9.49)岁。纳入标准:①NAC 治疗前行多参数MRI 检查,包括DCE-MRI 和DWI;②具有NAC 疗效病理评估结果。排除标准:①临床资料不全者;②MRI 影像有伪影者。将91 例病人按照7∶3 比例随机分为训练组(63 例)和验证组(28 例),2 组均进行 NAC 疗效病理评估,训练组中 PCR 者 16 例、PPR 者 47 例,验证组中 PCR 者 7 例、PPR 者 21 例。
1.2 设备与方法 采用西门子公司Magnetom Skyra 3.0 T MR 扫描设备,16 通道专用乳腺相控线圈。检查时病人取俯卧位,身体保持水平状态,双乳自然悬垂于线圈内,头先进。DCE-MRI 参数:TR 6.4 ms,TE 3.3 ms,FOV 288 mm×384 mm,矩阵 288×384,层厚2.0 mm,层间距0.4 mm,扫描34 个时相,第 1 个时相17.7 s,以后单时相扫描时间8.7 s,总时间304.8 s。DWI 参数:TR 420 ms,TE 62 ms,b 值分别取0、50、800 s/mm2,FOV 149 mm×340 mm,矩阵 86×220,层厚4.0 mm,层间距0.8 mm。动态增强扫描采用时间分辨随机轨道(TWIST)成像技术,先扫蒙片,然后采用高压注射器经手背静脉团注对比剂钆喷酸葡胺(Gd-DTPA,0.5mmol/mL,拜耳公司),注射剂量0.1 mmol/kg 体质量,流率3.0 mL/s,对比剂注射完毕后以相同流率注射生理盐水20 mL,前2个时相为蒙片,第3 个时相在注射对比剂同时进行扫描,注射对比剂后共扫描32 个时相。
1.3 临床特征及NAC 疗效病理评价标准 记录病人年龄、雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)、人表皮生长因子受体 2 (human epidermal growth factor receptor,HER-2)、肿瘤增殖细胞核抗原Ki-67 及NAC 疗效病理评估结果。ER 和PR 阳性标准为核染色的肿瘤细胞数≥1%;HER-2 阳性标准是免疫组织化学检测(+++)或荧光原位杂交法检测阳性;Ki-67<20%定义为低表达,≥20%为高表达;NAC 疗效病理评估采用Miller-Payne 分级系统,其中Ⅰ~Ⅳ级定义为PPR,V 级定义为 PCR[2]。
1.4 影像组学模型构建
1.4.1 肿瘤勾画 将DCE-MRI 影像(选取DCE-MRI序列中病灶强化峰值所对应时相)、ADC 图导入ITK-SNAP 软件(version 3.6.0, https://itk.org/)内,由1 名影像科主治医师对病灶进行手动逐层标记,并由另1 名副主任医师进行核对,意见分歧时通过协商达成一致。标记时尽量避免超出病灶边缘。
1.4.2 数据预处理 依据NAC 疗效病理评估结果对训练组和验证组中的病人进行标记,PPR 者和PCR 者在模型中分别标记为0 和1。
1.4.3 影像组学特征提取 将原始数据和肿瘤三维分割结果导入AK 软件(Artificial Intelligence Kit V3.0.0.R,GE),提取 5 大类特征(包括灰度共生矩阵、灰度大小区域矩阵、直方图、形态学特征和游程矩阵)并对分割区域内的影像数据进行特征计算。AK 软件中内嵌的特征计算公式遵循影像生物标志物标准化倡议(image biomarker standardisation initiative,IBSI)标准。每个特征所对应的计算公式可见网址(https://pyradiomics.readthedocs.io/en/latest/features.html)。每例病人提取396 个特征。
1.4.4 影像组学特征降维和模型构建 采用Spearman 相关性分析(阈值0.9)减少重复变量(采用R 软件进行影像组学特征筛选),采用最小绝对收缩和选择算法剔除系数为0 的变量,最终分析DCE 模型的偏度、聚类萌_angle45_offset7 和聚类萌_angle0_offset7 特征,ADC 模型的峰度、长游程低灰度补偿_angle0_offset7 和高密度短域补偿特征。最后采用多元Logistic 回归方法分别构建DCE 模型和ADC 模型,同时计算相应模型的影像组学评分(DCE-Radscore 和 ADC-Radscore)[2],计算公式为:为常数项,Xi为选择的特征值,Ci为选择特征所对应的回归系数。
1.5 临床模型构建 采用单因素Logistic 回归对病人年龄、ER、PR、HER-2 及 Ki-67 表达状态进行分析,然后将有统计学意义的临床特征纳入多因素Logistic 回归建立临床预测模型。
1.6 统计学方法 采用R 软件(Version:3.4.4,https://www.r-project.org/)和SPSS19.0 软件进行数据分析。符合正态分布的计量资料以均数±标准差()表示,2 组间比较采用t检验;计数资料以例(%)表示,2 组间比较采用χ2检验或Fisher 确切概率检验。采用受试者操作特征(ROC)曲线评估影像组学模型和临床模型的预测效能,并计算其准确度、特异度、敏感度和相应曲线下面积(AUC)。采用决策曲线评估模型的临床应用价值。P<0.05 为差异有统计学意义。
2 结果
2.1 PCR 者和PPR 者间临床特征比较 在训练组中,PCR 者的 ER、PR 阴性率较 PPR 者高(均P<0.05,表 1),并在验证组中得到验证(均P<0.05,表 2)。年龄、HER-2 及 Ki-67 表达状态在 PCR 者与 PPR 者间的差异均无统计学意义(均P>0.05,表1)。
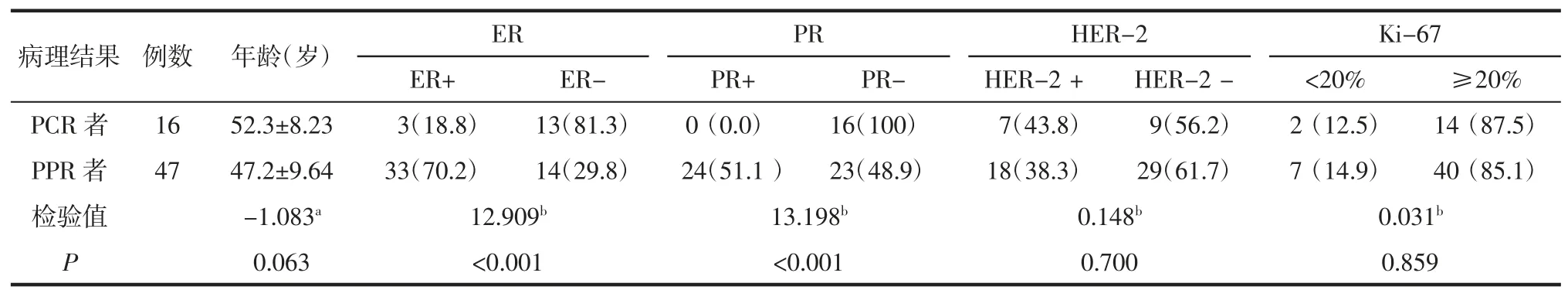
表1 训练组中PCR 者和PPR 者间临床特征比较 例(%)
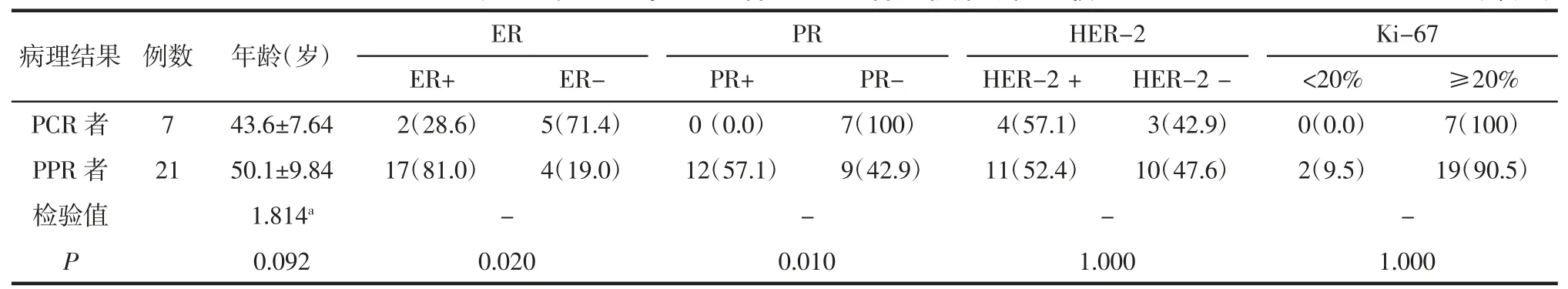
表2 验证组中PCR 者和PPR 者间临床特征比较 例(%)
2.2 影像组学模型评分比较 在训练组中,PCR 者的 DCE-Radscore 高于 PPR 者(P<0.05),并在验证组中得到验证(P<0.05)。训练组中,PCR 者的 ADCRadscore 高于 PPR 者(P<0.05),未在验证组中得到验证(P>0.05),见表 3。

表3 PCR 者和PPR 者的影像组学模型评分比较
2.3 训练组和验证组中3 种模型预测PCR 的效能 训练组中,临床模型的敏感度及AUC 最高,其次是ADC 模型,DCE 模型最低。验证组中,临床模型AUC 值最高而敏感度最低,ADC 模型AUC 最低而敏感度最高(表4)。训练组和验证组中3 种模型预测PCR 的ROC 曲线见图1。决策曲线分析显示临床模型具有最大的净获益,其次是ADC 模型,DCE 模型最低(图 2)。
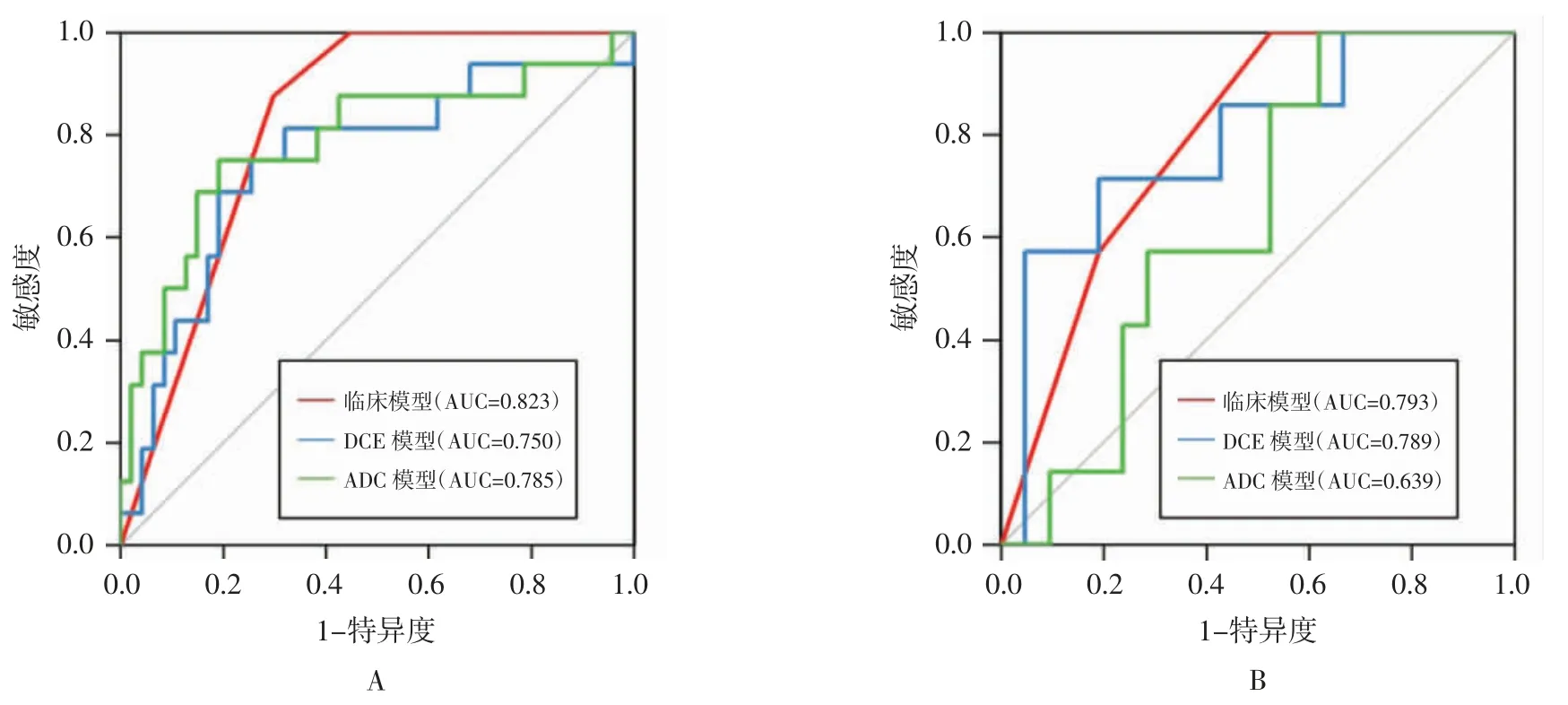
图1 训练组(A)和验证组(B)中3 种模型预测PCR 的ROC 曲线
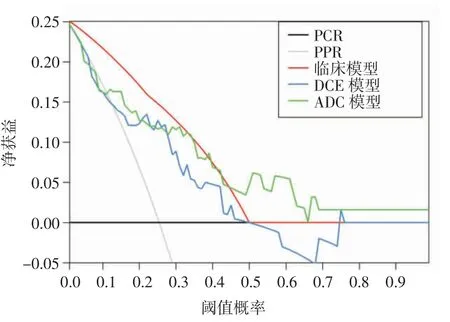
图2 训练组中临床模型、DCE 模型和ADC 模型的决策曲线分析
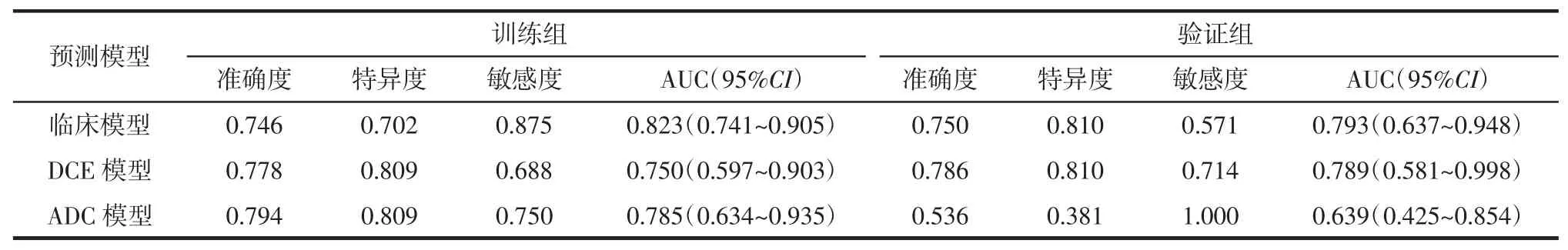
表4 3 种模型在训练组和验证组中预测PCR 的效能
3 讨论
ER、PR 表达状态与病人的疗效相关[2],ER/PR阴性者对NAC 较敏感,因此NAC 治疗后能够获得PCR 的概率就较高。本研究结果显示PCR 者的ER、PR 阴性率较PPR 者高,这与Chen 等[9]研究结果相同,符合ER/PR 阴性者获得PCR 概率较高的改变。此外,肿瘤的异质性与其疗效亦相关[2],因此了解乳腺癌的异质性将有助于评估NAC 疗效。本研究中396 个影像组学特征经过筛选后最终确定偏度、峰度、聚类萌、长游程低灰度补偿和高密度短域补偿,这5 个特征均能反映肿瘤的异质性。而且,基于上述特征建立的影像组学模型评分的比较结果显示,在训练组和验证组中PCR 者的DCE-Radscore 绝对值均低于PPR 组,这与既往研究[2]结果相符,因此提示肿瘤异质性越明显,其影像组学模型评分绝对值就越大,而NAC 疗效就越差。
乳腺MRI 在乳腺癌诊断、鉴别诊断及疗效评估中的实用性已经被证实[7-8,10-13]。本研究利用基于DCE-MRI 的影像组学特征建立预测乳腺癌NAC 疗效模型,结果显示基于治疗前DCE-MRI 影像建立的影像组学模型预测乳腺癌PCR 具有较好的预测效能(AUC=0.750),这与 Braman 等[7]的研究结果相近(AUC=0.780)。同样,基于ADC 图建立的影像组学模型对预测乳腺癌PCR 亦具同样的预测效能(AUC=0.785),稍高于 Liu 等[8]的研究结果(AUC=0.690)。分析原因可能是本研究为单中心、小样本研究,病人选择及统计结果可能存在偏差,而后者为大样本、多中心研究。基于联合ER、PR 建立的临床模型对预测乳腺癌PCR 具有最高的预测效能(AUC=0.823),稍高于上述2 种影像组学模型,这与Liu 等[8]部分研究结果相似,并再次验证了临床预测因子如ER、PR 和HER-2 在预测肿瘤特征或疗效方面的价值优于影像组学特征。另外,决策曲线分析显示应用临床模型预测PCR 的临床净获益稍优于影像组学模型,这也从一侧面提示在预测乳腺癌PCR 方面临床特征稍优于影像组学特征。
本研究对基于DCE-MRI、ADC 图建立的影像组学模型预测效能进行比较,结果显示在训练组中,基于ADC 影像组学模型在预测乳腺癌PCR 效能(AUC=0.785)稍高于基于DCE-MRI 影像组学模型预测效能(AUC=0.750),且前者的敏感度(0.750)较后者的(0.688)高,这与 Liu 等[8]研究结果相似,而且应用基于ADC 影像组学模型预测PCR 的临床净获益亦稍优于基于DCE-MRI 影像组学模型。此外,本研究验证组中,ADC 模型的敏感度为1,推测主要原因与PCR 组病人显著少于PPR 组有关,这也反映了目前乳腺癌NAC 治疗后PCR 病人明显少于PPR 病人这一普遍现象[9,14-15]。影像组学预测乳腺癌NAC 疗效的实用性已被既往研究[9,16-17]所证实,本研究的模型也取得了较好的预测结果,在后续的研究中我们将加入更多的病例对模型进行验证。
综上所述,基于ADC、DCE-MRI 影像组学模型和基于联合ER 和PR 临床模型均能作为术前预测乳腺癌NACPCR 的预测因子,其中临床模型的预测效能及获益最高。本研究尚存在一定局限性:首先,病例数偏少,特别是PCR 病人;其次,回顾性研究无法控制乳腺MRI 质量,可能会影响结果的准确性和可靠性。因此,需要扩大样本量进行多中心研究进一步验证。

