产香酵母的分离鉴定及对不同原料酿造甜酒香气成分的影响
杨玉蓉,钟海雁,徐帅哲,杨 宁,杨 涛*
(中南林业科技大学 食品科学与工程学院,湖南 长沙 410004)
甜酒又称甜酒酿、醪糟等,甜酒具有看起来像米、盛起来像饭、喝起来像酒、滋味如蜜的特点[1],不仅可以直接饮用,也可用于发酵食品如馒头[2]、米发糕[3]等的制作。非酿酒酵母可用以提高酒的风味,尤其是提高挥发性香味物质的种类和含量,例如在葡萄酒风味提高研究中,具有高产酯能力的铁红假丝酵母(Candida pulcherrima)已经是一种商业化的产香酵母[4],贝酵母(Saccharomyces bayanus)用于增加苹果白兰地挥发性风味物质含量,起到酒体增香的作用[5],扣囊复膜酵母(Saccharomycopsis fibuligera)发酵能提高韩国米酒乙酯类芳香化合物的含量[6],为提高传统米酒的香气品质,有研究表明从中国传统甜酒曲中分离出的光滑假丝酵母(Candida glabrata)发酵后,具有丰富的酯类物质及较高的含量[7],可见目前越来越多的研究关注到产香产酯酵母的菌种开发。
米酒中有几十上百种风味物质,原料对风味物质的形成具有一定决定作用,稻米中含量最多的成分是淀粉,淀粉含量平均达60%以上[8]。大米中含量第二多的物质是蛋白质,未经研磨的糙米蛋白质含量在7.1%~8.3%之间,精米中的蛋白质含量在6.3%~7.1%之间[9]。大米蛋白含量对米酒风味的形成起着关键的作用,这是因为根霉在米酒酿造过程中除了起到液化和糖化的作用,还起一个非常重要的作用——产蛋白酶,根霉所产的蛋白酶酶解大米蛋白后形成小分子的多肽和氨基酸,有利于提高米酒的营养价值和风味[10]。
“曲为酒之骨”,甜酒曲是酿造优质甜酒的关键。但目前传统甜酒曲多为家庭作坊手工制作,开放式培养,受气候温度的影响大,同时存在杂菌如致病菌的污染问题[11],导致甜酒成品质量不稳定、存在安全隐患;商品化甜酒曲酿造的甜酒成品质量稳定,但酒香不足,甜度过高,多喝使人生腻。因此,为提高甜酒风味品质,本研究从传统颗粒酒曲中分离筛选产香酵母,结合形态学观察及分子生物学对筛选菌株进行鉴定,采用顶空-气相色谱(head spacegas chromatography,HS-GC)法对筛选菌株产香能力进行测定,并考察产香酵母对不同原料酿造甜酒香气成分的影响,旨在为甜酒酿造筛选产香菌株和优良原料,以提高甜酒风味品质,为风味米酒开发提供理论基础。
1 材料与方法
1.1 材料与试剂
1.1.1 供试菌株和原料
传统颗粒甜酒曲:广西梧州农户;米根霉(Rhizopus oryzae)MT835118:本实验室保存;籼米(蛋白质含量7.2 g/100g、碳水化合物含量75 g/100 g、脂肪含量0.6 g/100g):湖南洞庭春米业有限公司;籼糯米(蛋白质含量7.3 g/100 g、碳水化合物含量77.0 g/100 g、脂肪含量1.7 g/100 g):安徽燕之坊食品有限公司。
1.1.2 化学试剂
乙酸乙酯(纯度99.9%)、苯乙醇(纯度99.5%):上海阿拉丁生化科技股份有限公司;乙酸苯乙酯(纯度99%):上海麦克林生化科技有限公司;乙醇(纯度99.7%):天津市科密欧化学试剂有限公司;Ezup Column Fungi Genomic 脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:生工生物工程(上海)股份有限公司;高温α-淀粉酶(酶活40 000 U/g)、葡萄糖淀粉酶(酶活100000U/g):北京索莱宝科技有限公司;TaqPlus DNA聚合酶、脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTP)(10 mmol/L):上海生工生物工程股份有限公司。
1.1.3 培养基
马铃薯葡萄糖固体培养基(potato dextrose agar medium,PDA):上海博微生物科技有限公司;酵母浸出粉胨葡萄糖(yeast peptone dextrose,YPD)固体培养基、孟加拉红琼脂培养基:青岛高科技工业园海博生物技术有限公司。
米汁培养基:称取100 g大米,蒸熟后加入0.3 g的高温α-淀粉酶,90 ℃水浴锅中液化1.5 h,100 ℃灭活10 min,再加入0.1 g葡萄糖淀粉酶,60 ℃水浴锅中糖化1.5 h,4层纱布过滤,8 000 r/min离心10 min后,于121 ℃灭菌15 min。
1.2 仪器与设备
HS-10顶空进样器、NexisGC-2030气相色谱仪、SH-Rtx-1色谱柱(30 m×0.25 mm×0.25 μm):日本岛津公司;BA200显微镜:麦克奥迪实业集团有限公司;MIR-150A恒温培养箱:上海SANTN公司;TD5A-WS台式高速离心机:湖南湘仪实验仪器开发有限公司、UV-2600紫外可见光分光光度计:日本岛津公司、DYY-6C电泳仪:北京六一仪器厂;Verity96well聚合酶链式反应(polymerase chain reaction,PCR)仪:美国ABI公司;手持折光仪:艾普计量仪器有限公司。
1.3 方法
1.3.1 菌种的分离和纯化
将0.1 g酒曲加入到10 mL无菌水中梯度稀释后,涂布于孟加拉红琼脂平板上,30 ℃条件下倒置培养24 h,挑取符合酵母菌落形态的单菌落,采用平板划线法接种于YPD培养基,30 ℃条件下静置培养48 h,以上步骤重复3次,纯化后得到纯菌株。
1.3.2 分离菌株复筛
将筛选菌株置于米汁培养基中发酵,采用HS-GC法测定甜酒典型风味β-苯乙醇含量,从而筛选产香能力最好的菌株。
各取一环分离菌株接种于50 mLYPD液体培养基中,30 ℃摇床振荡培养至菌悬液的OD600nm值至1后,于米汁培养基中添加OD600nm值为1的各实验菌株菌悬液0.8%(V/V),30 ℃摇床振荡培养72 h后,取发酵液用0.45 μm微孔滤膜过滤,1 mL滤液加入0.5 g NaCl后进样检测。
1.3.3 筛选菌株的鉴定
(1)形态学观察
取一环纯化后的菌,在YPD平板上平板划线,30 ℃倒置培养48 h,观察平板上单菌落的菌株菌落形态。用接种针沾取菌苔于载玻片上,滴加1滴无菌水,盖上盖玻片,于光学显微镜下10×40倍观察菌株细胞形态。
(2)分子生物学鉴定
DNA提取:按Ezup Column Fungi Genomic DNA Purification Kit说明进行DNA提取,DNA提取液于-20 ℃保藏备用。通过PCR扩增菌株的内部转录间隔(internal transcribed spacer,ITS)区域序列,引物为通用引物ITS1(5'-TCCGTAGGTGAACCTGCGG-3')和ITS4(5'-TCCTCCGCTTATTGATATGC-3');或者26S rRNA D1/D2区,扩增常用通用引物为NL1(5'-GCATATCAATAAGCGGAGGAAAAG-3')和NL4(5'-GGTCCGTGTTTCAAGACGG-3')。
PCR扩增体系:2 μL 的20~50 ng/μL模板DNA,2 μL 的10 μmol/L ITS1或NL1,2 μL 的10 μmol/L ITS4或NL4,2 μL的10 μmol/L脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTP),0.5 μL的5 U/LTaqPlus DNA聚合酶,加入超纯水补至50 μL。PCR扩增条件如下:94 ℃预变性4 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸45 s,35个循环;最后72 ℃再延伸2 min。取5 μL PCR产物用1%的琼脂糖凝胶电泳检验其纯度,电泳参数为150 V,100 mA,20 min。目的片段由生工生物工程(上海)股份有限公司进行一代测序,测序结果提交至美国国立生物技术信息中心(national center for biotechnology information,NCBI)数据库中,用基于局部比对算法搜索工具(basic local alignment search tool,BLAST)(http://www.ncbi.nlm.nih.gov/blast)进行基因序列的同源性检索,通过与已知酵母菌的基因序列比对进行分类鉴定。若基因序列与已知菌种的基因序列碱基差异大于1%,则该菌株即为新菌种。采用ClustalW比对ITS序列,利用MEGAX软件中的邻接(neighbor-joining,NJ)法(Bootstrap值设为1 000)构建系统发育。
1.3.5 米粉曲制作
取一环米根霉接种于PDA固体培养基上,30 ℃培养至孢子成熟,再用0.05%的Tween-80冲洗培养基表面,洗下的孢子经2层无菌擦镜纸过滤,将得到孢子悬液浓度调至约107CFU/mL。菌株YRNN5接种于YPD液体培养基中,30 ℃摇床振荡培养48 h,稀释后得约107CFU/mL的菌悬液。将大米磨粉过60目筛得到大米粉,取50 g大米粉分别加入3个500mL三角瓶中,115℃灭菌30 min,按米粉质量的2%将两种菌悬液分别按米粉质量2%的添加量加入灭菌后的米粉中,30 ℃培养3 d后,于35 ℃烘箱中干燥3 d,使水分含量低至14%以下,得到米根霉、菌株YRNN5的米粉曲,用于甜酒发酵。
1.3.6 菌株YRNN5发酵籼米酒、糯米甜酒分析检测
各取40 g籼米和籼糯米,按1∶1.4(g∶mL)的比例加入无菌水,于115 ℃蒸煮30 min,得到籼米和籼糯米米饭。将根霉和YRNN5米粉曲分别按接种量0.8%接至无菌籼米和籼糯米米饭中,总米粉曲接种量为1.6%,于30 ℃培养箱发酵72 h,采用顶空气相色谱联用(HS-GC)法测定籼米和籼糯米甜酒关键香气物质(β-苯乙醇、乙醇、乙酸乙酯和乙酸苯乙酯)差异。
HS-GC分析条件为:SH-Rtx-1色谱柱(30 m×0.25 mm×0.25 μm),顶空加热条件为:恒温炉温度60 ℃,恒温时间22 min;进样口温度220 ℃,分流进样,分流比1∶20,载气为氮气(N2),流量1 mL/min;升温程序:35 ℃保持6 min,以5 ℃/min升温至50 ℃,保持2 min,以8 ℃/min的速度升至160 ℃;检测器温度220 ℃。
β-苯乙醇、乙醇、乙酸乙酯和乙酸苯乙酯标准曲线绘制:用体积分数为10%的乙醇溶液配制不同质量浓度的β-苯乙醇、乙酸乙酯和乙酸苯乙酯标准溶液,同时配制不同体积分数的乙醇溶液,分别以β-苯乙醇、乙醇、乙酸乙酯和乙酸苯乙酯质量浓度(x)为横坐标,峰面积(y)为纵坐标绘制β-苯乙醇、乙醇、乙酸乙酯和乙酸苯乙酯标准曲线,β-苯乙醇标准曲线回归方程为:y=34.33x-246.104,相关系数R2=0.997。得到乙醇标准曲线回归方程为:y=3 821 829x+451 505,相关系数R2=0.999 2;乙酸乙酯标准曲线回归方程为:y=1 497.95x-5 155.75,相关系数R2=0.999 8;乙酸苯乙酯标准曲线回归方程为:y=156.88x-95.35,相关系数R2=0.999。按照标准曲线回归方程计算发酵液β-苯乙醇、乙醇、乙酸乙酯和乙酸苯乙酯的含量。
糖度的测定采用手持糖度计测定,取两滴甜酒发酵液滴于检测的折光棱镜表面,将折光仪对准光源观察目镜,所视分界线所对应的刻度值即为所测溶液的糖度(°Bx)。
感官评价:参考国标GB/T 12313—1990《感官分析方法风味剖面检验》[12]加以修改,具体为采用定量描述分析(quantitative descriptive analysis,QDA)法,标度方法为线性标度法。左端代表“最弱”,右端代表“最强”,由6名本实验室(20~27岁,3名女性,3名男性)经过训练的人员组成感官评价小组。发酵后的籼米和籼糯米甜酒各取5 g于品酒杯中,样品温度和室温均在20~25 ℃,评价完成后,用直尺测量气味描述的线性表度长度,采用得到的长度数据进行统计分析。
1.3.7 数据处理
数据统计采用SPSS 20.0软件,绘图采用Prism 8.0软件,系统发育树由MEGA X软件绘制。
2 结果与分析
2.1 菌株的分离和纯化
分离纯化后得到纯菌株6株,菌株分别命名为YRNN1、YRNN2、YRNN3、YRNN4、YRNN5、YRJM。
2.2 菌株复筛结果
β-苯乙醇是米酒的典型香气物质之一,具有典型的玫瑰花香[13],赋予米酒花香的特征。筛选菌株产β-苯乙醇能力测定结果见图1。由图1可知,筛选菌株在米汁培养基中发酵后,菌株YRNN5产β-苯乙醇量(19.06 mg/L)显著高于其他5株酵母(P<0.05),其次是菌株YRNN3,β-苯乙醇产量为11.74 mg/L,而其他菌株在米汁培养基中产β-苯乙醇的量均低于10 mg/L。因此,选取产香能力更强的菌株YRNN5作为甜酒增香酵母进行后续实验。

图1 筛选菌株产β-苯乙醇能力Fig.1 β-phenylethanol production ability of screened strain
2.3 菌种形态学鉴定
筛选菌株的菌落及细胞形态观察结果见图2。由图2A可知,菌株YRNN1~YRNN5的菌落颜色为白色,菌落边缘光滑无扩散,30 ℃培养48 h后菌落直径为5 mm。由图2B可知,菌株YRNN1~YRNN5具有两种细胞形态类型,一种是单细胞酵母形态,另一种是菌丝状酵母形态。菌株YRJM的细胞形态则呈现典型的酿酒酵母的卵圆形。该实验结果与FARH M等[14]的研究结果类似,从不同Nuruk样品中分离出的双形态的酵母被鉴定为扣囊复膜酵母(Saccharomycopsis fibuligera),该菌主要用于韩国米酒的发酵。

图2 筛选菌株的菌落(A)及细胞(B)形态Fig.2 Colony (A) and cell (B) morphology of screened strains
2.4 分子生物学鉴定
26S rRNA D1/D2区域具有较高的变异率,可用于亲缘关系较近的菌株之间的分类研究[15]。核糖体重复单元的ITS区具有受环境因素影响小、进化速度快的特点,在相同种的不同菌株间高度保守,而在不同种间的差异极大,通常是应用于属及属以下的真菌分类学[16]。使用BLAST对6株酵母的扩增产物测序得到序列与相关菌株的序列进行比较,结果见表1。
由表1可知,菌株YRNN1、YRNN2、YRNN3、YRNN4和YRNN5与S.fibuligeraADJ4、KJJ81和ATCC36309的亲缘关系最近,且序列相似度达99%以上,菌株YRJM与酿酒酵母(Saccharomyces cerevisiae)RG15和RG20的序列相似度为100%。

表1 6株筛选菌BLAST比对结果Table 1 BLAST comparison results of 6 screened strains
为进一步可视化菌株与其相似菌株之间的亲缘关系,采用MEGA X软件构件6株酵母菌的系统发育树,菌株YRNN1、YRNN2、YRNN3、YRNN4和YRNN5的系统发育树见图3。

图3 菌株YRNN1、YRNN2、YRNN3、YRNN4和YRNN5的系统发育树Fig.3 Phylogenetic tree of strains YRNN1,YRNN2,YRNN3,YRNN4 and YRNN5
由图3可知,菌株YRNN1、YRNN2、YRNN3、YRNN4和YRNN5被鉴定为扣囊复膜酵母(Saccharomycopsisfibuligera),NCBI登记号分别为MT831527、MT831528、MT831529、MT831530和MN809231。菌株YRJM的系统发育树见图4。由图4可知,菌株YRJM与S.cerevisiaeRG15的bootstrap值为100,被鉴定为酿酒酵母(Saccharomyces cerevisiae),NCBI登记号为MT830867。

图4 菌株YRJM的系统发育树Fig.4 Phylogenetic tree of strain YRJM
2.5 籼米和籼糯米甜酒风味
以菌株YRNN5作为甜酒增香酵母分别发酵籼米和籼糯米,所得甜酒风味轮廓见图5。由图5可知,籼米和籼糯米的风味轮廓有明显的区别,体现在籼糯米甜酒的甜滋味更为突出。籼米甜酒虽然甜滋味不够突出,但花香、果香和蜜香得分更高,整体风味更为突出。
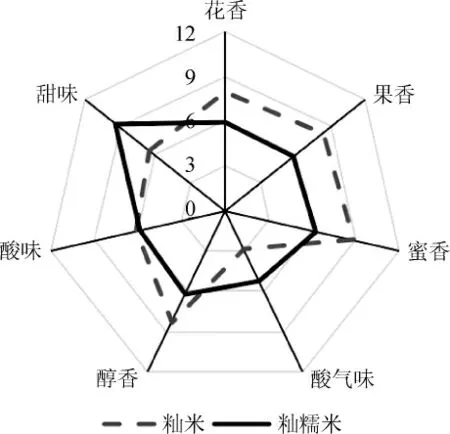
图5 菌株YRNN5发酵籼米和籼糯米制备甜酒风味轮廓图Fig.5 Flavor profile of indica rice and indica glutinous rice wine fermented by strain YRNN5
选取具有果香特征的乙酸乙酯[17]、具有舒适花香和蜜香特征的β-苯乙醇[18]和乙酸苯乙酯[19]作为风味物质含量评价指标,经HS-GC测定风味物质含量,籼米和籼糯米甜酒风味物质测定结果见表2。由表2可知,籼米甜酒和籼糯米甜酒的乙醇含量分别为15.15%vol和12.80%vol,无显著性差异(P>0.05)。乙酸乙酯含量差异不显著(P>0.05),但籼米甜酒的乙酸乙酯含量为70.42 mg/L,高于籼糯米甜酒的47.01 mg/L。这可能与籼米甜酒和籼糯米甜酒乙醇含量差异不显著有关,因为乙酸乙酯主要是在醇乙酰基转移酶的催化下由乙酸和乙醇脱水缩合形成[20]。籼米和籼糯米甜酒的β-苯乙醇含量分别为771.38 mg/L和433.07 mg/L,差异显著(P<0.05),籼米甜酒的β-苯乙醇含量高于籼糯米甜酒。该结果与油卉丹等[21-22]的研究结果类似。贵州和海南的地方标准[23-24]对发酵米酒中的β-苯乙醇都有最低含量标准(4~20 mg/mL)。籼米和籼糯米甜酒的乙酸苯乙酯含量也具有显著性差异(P<0.05),乙酸苯乙酯含量分别为2.90 mg/L和1.33 mg/L。乙酸苯乙酯可经酯酶催化乙酸与β-苯乙醇形成,或是经醇酰基转移酶催化乙酰辅酶A和β-苯乙醇形成[25],β-苯乙醇是乙酸苯乙酯形成的必要底物之一,因此籼米甜酒和籼糯米甜酒中乙酸苯乙酯含量的差异可能与β-苯乙醇含量高低有关。赵婷婷等[26]研究表明,β-苯乙醇和乙酸苯乙酯是米酒的主体香成分,通过测定典型甜酒香风味物质乙酸乙酯、β-苯乙醇和乙酸苯乙酯含量和感官评价,表明籼米甜酒的风味要高于籼糯米甜酒。

表2 籼米和籼糯米甜酒关键风味物质差异Table 2 Differences in key flavor compounds between sweet wine of indica rice and indica glutinous rice
3 结论
该研究本实验从土曲中分离出6株酵母,其中5株菌(编号为YRNN1~YRNN5)被鉴定为扣囊复膜酵母(Saccharomycopsis fibuligera)和菌株YRJM被鉴定为酿酒酵母(Saccharomyces cerevisiae)。菌株YRNN5产β-苯乙醇最高(22.98 mg/L),将其作为甜酒增香菌株应用于不同原料酿造甜酒。甜酒香气成分分析结果表明,籼米甜酒的β-苯乙醇和乙酸苯乙酯含量分别为771.38 mg/L、2.90 mg/L,显著高于籼糯米甜酒(P<0.05),籼米甜酒和籼糯米甜酒的乙醇含量分别为15.15%vol和12.80%vol,无显著性差异(P>0.05)。本研究筛选出的扣囊复膜酵母产β-苯乙醇能力优于酿酒酵母,能提高甜酒的典型的蜜香和花香,籼米甜酒的整体风味优于籼糯米甜酒,菌株YRNN5和籼米可以作为甜酒发酵的产香酵母和优良原料。

