1型自身免疫性胰腺炎合并自身免疫性肝炎一例
余畅 马可 余洲 赵礼金
病人,男,32岁。因腹痛、皮肤巩膜黄染10天于2018年8月14日入院。10天前出现腹痛伴皮肤巩膜黄染,呈进行性加重,治疗无好转,并伴有腹胀等不适。半月前病人曾考虑为胰腺炎并住院治疗。体格检查:全身皮肤巩膜轻度黄染,腹部平坦,上腹部深压痛,无反跳痛及肌紧张,墨菲氏征(-),肝脾未触及,移动性浊音阴性。2018年8月14日急诊腹部CT检查提示:(1)胆囊泥沙样结石;(2)胆总管下段梗阻;(3)左肾结石。2018年8月15日腹部磁共振(MRI)检查提示:可疑胆囊炎,胰头钩突性病变并梗阻性胆道扩张。血常规:白细胞10.06×109/L,血红蛋白135 g/L。丙氨酸氨基转移酶(ALT) 205 U/L,门冬氨酸氨基转移酶(AST )98 U/L,碱性磷酸酶(ALP )320 U/L,谷氨酰转移酶(GGT )823 U/L,总胆红素(TBIL )375 μmol/L,直接胆红素(DBIL )202.5 μmol/L,血淀粉酶无异常,CA19-9 104 U/ml,铁蛋白819.2 μg/L,甲胎蛋白及癌胚抗原正常,乙肝五项、艾滋病病毒(HIV)、梅毒均未见异常。诊断为梗阻性黄疸, 胰头癌可疑,炎性肿块可疑。完善术前准备后于2018年8月16日行ERCP+ENBD术(图1)。术中显示:左肝内及肝外胆管显影,右肝胆管、胆囊、胰管均未显影,胆总管下段长约3 cm狭窄,肝外胆管直径最粗达14 mm,置入鼻胆管持续引流并固定,术后予抑酶、制酸、保肝等治疗。2018年8月21日复查腹部CT提示胰腺钩突低密度影,水肿或占位(图2)。复查肝功能:TBIL 501.6 μmol/L,DBIL 254.7 μmol/L。病人黄疸加重,考虑鼻胆管引流不畅。2018年8月23日行PTCD减黄治疗。1个月后再次入院。于2018年9月14日行腹腔镜胰十二指肠切除术,术中肝脏未见肿块,胆囊增大,胆总管扩张,直径约15 mm;胰腺钩突质地较硬,侵犯肠系膜上静脉,术中出血100 ml。术后予抗感染、抑酸、保肝等治疗,病理结果提示:自身免疫性胰腺炎(图3)。术后诊断:(1)梗阻性黄疸 ;(2)1型自身免疫性胰腺炎。1年后门诊复查肝功能:ALT 153 U/L,AST 106 U/L,ALP 1 008 U/L,GGT 274 U/L,TBIL 32.9 μmol/L,伴有全身皮肤瘙痒,无腹胀腹痛、无恶心呕吐等。入院后予保肝等对症处理,查自身免疫性肝炎抗体:抗核抗体(ANA)1∶100弱阳性、1∶40阳性、1∶80弱阳性,免疫球蛋白E 326 IU/ml,抗核抗体谱阴性,考虑自身免疫性肝炎。目前,经保肝治疗后转氨酶指标呈下降趋势,暂不考虑激素治疗。随诊:病人持续肝功能异常曾就诊多家医院,查血IgG4抗体阳性,服用激素1个月后效果欠佳,并发胃溃疡后停药。现病人基本生活自理,饮食正常。定期门诊复查肝功能。

a.十二指肠降段乳头呈椭圆形,开口绒毛状,口侧隆起明显。b.胆总管下段长约3 cm狭窄,肝外胆管直径最粗达14 mm

a.腹部CT平扫显示胰腺钩突低密度影,水肿或占位;b.增强扫描胰腺钩突部见片状弱强化,胃-十二指肠乳头部-胆总管-肝门区胆管走行区管状影,考虑ERCP术后表现
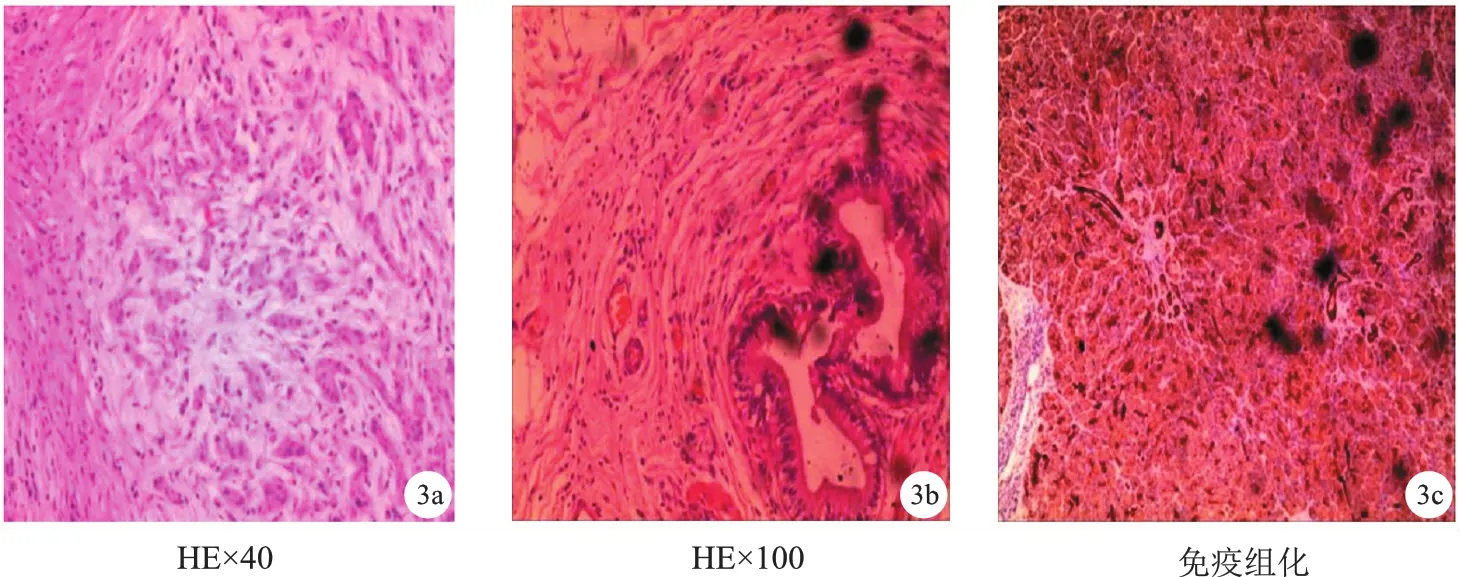
a.胰腺腺泡萎缩甚至消失,间质大量纤维组织增生,HE×40;b.硬化伴大量淋巴细胞、浆细胞及少量嗜酸性粒细胞浸润,HE×100;c.免疫组化见IgG(浆细胞+),IgG4阳性浆细胞<40%,Ki-67<1%;CD138浆细胞(+);CEA(-);CK19(-),肝门淋巴结(5枚)反应性增生。
讨论自身免疫性胰腺炎(AIP )属于罕见疾病,其发病率≤1/10万[1]。目前,AIP分为两种类型,AIP 1型又称为IgG4 相关AIP,病理描述为淋巴浆细胞硬化性胰腺炎,通常与IgG4和血清自身抗体阳性相关[2]。AIP 2型的病理描述为特发性导管中心型胰腺炎。2型AIP偶尔与炎症性肠病并存(16%~30%),可通过程序性死亡受体配体1(PD-L1)帮助确诊[3-4]。Gupta 等[5]提出了滤泡性胰腺炎,男性老年病人发病率较高,组织学特征包括大量淋巴滤泡存在,同时IgG4+浆细胞计数低,IgG4/IgG比率低。
IgG4-AIP发病机制可能与免疫、遗传、感染等因素相关。血清IgG4升高可能与Th1/Th2免疫平衡、通过Toll样受体(TLR)激活固有免疫、调节性T细胞(Treg)有关,激活胰腺慢性炎症和组织纤维化[6-7]。临床表现常以急性胰腺炎为首发表现,常有慢性腹痛持续发作,伴有黄疸、消瘦等症状[6]。CT检查显示胰腺弥漫性肿大伴增强延迟、多发性主胰管狭窄且不伴远端胰管扩张;特征性表现为“腊肠形”胰腺弥漫性肿大,并常伴有胰腺外器官受累表现[6]。血清学IgG4浓度≥1.35 g/L为诊断AIP的一个重要指标。其他指标还包括高γ球蛋白血症、抗核抗体及类风湿因子阳性及CA19-9异常等[8]。组织病理学检查诊断1型AIP标准为 IgG4/IgG 阳性细胞>40%或高倍镜下观测IgG4浆细胞>10个,典型特征包括席纹状纤维化、闭塞性脉管炎等[7]。影像学和实验室检查均缺乏特异性,临床上超声穿刺可以辅助诊断[9]。对于疑似胰腺癌行手术治疗的病人,可以达到诊断与治疗的双重效果,术后疾病也能缓解[1]。
IgG4相关疾病(IgG4 related-disease,IgG4-RD)是一个或多个器官的慢性纤维炎症性疾病。血清IgG4浓度升高和表达大量IgG4浆细胞浸润是该疾病的关键诊断特征,累及的器官包括胰腺、胆管、肝脏、唾液腺等[10]。若累及肝脏引起自身免疫性肝炎(autoimmune hepatitis AIH)。有研究指出,IgG4-AIH常继发于硬化性胆管炎(IgG4-SC)和(或)I型AIP,血清学检查中IgG4抗体增高,且AST值较非典型AIH高。诊断标准:(1)血清IgG4浓度>1.35 g/L;(2)肝组织中IgG4细胞增多>10 每高倍视野HPF;(3)慢性肝炎伴带状和桥状坏死或广泛塌陷;(4)其他器官表达IgG 4抗体异时或同步关联[11]。本例病人肝功能持续异常,自身免疫性抗体ANA示阳性,考虑为AIH,但病人未做肝脏活检,故未能确定病理形态结果。
IgG4-AIP治疗,激素初始诱导剂量应从每天0.6~1.0 mg/kg,治疗2~4周后进行影像学评估,症状缓解者再用2.5~10 mg维持治疗3~6个月。日本指南建议对于症状缓解病人可予2.5~5.0 mg/d 维持半年,在影像学和血清学改善的情况下3年内终止治疗,对于反复发作或服用激素副作用明显者,利妥昔单抗、硫唑嘌呤、6-巯基嘌呤等免疫调节剂是有效的备选方案[6]。
IgG4-RD同时累及胰腺和肝脏临床极少见。本例行胰十二指肠切除术后腹痛及黄疸得到缓解,手术对AIP治疗具有可行性,但ALT、AST长期维持在较高水平,可能是早期未能规律行激素缓解治疗,且病人服用激素后副作用大。应警惕肝功能持续损害引起肝衰竭或引起多个器官发生自身免疫性疾病,可考虑加用免疫调节剂治疗,需要定期随诊。

