元宝枫籽多肽的制备及其抗氧化性的研究
刘速速,李文凯,孙华*,周庆礼,于功明,马强
(1.天津科技大学 食品科学与工程学院,天津 300457;2.齐鲁工业大学 食品科学与工程学院,济南 250353;3.上海海洋大学 食品学院,上海 201306)
近年来,由于化学抗氧化剂作为食品添加剂的不安全性,具有清除羟自由基、超氧阴离子等能力的抗氧化肽成为当前研究的热点,这些自由基在人体正常生理代谢过程中会少量产生并处于动态平衡中,维持在一定水平。然而在年龄增长、身体受到创伤或在某些病理条件下,体内自由基过剩就会引发人类的许多疾病,例如:癌症、衰老、动脉硬化等[1]。抗氧化肽能有效地降低人体过剩的氧自由基水平,保护细胞和线粒体的正常结构及功能,防止脂肪过氧化,并且帮助机体抵御疾病[2]。
元宝枫因其翅果形状似中国古代的金元宝而得名[3],属于槭树科、槭树属,落叶乔木,是我国特有的树种。元宝枫种仁中含有丰富的化学成分,在张玉伟等的研究中元宝枫种仁70%乙醇提取物的化学成分鉴定出12种,大多为天然多酚类物质、黄酮类化合物。在王性炎等的研究中,元宝枫籽油中富含有特殊生理功能和药理作用的神经酸。元宝枫籽本身也富含蛋白质,且不含淀粉,这是植物种籽中少见的。据测定,元宝枫籽蛋白质中含有8种人体必需的氨基酸,属完全蛋白质,是理想的蛋白质资源,可作为制备食品蛋白的新资源[4-5]。元宝枫籽作为特种植物油脂新食品原料之一,含有较高含量的不饱和脂肪酸和其他多种微量元素,将其应用于食品中能够更加突出食品的风味与营养,赋予食品特殊的香味与口感,在一定程度上起到调味的作用;同时以元宝枫籽为原料制备的抗氧化肽可以制成调味品,能够提升食品的风味,并且元宝枫籽抗氧化肽也为发酵调味品提供了一定的理论基础。
本试验以元宝枫籽为原料,制备具有生物活性的多肽。通过正交试验设计,优化水解条件,以获得最佳的多肽得率。此外,通过体外清除自由基试验研究了抗氧化肽的抗氧化活性[6]。
1 材料与方法
1.1 材料与仪器
元宝枫:潍坊绿元生物科技有限公司提供;胰蛋白酶、木瓜蛋白酶、碱性蛋白酶、中性蛋白酶:均购自Novo公司;1,1-二苯基-2-三硝基苯肼(DPPH):美国Sigma公司;石油醚、乙醇、盐酸:购自成都市科龙化工试剂厂;其他化学药品和试剂:均为分析级,购自上海国药集团化学试剂有限公司。
UV-1800PC型紫外分光光度计 上海棱光技术有限公司;离心机 湖南湘仪实验室仪器有限公司;电子分析天平 德国赛多利斯股份公司;恒温水浴锅 江苏金坛市维诚实验器材有限公司;pH计 上海智光仪器仪表有限公司;干燥箱 上海医疗器械五厂。
1.2 蛋白组分的制备和提取
将元宝枫种仁籽粕卷入滤纸筒中,滤纸筒上端不超过虹吸管上管口。用索氏抽提法提取分离油脂(抽提溶剂为石油醚,在温度(85±2) ℃水浴中抽提3 h。将残渣在破碎机中打碎,过60目筛后,再将残渣置于研钵中研细后过筛,置于40 ℃恒温烘箱中烘干,得到元宝枫种仁脱脂粉,即元宝枫籽粗蛋白。
1.3 蛋白酶的筛选
配制质量分数为2%的元宝枫籽蛋白溶液,选用4种蛋白酶(见表1),作为元宝枫籽蛋白酶解法制备抗氧化肽的备选酶[7-9]。分别调节至各自最适 pH、温度下,分别添加15000 U/g的蛋白酶量,并在水解过程中不断添加0.5 mol/L的碱液,用移液枪移取碱液,记录数据,前1 h每10 min记录一次 0.5 mol/L NaOH溶液用量,然后每0.5 h记录一次直至水解过程结束,根据NaOH的最终用量得到水解度。酶解时间均为 4 h,随后沸水浴加热10 min使酶钝化,样品冷却后在10000 r/min离心15 min,取出上清液,测定酶解物DPPH清除率[10]。
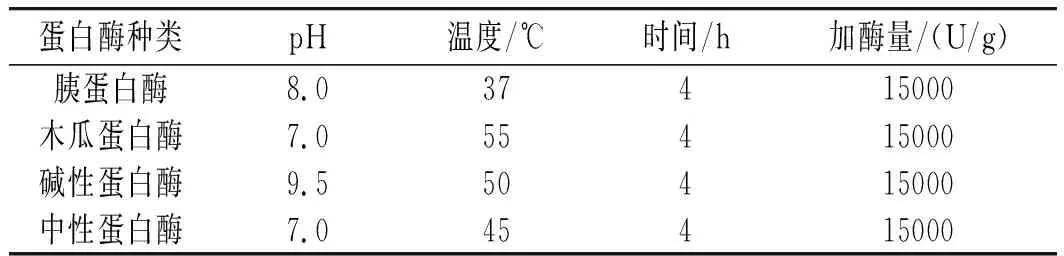
表1 4种酶水解的最佳反应条件Table 1 The optimal reaction conditions for hydrolysis of four enzymes
1.4 单因素试验
通过单因素试验考察pH、加酶量、酶解时间、底物浓度等因素对样品酶解度、产物DPPH清除率的影响。
1.5 正交试验
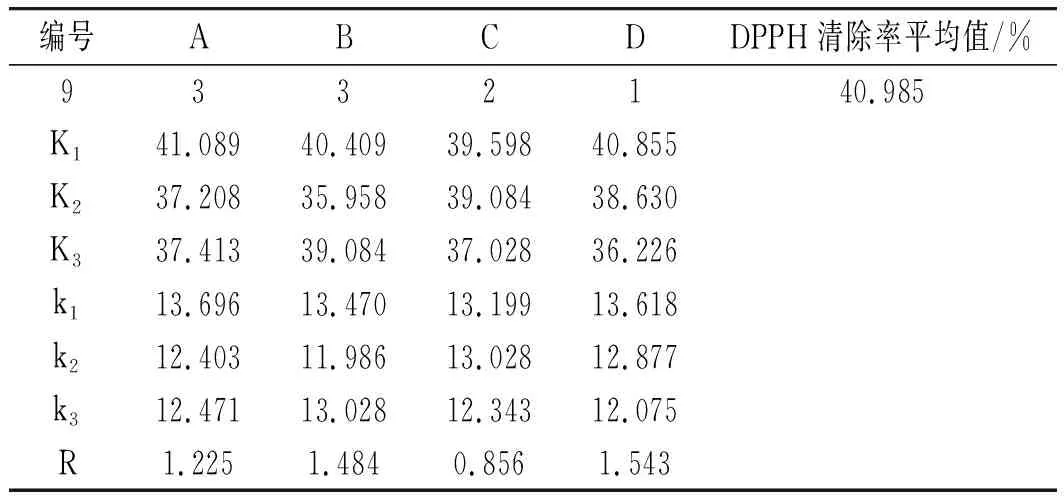
采用正交试验设计,考察pH、加酶量、酶解时间、底物浓度4个自变量对样品水解度和产物清除DPPH自由基活性的影响。在初步单因素试验的基础上,选择了自变量的取值范围,独立变量的编码级别见表2[11]。每个试验重复3次,见表3。所有试验均按随机顺序进行。
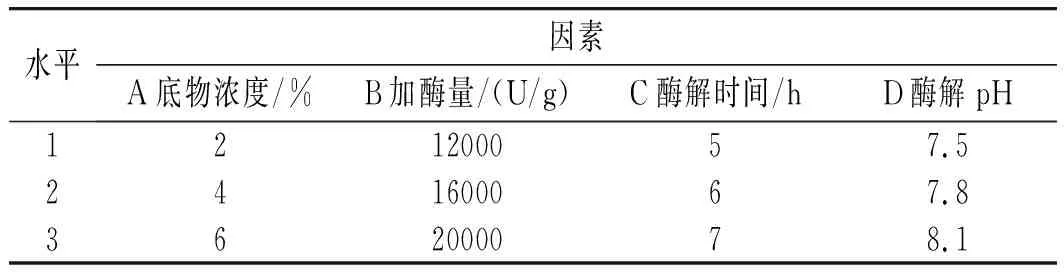
表2 正交试验因素及水平Table 2 The factors and levels of orthogonal experiment
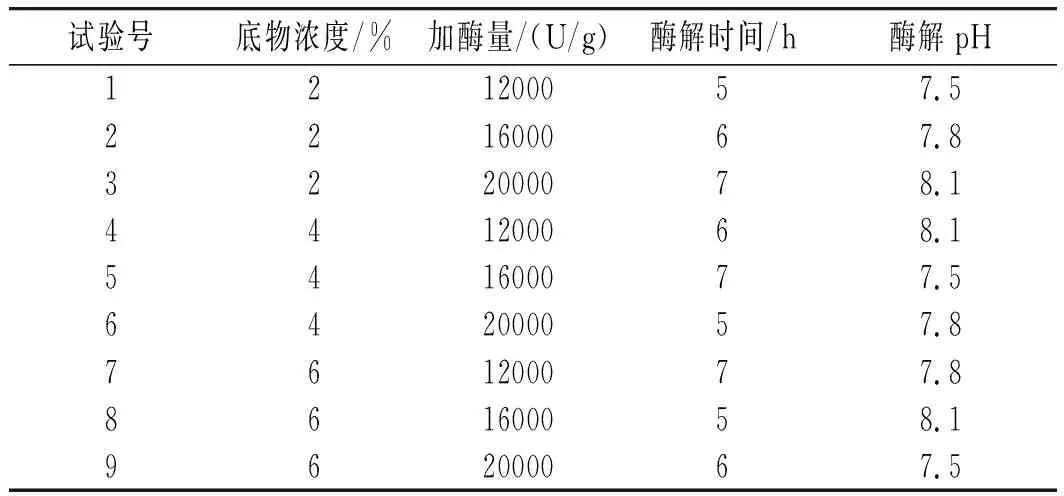
表3 正交试验结果Table 3 The results of orthogonal test
1.6 不同分子量元宝枫籽肽的微滤分离处理
将酶解后的元宝枫籽蛋白溶液先过1.2 μm微滤膜,再过0.45 μm微滤膜[12]。将经过微滤的元宝枫籽蛋白酶解液进行超滤分离。
1.7 多肽稳定性的研究
对活性最高的组分进行稳定性分析,考察了温度、pH、NaCl浓度和葡萄糖浓度对稳定性的影响。配制样品浓度为5 mg/mL,分别测定其DPPH自由基清除率。
1.8 测定指标
蛋白质在水解过程中被断裂的肽键数占其总肽键数的百分比称为水解度。本次试验中采用pH-stat法对水解度进行测定,在水解过程中不断添加0.5 mol/L的NaOH溶液,在前1 h中每间隔 10 min记录一次0.5 mol/L NaOH溶液用量(mL),然后每0.5 h记录一次碱液添加量直至水解过程结束,根据NaOH的最终用量,得到水解度。水解度计算公式如下:
式(1)
式中:B为水解过程 0.5 mol/L NaOH的消耗量(mL);Nb为水解所用NaOH的浓度(mol/L,此试验中为0.5 mol/L);Mp为参加水解的元宝枫籽蛋白质量(g);htot为单位质量原料元宝枫籽蛋白中肽键的总数(mmol/g,试验采用元宝枫籽蛋白为原料,根据蛋白质氨基酸种类和百分含量计算htot= 8.232)。
α-元宝枫籽蛋白氨基的平均解离度按式(2):
式(2)
式中:pH为酶解过程中反应液的pH;pK为α-NH3+的解离常数(通常取数值7)。
DPPH清除率的测定:取不同质量浓度的多肽液稀释液2 mL,加入2 mL 0.1 mol/L DPPH无水乙醇溶液,混匀后在室温避光反应30 min,在 517 nm波长处测定吸光度,清除率计算见公式(3):

式(3)
式中:Ac为用无水乙醇代替样品液时的吸光度;Aj为加样品用无水乙醇代替DPPH时的吸光度;Ai为加样品与DPPH时的吸光度(DPPH的乙醇水溶液颜色为深紫色,当加入抗氧化物后,自由基被清除,DPPH溶液在517 nm处的吸光值减少,此时溶液的颜色将会从紫红色褪至淡黄色)。
1.9 统计学分析
采用SPSS 17.0统计软件进行统计分析。所有试验重复3次,对所得数据进行方差分析(ANOVA),均数差异采用Duncan检验(p<0.05)。
2 结果与讨论
2.1 不同种类的蛋白酶对制备元宝枫籽功能性肽的影响
蛋白酶种类的选择是酶解试验中最重要的因素之一,4种蛋白酶活力及其理论最佳水解条件见表4,在此控制水解时间均为4 h。
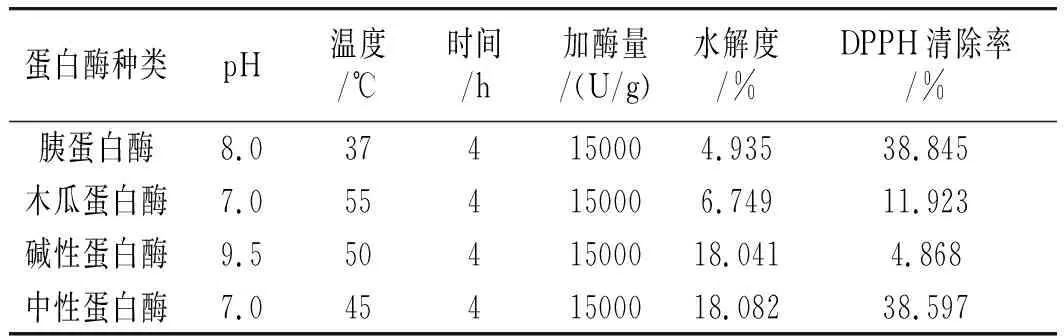
表4 不同蛋白酶理论最佳水解条件Table 4 The optimal theoretical hydrolysis conditions for different proteases
由表4可知,控制添加相同的酶量条件下,将不同的酶维持在其最适的水解条件。从酶的水解度看,4种蛋白酶水解能力由强到弱的顺序依次为中性蛋白酶>碱性蛋白酶>木瓜蛋白酶>胰蛋白酶。比较酶解液DPPH清除率可知,用胰蛋白酶酶解得到的水解液DPPH清除率为38.845%,高于中性蛋白酶和木瓜蛋白酶等其他蛋白酶水解液的DPPH清除率。
已有研究证明蛋白水解度在小于14%时得到的水解液的抗氧化值较高,水解度较低时(6%~8%)得到的多肽抗氧化能力反而较强[13]。因此综合水解度与抗氧化值的条件,选用胰蛋白酶作为元宝枫籽抗氧化肽制备的水解酶。
2.2 单因素试验
2.2.1 pH值对水解度和DPPH自由基清除率的影响
由图1可知,随着pH值从7.5增加到7.8时,水解度和DPPH自由基清除活性增加。当pH值从8.4增加到8.7时,水解度下降;当pH值从7.8增加到8.7时,DPPH自由基清除活性下降。由于每个蛋白酶都有各自的最适pH值,当pH值高于或低于最适pH值时,蛋白酶可能发生变性或失活。因此,选择pH值为7.8进行进一步的研究。
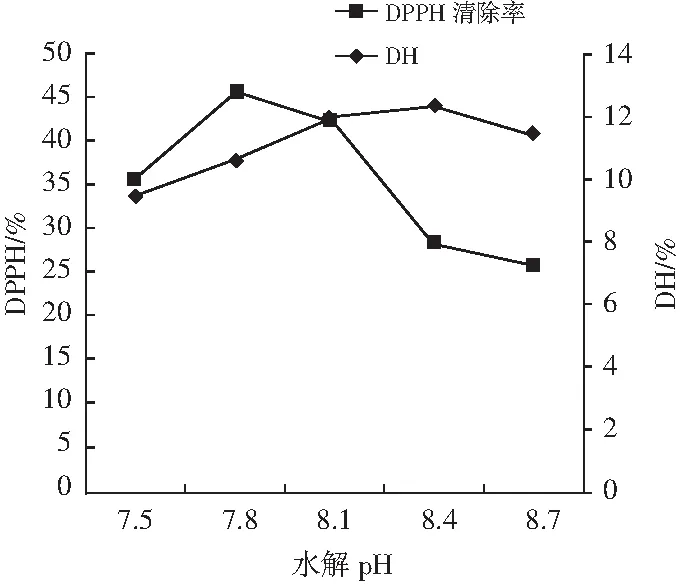
图1 酶解pH对水解度和DPPH自由基清除率的影响Fig.1 Effect of enzymatic hydrolysis pH values on hydrolysis degree and DPPH radical scavenging rate
2.2.2 加酶量对水解度和DPPH自由基清除率的影响
由图2可知,随着胰蛋白酶用量的增加,元宝枫蛋白的水解度和DPPH清除率不断增加,当酶用量增加到一定程度后,水解度增加程度趋于平缓,但DPPH自由基清除率下降。胰蛋白酶用量在超过16000 U/g时,DPPH自由基清除率开始下降,且水解度的增幅也不是很明显,仅为0.484%。因此,试验较适酶用量为16000 U/g。
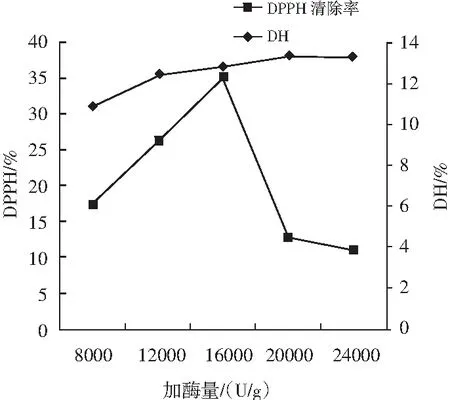
图2 加酶量对水解度和DPPH清除率的影响Fig.2 Effect of enzyme additive amount on hydrolysis degree and DPPH radical scavenging rate
2.2.3 酶解时间对水解度和DPPH自由基清除率的影响
由图3可知,在酶解时间为5~6 h时,水解度和DPPH清除率都在不断上升且十分迅速。6 h时水解度和DPPH清除率分别上升到13.765%和35.748%。6 h之后DPPH清除率快速下降,在7 h后基本不变。水解度在 6 h后仍在上升,7 h后增幅不大,趋于平缓。这可能是因为随着时间的延长,元宝枫籽蛋白的水解度也相应增加,而7 h后由于底物蛋白已经基本水解完全,因而水解度基本不变。但对于DPPH清除率,随着水解的进行,抗氧化肽的含量增加,所以 5~6 h之间DPPH自由基清除率不断升高。在6~7 h内,DPPH清除率下降,在7 h后趋势平缓。原因可能是随着时间延长,元宝枫蛋白的水解程度增大,多肽进一步酶解成小肽和氨基酸,所以使得最终的水解产物DPPH清除能力也逐渐减弱[14]。因此,酶解的较适合作用时间为6 h。
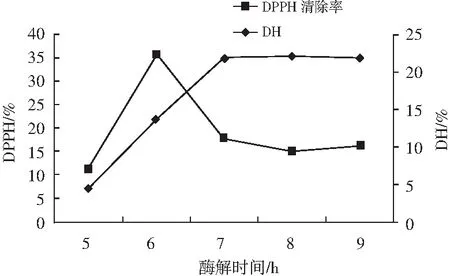
图3 酶解时间对水解度和DPPH自由基清除率的影响Fig.3 Effect of enzymatic hydrolysis time on hydrolysis degree and DPPH radical scavenging rate
2.2.4 底物浓度对水解度和DPPH自由基清除率的影响
由图4可知,随着底物浓度的不断加大,水解度的变化为先升高后逐渐降低,而DPPH自由基清除率的变化为先降低后趋于平缓。在底物浓度为4%时,DPPH自由基清除率达到最大值,而水解度与试验中的最高水解度相比,下降了2.171%。由此现象分析可能为随着溶液底物浓度的不断增大,酶解液的溶液粘度也不断增加,从而影响了蛋白酶扩散的同时水分活度也相应降低,对水解反应有一定的抑制作用。在蛋白水解过程的相关研究中,吕桂善等[15]发现蛋白酶的水解性与酶活性的抑制之间没有相关性,因此也说明将水解度选取为检测指标是不合适的,应该将所得酶解物生物活性大小作为主要的抗氧化肽活性检测指标。所以,在本次试验中选取酶解物的DPPH自由基清除率作为主要的参考指标,综合以上各因素考虑,选择4%作为最佳底物浓度。
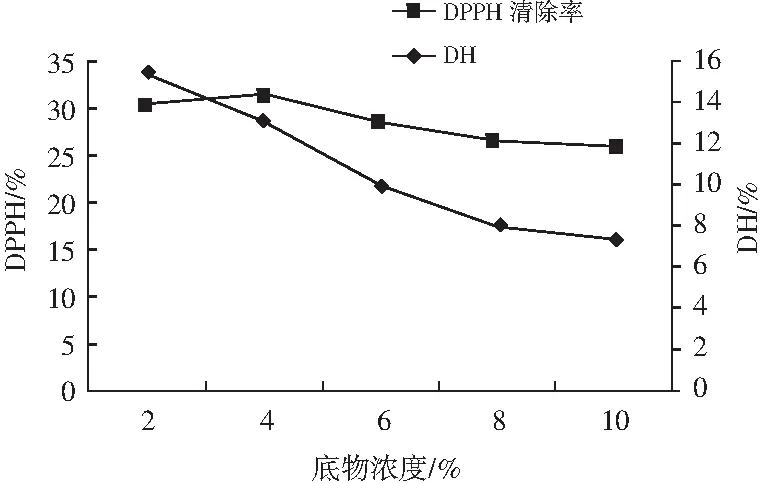
图4 底物浓度对水解度和DPPH清除率的影响Fig.4 Effect of substrate concentration on hydrolysis degree and DPPH radical scavenging rate
2.2.5 正交试验结果
根据上一步的单因素试验确定出各因素的最佳范围,在此基础上选择4个因素对胰蛋白酶的酶解条件进行四因素三水平的正交试验进一步优化试验方案[16],正交试验结果见表5。
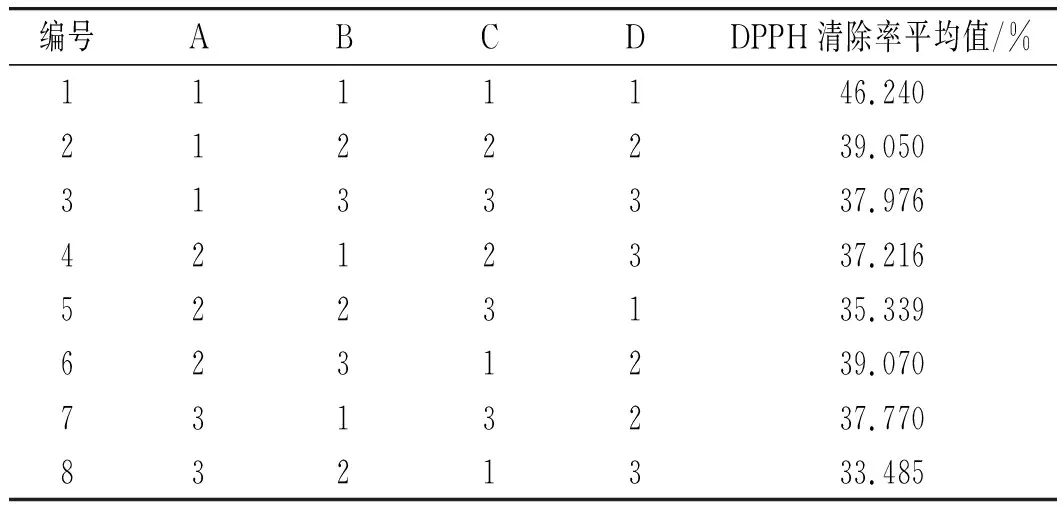
表5 正交试验结果Table 5 The orthogonal experiment results
由表5中极差R值可知,4个因素对酶解效果的影响程度顺序为D pH>B 酶用量>A底物浓度>C酶解时间,酶解提取最佳组合条件为A1B1C1D1,即最佳酶解条件为:底物浓度2%、酶用量12000 U/g、酶解时间5 h、pH值7.5。根据此最佳工艺条件进行3次重复验证试验操作,实际测得的水解度平均值为46.2%,超过了此前理论最佳酶解条件下测得的DPPH清除率值 35.9%,因此下一步的酶解条件选取正交优化后的。
2.3 超滤
2.3.1 各组分对DPPH自由基的清除率
采用超滤膜生物反应器对水解产物在最佳条件下的上清液进行分离[17]。对微滤液进行超滤,分别用分子量为10,5,3 kDa的超滤膜进行分离,各组分对DPPH自由基的清除率见图5。
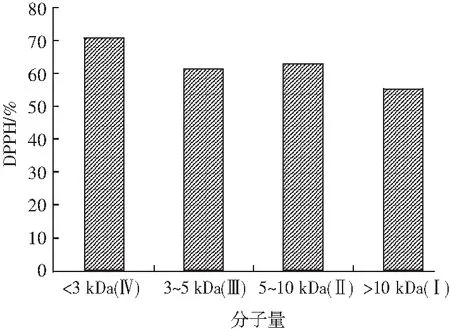
图5 超滤分级后各组分的DPPH自由基清除率Fig.5 DPPH free radical scavenging rate of each component after ultrafiltration
由图5可知,分子量<3 kDa的抗氧化活性最高,达到70.4%。纯化前酶解产物对DPPH自由基的清除活性为46.2%,明显高于纯化前酶解产物对DPPH自由基的清除活性。组分1和组分3对DPPH自由基的清除活性相似,分别为62.7%和61.3%。组分2的DPPH自由基清除活性为55.4%,是超滤得到的组分中最低的,但仍比未纯化前提高约9.2%,原因可能是超滤除去了大部分的纤维、矿物元素、盐等,提高了多肽的纯度。
2.3.2 抗氧化肽稳定性的研究
2.3.2.1 温度对DPPH自由基清除率的影响
由图6可知,在20~60 ℃时DPPH自由基清除率变化不大;60~100 ℃时,DPPH自由基清除率下降,抗氧化活性与肽的结构密切相关,这可能是由于加热引起的多肽构象变化。随着温度的逐渐升高,会破坏肽的二级结构,导致抗氧化活性的丧失[18]。本试验结果表明,在20~60 ℃之间,元宝枫籽抗氧化肽对DPPH自由基的清除活性保持稳定。
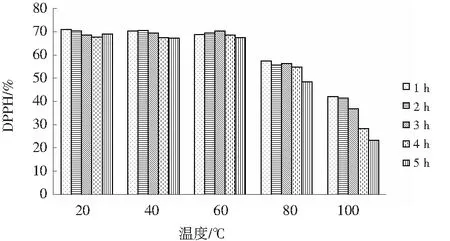
图6 不同温度及时间下的DPPH清除率Fig.6 DPPH free radical scavenging rates at different temperatures and time
2.3.2.2 pH对DPPH自由基清除率的影响
由图7可知,在pH为7条件下保存时,DPPH自由基清除率随着时间的延长几乎不变,无显著差异;而在偏酸(pH 4)或者偏碱(pH 10)条件下,DPPH自由基清除率均呈现下降的趋势,且在偏酸条件下,4 h时的DPPH自由基清除率降低幅度最大,而在偏碱条件下,5 h时的DPPH自由基清除率降低幅度最大。对于过酸(pH 1)或者过碱(pH 13)环境,元宝枫籽功能性肽的DPPH自由基清除率大幅度下降,但过碱条件下DPPH自由基清除率下降幅度更大。原因可能是元宝枫籽蛋白的酶解产物是应用胰蛋白酶在pH为7.8的条件下制备的,酶解条件接近于中性pH偏高后,就会使得其抗氧化活性降低[19]。
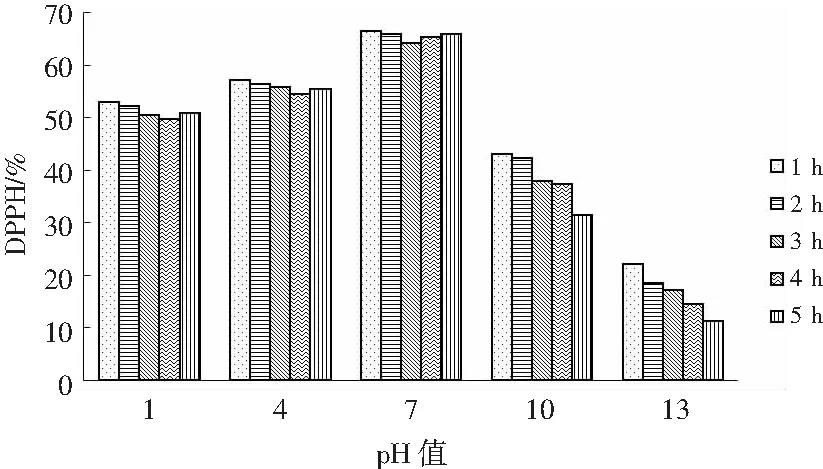
图7 不同pH及时间下的DPPH清除率Fig.7 DPPH free radical scavenging rates at different pH values and time
2.3.2.3 NaCl浓度对DPPH自由基清除率的影响
研究NaCl溶液浓度对抗氧化多肽稳定性的影响是由于NaCl在食品加工生产过程中经常被用到,因此将分子质量小于3 kDa的元宝枫籽抗氧化肽溶于不同浓度的盐溶液中,比较5 h内DPPH自由基清除率的不同,试验结果见图8。

图8 不同盐浓度及时间下的DPPH清除率Fig.8 DPPH free radical scavenging rates at different salt content and time
由图8可知,不同浓度NaCl溶液的加入对元宝枫籽抗氧化肽的DPPH自由基清除活性有较大影响。当NaCl浓度为0.2%和0.8%时,样品溶液中DPPH自由基清除率较高。当NaCl浓度大于0.8%时,DPPH自由基清除率迅速下降。由此可见,元宝枫籽抗氧化肽对NaCl溶液具有不稳定性,因此,在食品加工中进行脱盐处理[20]。
2.3.2.4 葡萄糖浓度对DPPH自由基清除率的影响
由图9可知,在元宝枫籽抗氧化肽中添加葡萄糖,随着葡糖糖浓度的增加,其DPPH自由基清除率不断下降,并且DPPH自由基清除率随着时间的延长会产生波动,但幅度不明显;当葡萄糖浓度升高到5%时,随着时间的延长,元宝枫籽抗氧化肽的DPPH自由基清除率继续降低。说明元宝枫籽抗氧化肽的抗氧化活性在葡萄糖浓度为1%~2%条件下保持稳定,随着葡萄糖浓度的升高会有不同程度的降低,当浓度达到5%时,DPPH自由基清除率降低更加明显。本试验测定的结果表明,1%~2%时,元宝枫籽抗氧化肽的DPPH自由基清除率无明显变化,而随着浓度的升高(>2%),其抗氧化活性有所降低,而温度继续升高(>4%),抗氧化活性明显下降,且随着时间的延长,其抗氧化活性降低更为迅速。
续 表
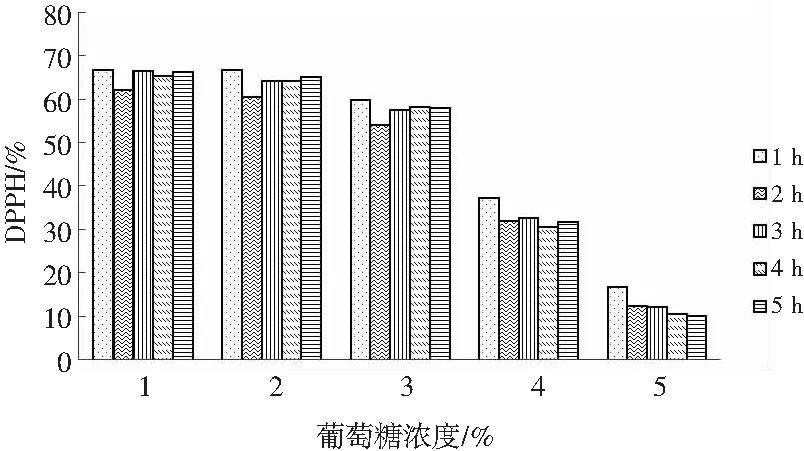
图9 不同葡萄糖浓度及时间下的DPPH清除率Fig.9 DPPH free radical scavenging rates at different glucose content and time
3 结论
本文根据水解度和抗氧化值的条件,选用胰蛋白酶为水解酶,以元宝枫籽为原料,制备了元宝枫籽抗氧化肽。以正交试验L9(34)为优化工艺,以底物浓度2%、加酶量12000 U/g、酶解时间5 h、pH值7.5为优化参数组合,DPPH自由基清除率为46.2%。对微滤后的溶液进行超滤,其分子量<3 kDa的抗氧化活性最高,达到70.4%。活性最高(<3 kDa)的组分通过稳定性试验进一步分析。各参数的最佳组合为20~60 ℃,pH 7,盐浓度0.2%或0.5%,葡萄糖浓度1%~2%。通过试验证明,元宝枫籽具有天然的抗氧化能力,将其应用在抗氧化食品领域中能够开拓良好的食品市场。

