基于“内皮损伤学说”探讨动脉粥样硬化的中医药防治策略
傅馨莹 孙正骥 张伟

摘要 基于“动脉粥样硬化内皮损伤学说”,探讨在动脉粥样硬化(AS)疾病发生发展过程中,血管内皮功能障碍与血管内皮损伤的联系及区别。阐述血管内皮功能障碍与血管内皮损伤的概念,从血管内皮细胞分泌的一氧化氮/内皮素(NO/ET)稳态,诱发的炎症反应及氧化应激的角度和激活的VECF、MAKP、JAK/STAT、PI3K-AKT通路出发,探讨动脉粥样硬化疾病进程中二者的联系与区别。通过检索Genecards数据库,筛选血管内皮功能障碍、血管内皮损伤及AS的相关靶点,从分子角度进一步论证。阐明中药对血管内皮功能障碍及血管内皮损伤的保护及修复作用。
关键词 血管内皮功能障碍;血管内皮损伤;动脉粥样硬化;Genecards数据库;中医药;炎症反应;氧化应激;内皮细胞
Abstract Based on the theory of atherosclerotic endothelial injury,this paper discusses the relationship and difference between vascular endothelial dysfunction and vascular endothelial injury in the course of occurrence and development of atherosclerotic diseases.This paper firstly describes the concepts of vascular endothelial dysfunction and vascular endothelial injury,and explores the relationship and difference between the two in the process of atherosclerotic disease from the point of view of NO/ET homeostasis secreted by vascular endothelial cells,inflammatory response and oxidative stress induced by vascular endothelial cells and activated VECF,MAKP,JAK/STAT,PI3K-AKT signaling pathway.Then the Genecards database were searched to screen the related targets of vascular endothelial dysfunction,vascular endothelial injury and AS,which were further demonstrated from the molecular point of view.Finally,the protective and repair effects of traditional Chinese medicine on vascular endothelial dysfunction and vascular endothelial injury were described.
Keywords Vascular endothelial dysfunction; Vascular endothelial injury; Atherosclerosis; Genecards database; Traditional Chinese medicine; Inflammatory response; Oxidative stress; Vascular endothelial cells
中圖分类号:R242;R256文献标识码:Adoi:10.3969/j.issn.1673-7202.2021.11.024
Ross[1]提出“动脉粥样硬化(Atherosclerosis,AS)内皮损伤反应学说”,认为血管内皮功能障碍发生在AS致血管内皮损伤前,并对血管内皮造成持续性的病理损伤,使功能障碍渐进性加重,从而致相关血管壁发生炎症反应及过度的慢性增生,进一步造成血管内皮损伤的病理性改变。自这一学说的提出后,血管内皮细胞(Vascular Endothelial Cells,VECs)成为一个新的研究方向及热点问题,多以血管细胞内皮功能障碍与AS的关系作为主要的切入点,但血管内皮功能障碍和血管内皮细胞损伤的联系及区别的研究较少。我们基于AS探讨血管内皮功能障碍及血管内皮损伤联系及区别,并探讨其可能的作用机制及中医药干预作用。
1 血管内皮功能障碍与血管内皮损伤的概念
VECs是位于血液和血管平滑肌之间的单层扁平上皮细胞,主要是作为一道机械屏障,还具有调节血管通透、水和分子的转运,调节血管的紧张度及流利度,维持凝血、抗凝平衡及正常的血液流变学,维持血管内平衡及修复血管壁等多种生理功能。当血管内皮受到血流冲刷、病原微生物、抽烟、机械损伤和脂质浸润等病理因素损害时,VECs可能发生血管内皮功能障碍或血管内皮损伤。
1.1 血管内皮功能障碍 血管内皮功能障(Vascular Endothelial Dysfunction)是指多种病理因素作用于VECs导致其分泌功能紊乱,使合成和分泌多种血管活性物质及细胞因子间的平衡被破坏,最终打破血管稳态。主要表现为一氧化氮(NO)等其他内皮衍生舒张因子(EDRFs)和内皮衍生超极化因子(EDHFs)合成减少或者活性减弱及内皮素(Endothelin,ET)等内皮衍生收缩因子(EDCFs)的分泌增加[2-3]。其中NO在维持血管稳态中起着重要作用,能被动转运进入血管中层平滑肌细胞(Smooth Muscle Cell,SMCs),抑制肌球蛋白轻链磷酸化致血管平滑肌舒张,维持血管舒缩功能。内皮源性的NO主要是通过NOS催化O2和L-精氨酸生成,体内存在3种NOS亚型,包括内皮性一氧化氮合酶(eNOS)、神经性一氧化氮合酶(nNOS)及诱生性一氧化氮合酶(iNOS)[4]。其中e NOS主要存在于VECs中,能通过VEGF通路的变化影响NO的合成。研究表明,随着AS疾病的发展,eNOS的表达及活性均下降,导致NO的合成减少[5-6]。
1.2 血管内皮损伤 血管内皮损伤(Vascular Endothelial Injury)是指血管内皮功能障碍发生后,在病理因素持续作用下,VECs为适应内外环境变化发生形态学和结构的改变,主要表现为细胞间的连接发生断裂,导致局部血管內皮结构不完整,通透性增加[7]。随着内皮损伤进一步加重,VECs表面黏附分子异常表达,黏附大量单核细胞及炎症细胞,在单核细胞趋化蛋白-1的作用下迁移至血管内皮间隙,分化为巨噬细胞,并吞噬脂质转化为泡沫细胞,使局部血管壁发生过度的慢性炎症增生;或者VECs表面产生并累积细胞活性氧(ROS),胞质内Ca2+水平随之增加,Ca2+内流消耗腺嘌呤核苷三磷酸(ATP),使ATP减少[8-9]。与此同时,ROS产生增多,伴随eNOS表达下降,使NO合成减少,导致局部血管发生氧化应激[10]。当VECs受到损伤发生炎症反应时,产生的多种细胞因子和细胞膜表面受体结合,激活JAK/STAT通路,活化的JAK磷酸化产生的SHF2与GRB相互作用形成的结合物,加速SOS的激活。VECs内活化的SOS通过激活PI3K-AKT通路的方式促进核因子κB、TNF-α的表达,在调节氧化应激和炎症反应的发生、发展的过程中发挥重要作用[11-12]。
1.3 AS疾病进程中的血管内皮功能障碍及血管内皮损伤 AS是由于众多病理因素作用于VECs使其功能及结构发生异常,产生的一系列血管内皮功能障碍或血管内皮损伤的病理过程。生理情况下,机体内NO/ET保持动态平衡。血管内皮功能障碍时NO合成减少、ET分泌增加,二者的稳态被打破是AS的起始环节。体内大部分的NO是由VECs中的e NOS产生,e NOS主要通过VEGF通路变化合成NO,VEGF通路的激活可以促进VECs膜表面的VEGFR2受体活化,增加细胞内PI3K含量,诱导催乳素诱导蛋白3(Prolaction Induced Protein 3,PIP3)基因表达,促进AKT磷酸化,使PI3K-AKT通路激活;或通过AKT磷酸化增强e NOS的活性与表达,促进NO的合成[13]。NO具有抑制血小板黏附和聚集及黏附分子表达,减少炎症细胞浸润及SMCs增殖和迁移的作用[14]。ET作为一种重要的EDCFs,能调控血管收缩,促进血管MSCs分化增殖。NO合成减少是由于机体脂质代谢紊乱条件下,ox-LDL降低eNOS活性和表达导致的,能造成血管内皮功能障碍,加速AS疾病进程[5]。ET在机体缺血缺氧时分泌增加[15],能诱导eNOS磷酸化改变脑循环,或激活某些补体,诱导活性氧(ROS)产生,或直接与SMCs表面ET受体结合,诱导血管收缩,加重AS血管内缺血缺氧情况。
AS疾病进程中血管内皮功能障碍发生后,机体内NO/ET稳态被打破,VECs表面的黏附分子异常表达,ROS水平升高,同时多种病理因素持续作用于VECs,使血管内皮结构出现病理性损伤,进一步诱导VECs炎症反应和氧化应激。生理条件下,黏附分子能维持正常的血管内膜结构,介导VECs间或与细胞外基质间结合,分泌的ROS具有信息转导作用。血管内皮损伤时,炎症细胞分泌大量炎症介质和血管活性物质,并迁移至受损血管区,激活JAK/STAT及MAPK通路,诱导VECs表面黏附分子异常表达。异常表达的黏附分子与单核细胞或炎症细胞结合,使血管内膜通透性增大,并向血管内膜侵袭,分化成巨噬细胞,吞噬脂质转化为泡沫细胞,同时刺激SMCs增殖分化,加快AS斑块的形成和发展。生理情况下,ROS作为机体代谢的中间产物通过细胞代谢途径产生,与超氧化物歧化酶(SOD)保持生成与清除的动态平衡[16]。血管内皮损伤时,巨噬细胞生成,同时ROS/SOD生成与清除稳态被打破,机体内ROS水平升高[17]。ROS进一步与NO结合生成具有强氧化作用的过氧化硝酸阴离子(ONOO-),通过降低eNOS活性,使NO合成减少和生物利用度降低,从而加重VECs功能的紊乱[18]。ONOO-还参与炎症细胞浸润的血管内膜损伤过程,促进AS疾病发展[19]。
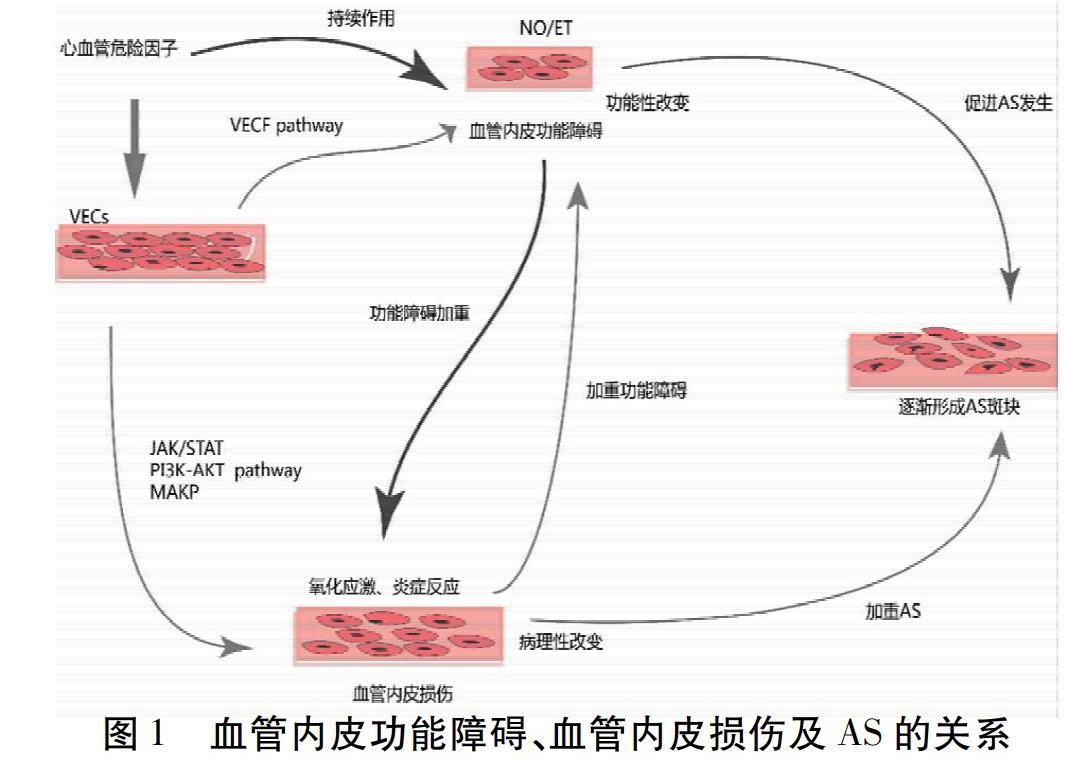
血管内皮功能障碍发生于AS致血管内皮损伤前,血管内皮功能障碍时,VEGF通路激活,NO/ET的稳态被打破,导致AS疾病的发生发展。同时,持续性的病理损伤VECs,诱发炎症反应及氧化应激,通过诱导VECs表面黏附分子的异常表达,炎症细胞迁移聚集于受损血管内膜区,促使管壁增厚、管腔狭窄,通过MAPK、PI3K-AKT、JAK/STAT、NF-κB等通路的变化,加快AS斑块的形成,促进AS疾病进程发展。机体ROS水平升高,抑制eNOS活性,减少NO生成,加重血管内皮功能障碍。见图1。VECs功能及结构异常贯穿AS疾病的进程。AS的发病机制一直是医学界的研究热点,涉及多种学说,如内皮损伤学说、氧化应激学说、炎症反应学说、脂质浸润学说、基因蛋白学说等都不能完全解释AS的发病机制[20]。目前比较差异靶点对AS疾病的发病机制是心血管领域研究的热门话题,根据靶点的筛选诊断AS疾病的阶段可以作为未来研究的切入点。
2 基于Genecards数据库对血管内皮功能障碍、血管内皮损伤及AS关系异同
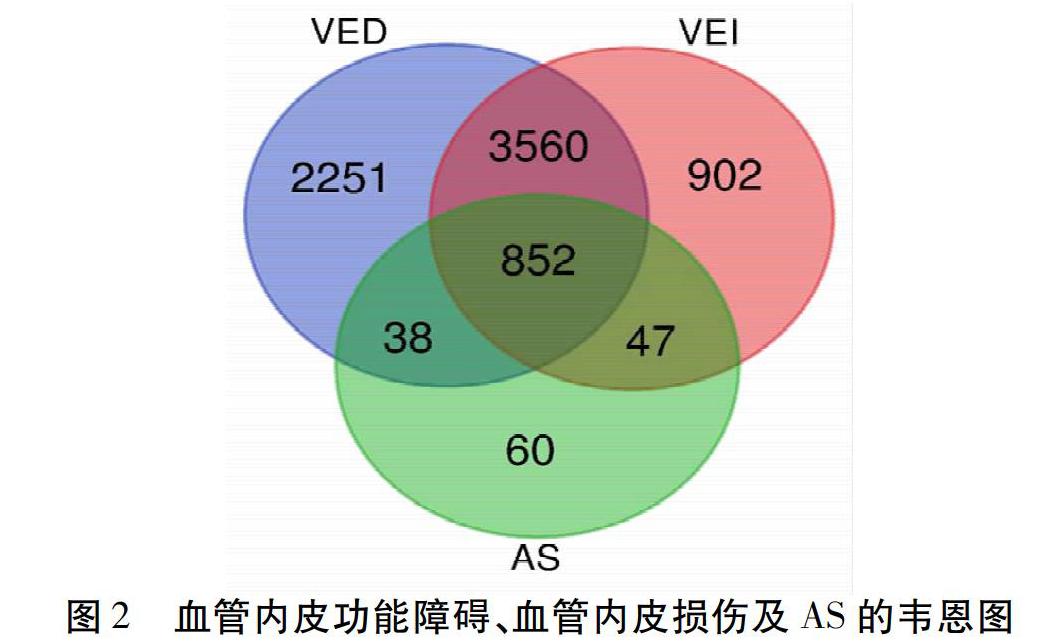
通过GeneCards(https://www.genecards.org/)数据库,分别以“Vascular Endothelial Dysfunction”“Vascular Endothelial Injury”“Atherosclerosis[MeSH]”为检索词,收集血管内皮功能障碍、血管内皮损伤及AS相关的作用靶点。通过Bioinformatics Gent(http://bioinformatics.psb.ugent.be/beg)中Van de Peer Lab取交集获得血管内皮功能障碍、血管内皮损伤及AS的共同靶点及差别靶点,并绘制韦恩图。见图2。通过GeneCards数据库数据,收集到6 701个血管内皮功能障碍靶点,5 361个血管内皮损伤靶点,997个AS靶点。利用Bioinformatics Gent取交集获得血管内皮功能障碍、血管内皮损伤及AS的共同靶点及差别靶点,得到韦恩图。见图2。
图2提示,血管内皮功能障碍及血管内皮损伤相关且能导致AS的靶点有852个。血管内皮功能障碍相关且不包含血管内皮损伤的靶点有2 289个。血管内皮损伤相关且不包含血管内皮功能障碍的靶点有949个。血管内皮功能障碍相关可导致AS且不包含血管内皮损伤的靶点有38个;血管内皮损伤相关可导致AS且不包括血管内皮功能障碍的靶点有47个。见表1。
其中KISS1R、ESAM、KISS1、HDLBP、CAPG、HDL3、MARS、PMPCA、SENP8、FBXW7、MTHFD2已有研究证实在AS血管功能障碍中发挥作用[21-30]。LMCD1、MARCO、ADAMTS7、LPP、OSCAR、MED1、IKBKE已有研究证实在AS血管内皮损伤中发挥作用[31-37]。仅有少量血管内皮功能障碍或血管内皮损伤可致AS的相关靶点被研究报道,其他靶点在AS进程中的作用机制可以作为后期研究方向。同时证明血管内皮功能障碍及血管内皮损伤二者间存在差异性,筛选靶点可作为后期对AS疾病诊断方法和治疗方式。
3 中医药对血管内皮功能障碍及血管内皮损伤的保护及修复作用
AS属于中医学“眩晕”“中风”“胸痹”“脉痹”等疾病范畴,中医理论认为,机体年老虚衰,脏腑功能衰竭,则气血不足,津液运行障碍。气为血之帅,气行则血行。气虚则无力运行血液,痰浊瘀血内生,阻滞经络,使血管稳态和结构破坏,最终导致AS发生[38]。《医林改错》云:“半身不遂,元气亏损,是其本源……元气既虚,必留而瘀。”故治以补气与活血通络并用。气虚为血瘀之本,治疗气虚血瘀证应当大补元气,使全身气血运行通畅[39]。中医药防治AS,脏腑气血亏虚为本,痰瘀阻滞脉络为标,治疗当以补益气血、化瘀祛痰为主。现代中医药研究表明,益气活血法为治疗心脑血管的气虚血瘀证的主要原则。黄芪甲苷具有修复血管作用,黄芪甲苷通过调控miR-21,抑制TLR4蛋白和TNF-α、IL-6、NF-κB等炎症介质的表达,减轻ox-LDL诱导的VECs的炎症损伤,并进行修复[40]。黄芪多糖和白芍总苷配伍,可以通过增强巨噬细胞对ox-LDL的吞噬功能,促进胞内脂质的排出,具有潜在调控体内脂质水平、延缓AS疾病进程的作用[41]。补阳还五汤可能通过抑制SMCs的增殖和迁移,抑制泡沫细胞及AS斑块的形成,具有改善或修复VECs异常的超微结构的作用[42]。补阳还五汤及其有效组分通过抑制金属蛋白酶抑制物-1(TIMP-1)、1型胶原(Col-1)、纤连蛋白(FN)的表达,增强基质金属蛋白酶-9(MMP-9)表达,抑制VSMCs的增殖和迁移[43]。中医药在调控VECs方面进行了大量研究,益气活血单味中药、药对、复方及其有效组分在AS疾病进程中对血管稳态的维持及重构具有显著疗效,特别是VECs功能的调节及结构损伤的修复方面。
4 总结
综上所述,血管内皮功能障碍发生于AS致血管内皮损伤之前,血管内皮功能障碍仅涉及VECs功能性改变,血管内皮损伤涉及VECs的功能性改变、结构性改变等病理改变。血管内皮功能障碍贯穿AS疾病的始终,血管内皮损伤的出现会导致AS的加重。目前的研究,多以血管内皮功能障碍或血管内皮损伤的作用机制及二者与AS疾病发生发展的关系为切入点,针对二者联系与区别的研究尚不完善。建议将二者之间的联系与区别作为未来研究的切入点,可以更加清晰地了解AS疾病的进程,针对性地进行用药,缩短疗程的同时获得更佳的治疗效果。
参考文献
[1]Ross R.The pathogenesis of atherosclerosis:a perspective for the 1990s[J].Nature,1993,362(6423):801-809.
[2]周少春.血管内皮功能障碍的早期检测及对策[J].岭南心血管病杂志,1998,4(1):62-64.
[3]潘亮,邱春光.血管内皮功能障碍在冠心病发生发展中的作用[J].中国分子心脏病学杂志,2014,14(5):1106-1108.
[4]Hong FF,Liang XY,Liu W,et al.Roles of eNOS in atherosclerosis treatment[J].Inflamm Res,2019,68(6):429-441.
[5]Scalia R,Stalker TJ.Microcirculation as a target for the anti-inflammatory properties of statins[J].Microcirculation,2002,9(6):431-442.
[6]Xu L,ang S,Li B,et al.A protective role of ciglitazone in ox-LDL-induced rat microvascular endothelial cells via modulating PPARγ-dependent AMPK/eNOS pathway[J].J Cell Mol Med,2015,19(1):92-102.
[7]Konukoglu D,Uzun H.Endothelial dysfunction and hypertension[J].Adv Exp Med Biol,2017,956:511-540.
[8]趙恒懿,李运伦.血管内皮损伤的机制探讨[J].中国医学创新,2014,11(9):137-139.
[9]李丹,李玉洁,杨庆,等.血管内皮功能障碍与动脉粥样硬化研究进展[J].中国实验方剂学杂志,2012,18(8):272-276.
[10]邱雅慧.血管内皮细胞的功能以及损伤修复与动脉粥样硬化[J].中国组织工程研究与临床康复,2007,11(10):1927-1929.
[11]Sheffels E,Sealover NE,Theard PL,et al.Anchorage-independent growth conditions reveal a differential SOS2 dependence for transformation and survival in RAS-mutant cancer cells[J].Small GTPases,2021,12(1):67-78.
[12]Hoang HM,Umutesi HG,Heo J.Allosteric autoactivation of SOS and its kinetic mechanism[J].Small GTPases,2021,12(1):44-59.
[13]Yuan X,Rosenberg JT,Liu Y,et al.Aggregation of human mesenchymal stem cells enhances survival and efficacy in stroke treatment[J].Cytotherapy,2019,21(10):1033-1048.
[14]Saini V,Bhatnagar MK,Bhattacharjee J.Endothelial nitric oxide synthase Glu298Asp(G894T)gene polymorphism in coronary artery disease patients with type 2 diabetes mellitus[J].Diabetes Metab Syndr,2012,6(2):106-109.
[15]Volpe M,Cosentino F.Abnormalities of endothelial function in the pathogenesis of stroke:the importance of endothelin[J].J Cardiovasc Pharmacol,2000,35(4 Suppl 2):S45-48.
[16]王勇,王思軒,李春,等.氧化应激损伤反应在冠心病心肌缺血血瘀证中的实验研究[J].中国中医基础医学杂志,2011,17(1):58-60.
[17]李苗,王丽丽,常冰梅.血管内皮细胞功能损伤机制的研究进展[J].中国动脉硬化杂志,2019,27(8):730-736.
[18]Münzel T,Daiber A,Ullrich V,et al.Vascular consequences of endothelial nitric oxide synthase uncoupling for the activity and expression of the soluble guanylyl cyclase and the cGMP-dependent protein kinase[J].Arterioscler Thromb Vasc Biol,2005,25(8):1551-1557.
[19]Antohe F.Endothelial cells and macrophages,partners in atherosclerotic plaque progression[J].Arch Physiol Biochem,2006,112(4-5):245-253.
[20]张昭华,庞敏.动脉粥样硬化的发病机制综述[J].基层医学论坛,2018,22(34):4918-4919.
[21]Mead EJ,Maguire JJ,Kuc RE,et al.Kisspeptins are novel potent vasoconstrictors in humans,with a discrete localization of their receptor,G protein-coupled receptor 54,to atherosclerosis-prone vessels[J].Endocrinology,2007,148(1):140-147.
[22]Inoue M,Ishida T,Yasuda T,et al.Endothelial cell-selective adhesion molecule modulates atherosclerosis through plaque angiogenesis and monocyte-endothelial interaction[J].Microvasc Res,2010,80(2):179-187.
[23]Dursun M,Besiroglu H,Otunctemur A,et al.Association between cardiometabolic index and erectile dysfunction:A new index for predicting cardiovascular disease[J].Kaohsiung J Med Sci,2016,32(12):620-623.
[24]Pellieux C,Desgeorges A,Pigeon CH,et al.Cap G,a gelsolin family protein modulating protective effects of unidirectional shear stress[J].J Biol Chem,2003,278(31):29136-29144.
[25]Valente AJ,Irimpen AM,Siebenlist U,et al.OxLDL induces endothelial dysfunction and death via TRAF3IP2:inhibition by HDL3 and AMPK activators[J].Free Radic Biol Med,2014,70(5):117-128.
[26]Stepanova GP,Buǐlov SP,Eshchenko AI,et al.Effects of the 520-day isolation on the functional state of the cardiovascular system[J].Aviakosm Ekolog Med,2014,48(4):23-27.
[27]Ewart MA,Kennedy S,Macmillan D,et al.Altered vascular smooth muscle function in the ApoE knockout mouse during the progression of atherosclerosis[J].Atherosclerosis,2014,234(1):154-161.
[28]Pandey D,Hori D,Kim JH,et al.NEDDylation promotes endothelial dysfunction:a role for HDAC2[J].J Mol Cell Cardiol,2015,81(11):18-22.
[29]Zheng B,Zheng CY,Zhang Y,et al.Regulatory crosstalk between KLF5,miR-29a and Fbw7/CDC4 cooperatively promotes atherosclerotic development[J].Biochim Biophys Acta Mol Basis Dis,2018,1864(2):374-386.
[30]Hitzel J,Lee E,Zhang Y,et al.Oxidized phospholipids regulate amino acid metabolism through MTHFD2 to facilitate nucleotide release in endothelial cells[J].Nat Commun,2018,9(1):2292-2309.
[31]Govatati S,Pichavaram P,Janjanam J,et al.NFATc1-E2F1-LMCD1-Mediated IL-33 Expression by Thrombin Is Required for Injury-Induced Neointima Formation[J].Arterioscler Thromb Vasc Biol,2019,39(6):1212-1226.
[32]Di Marco GS,Hausberg M,Hillebrand U,et al.Increased inorganic phosphate induces human endothelial cell apoptosis in vitro[J].Am J Physiol Renal Physiol,2008,294(6):F1381-F1387.
[33]Kessler T,Zhang L,Liu Z,et al.ADAMTS-7 inhibits re-endothelialization of injured arteries and promotes vascular remodeling through cleavage of thrombospondin-1[J].Circulation,2015,131(13):1191-1201.
[34]Jin L,Hastings NE,Blackman BR,et al.Mechanical properties of the extracellular matrix alter expression of smooth muscle protein LPP and its partner palladin;relationship to early atherosclerosis and vascular injury[J].J Muscle Res Cell Motil,2009,30(2):41-55.
[35]Caicedo D,Díaz O,Devesa P,et al.Growth Hormone(GH)and Cardiovascular System[J].Int J Mol Sci,2018,19(1):290-330.
[36]von Scheidt W.Cardiac allograft vasculopathy--problem and model[J].Z Kardiol,2000,89(9):92-95.
[37]Tsai SH,Liang YC,Lin-Shiau SY,et al.Suppression of TNFalpha-mediated NFkappaB activity by myricetin and other flavonoids through downregulating the activity of IKK in ECV304 cells[J].J Cell Biochem,1999,74(4):606-615.
[38]張伟,邓常清.从气血理论探讨病理性血管重构的研究思路[J].中华中医药杂志,2019,34(10):4713-4717.
[39]张伟,晓丹,李亮,等.益气活血法和行气活血法修复受损血管内皮的实验研究[J].时珍国医国药,2014,25(11):2792-2793.
[40]常方圆,泽瑞,迎春,等.miR-21在黄芪甲苷保护ox-LDL诱导的内皮细胞炎症损伤过程中的作用[J].分子诊断与治疗杂志,2019,11(4):276-282,309.
[41]魏毅,张贵平.芪多糖与白芍总苷对THP-1巨噬细胞源性泡沫细胞内脂质的影响[J].中药新药与临床药理,2007,8(3):189-191.
[42]张红珍,郭春兰,焦瑞,等.补阳还五汤对动脉粥样硬化大鼠主动脉超微结构的影响[J].国临床药理学杂志,2018,34(5):555-557,561.
[43]张伟,吴露,陈北阳,等.补阳还五汤及有效组分对大鼠增生血管内膜细胞外基质蛋白表达的影响[J].中国病理生理杂志,2010,26(1):169-173.
(2020-04-24收稿 责任编辑:芮莉莉)

