小蓬草乙醇提取物对葡聚糖硫酸钠诱导的溃疡性结肠炎小鼠的抗炎作用
吕芳芳,高阳阳,陈锦丽,朱晓琳,宋家乐,3,
(1.桂林医学院公共卫生学院,广西桂林 541100;2.广西医科大学公共卫生学院,广西南宁 530021;3.桂林医学院第二附属医院临床营养科,广西桂林 541100)
炎症性肠病(inflammatory bowel disease,IBD)是一种免疫机制失衡的慢性胃肠道疾病。临床上主要将IBD划分为溃疡性结肠炎(ulcerative colitis,UC)和克罗恩氏病(Crohn’s disease, CD)两类。IBD患者由于肠粘膜中存在反复的慢性炎症造成肠上皮系统功能的障碍,引发胃肠道粘膜组织损伤,从而导致腹痛、腹泻及便血等症状,严重影响患者的生活质量[1−2]。据流行病学调查,IBD在中国的发病率急速增加[3]。然而,IBD确切的发病机制至今尚未明确,但遗传和环境等因素是公认的IBD主要致病因素,且与肠道免疫调节紊乱密切相关[4]。同时,又因慢性IBD与结直肠癌的发生高度相关,进而成为了研究的热点问题之一[5]。IBD的传统疗法有抗炎药物、类固醇、免疫调节剂、单克隆抗体和抗生素疗法。但这类疗法大多数起到暂时的效果,且还存在着严重的并发症和不良药物反应[6]。目前,一些传统中草药由于其较好的抗炎效果而引发研究者的关注[7]。
小蓬草(Conyza canadensisL.)又名小飞蓬或加拿大蓬,属于一年生菊科属草本植物,原产北美而今在全球都有发现[8]。近年来,植物多酚黄酮类物质因具有较好的生物活性和安全性而被重视[9],而小蓬草中主要富含黄酮类、生物碱类及挥发油类等植物化学成分,其生物活性和药用价值研究已有相关的报道[10]。在中国,小蓬草虽被视为一种分布较广的外来入侵植物[11],但研究报道表明,小蓬草具有抗血小板凝集作用,能通过抑制血小板过度活跃改善动脉粥样硬化等心血管疾病[12−13]。同时,小蓬草也具有抗炎[14]、抗菌[15]、抗氧化活性[12,16]和抑制儿茶酚胺分泌的作用[17]。然而,小蓬草对于UC的抗炎作用的相关研究鲜有报道。因此,本研究拟通过利用DSS诱导制备UC小鼠模型,通过观察小蓬草乙醇提取物对UC小鼠的临床症状的改善作用,对小鼠结肠组织中抗氧化酶的活性的影响以及对炎性细胞因子和炎性介质的表达的影响,进一步探讨小蓬草乙醇提取物对结肠炎的抗炎作用及机制。
1 材料与方法
1.1 材料与仪器
新鲜小蓬草 广西桂林市建干路药材市场,并经桂林医学院药学院生药学教研室鉴定(室温阴干后备用);葡聚糖硫酸钠(DSS,分子量:36000~50000 kDa) MP Biomedical公 司(Solon, OH,USA);TNF-α、IL-1β和IL-6 ELISA试剂盒(R&D system,Minneapolis,MN,USA)、Trizol试 剂、OligodT18引物、鼠maloney白血病病毒(MMLV)逆转录酶、辣根过氧化物酶、RNase抑制剂、溴化乙锭(EtBr)和琼脂糖 Invitrogen Life Technologies(Carlsbad,CA,USA);总超氧化物歧化酶(SOD)活性检测试剂盒 上海碧云天生物技术有限公司;其他所有试剂 均为国产分析级;实验动物 雄性C57BL/6J小鼠,6周龄,体重16~18 g,共32只,由桂林医学院实验动物中心提供,所有小鼠置于桂林医学院公共卫生学院普通饲养房,室温条件,标准光照/黑暗(12 h/12 h)循环环境饲养小鼠,随意取用食物和水。
Leica DM4B光学显微镜,适配Leica DFC550 CCD相机 美国Leica Microsystems Inc;Büchi-RE111旋转蒸发器 瑞士Büchi Labortechnik;UV-2401PC分光光度计 日本Shimadzu;Applied Biosystems 2720热循环仪 美国Thermo Fisher Scientific。
1.2 实验方法
1.2.1 小蓬草乙醇提取物(CME)的制备 新鲜小蓬草样本经冷冻干燥(−80 ℃)后,研磨成细粉,加入乙醇(80%)充分搅拌,过夜,反复回流三次,合并回流液,4号滤纸(Whatman International Ltd.,Maidstone,UK)过滤。滤液置于旋转蒸发器中于50 ℃真空浓缩,制备得到CME,储存于−20 ℃环境中待用。
1.2.2 动物实验 所有小鼠随机分为正常组、模型组、低剂量与高剂量CME组共4组,每组8只。整个实验周期内正常组小鼠自由饮水,其余三组小鼠均予2%DSS溶液自由饮用诱导结肠炎7 d。模型组,低剂量与高剂量CME组于第1~7 d分别予0.9%生理 盐 水,50 mg·kg−1CME和200 mg·kg−1CME灌胃。本研究所使用研究方案已由桂林医学院动物伦理委员会审批通过(审查编号:GLMC201604002)。
1.2.3 动物疾病活动指数(DAI)评估 每日监测所有小鼠体重、粪便稠度和粪便隐血。评分标准如下[18]:体重减失评分,体重未减轻:0分; 减轻1%~5%:1分;减轻5%~10%:2分;减轻10%~20%:3分;减轻20%以上:4分。粪便稠度评分,正常:0分;稀便:2分;水样腹泻:4分。粪便隐血程度评分,隐血阴性:0分;隐血阳性:2分;隐血强阳性:4分。DAI分数的范围为0~12分。
1.2.4 结肠病理组织学观察 实验周期结束后,用CO2窒息处死所有实验小鼠(处死前禁食12 h),取整段结肠组织,经生理盐水清洗,吸水纸吸干表面液体,测量结肠长度并称重记录。取部分结肠组织用10%的甲醛溶液固定,其余结肠组织置于−80 °C冰箱储存待用。前者在乙醇中脱水并包埋在石蜡中,石蜡切片(4 μm)进行HE染色,使用Leica DM4B显微镜观察组织标本并记录图像。
1.2.5 髓过氧化物酶(MPO)活性测定 取结肠组织50 mg置于预冷的含有0.5%十六烷基三甲基溴化铵(hexadecyl trimethyl ammonium bromide,HTAB)的磷酸盐缓冲盐水(PBS,80 mmol·L−1,pH5.4)中均质化,离心(4 ℃,12000×g,20 min)后取上清,加入150 μL的3, 3', 5, 5'-四甲基联苯胺(2 mmol·L−1),50 μL的H2O2(300 mmol·L−1)和250 μL PBS(pH5.4,80 mmol·L−1)后混匀并置于25 ℃温育30 min后立即测定混合物在450 nm下的吸光度(A1)。约5 min后加入2.5 mL 的H2SO4(200 mmol·L−1)终止反应,使用UV-2401 PC分光光度计测量所得混合物在450 nm下的吸光度(A2)。依据公式:MPO活性单位=(A1−A2)/5,计算MPO活性单位,并以组织内总蛋白量做校正[19]。
1.2.6 脂质过氧化水平(MDA)测定 取结肠组织100 mg置于冷却的PBS中匀浆。二辛可宁酸(bicinchoninic acid,BCA)测定法测定总蛋白质。匀浆液与1 mL硫代巴比妥酸(thiobarbituric acid,TBA)(0.67%,mg·L−1)和1 mL三氯乙酸(trichloroacetic acid,TCA)(25%, mg·L−1)混合,加热(45 min,95 ℃),离心(4 ℃,10715 r·min−1,20 min),取上清液。使用UV-2401 PC分光光度计测量复合物在535 nm下的光密度值后计算MDA水平[20]。
1.2.7 谷胱甘肽水平(GSH)测定 取结肠组织100 mg置于冷却的PBS中匀浆。取0.5 mL匀浆与0.5 mL 10%的TCA充分混合,离心(5000×g,5 min),取0.1 mL上清液与1.7 mL磷酸钾缓冲液(0.1 mol·L−1,pH8.0)和0.1 mL Ellman's试剂混合,反应5 min,使用UV-2401 PC分光光度计测量混合物在412 nm处的光密度后计算GSH水平[21]。
1.2.8 超氧化物歧化酶(SOD)活性测定 取结肠组织100 mg置于冷PBS(5 mL,0.1 mol·L−1,pH7.4)中均质化,离心(4 ℃,5000×g,10 min)后,按总SOD活性检测试剂盒说明书要求,取适量上清液与试剂盒内反应试剂混合。37 ℃孵育30 min后,使用UV-2401 PC分光光度计测量混合物在560 nm下的吸光度后根据说明书要求进行SOD活性的计算。
1.2.9 结肠组织中TNF-α、IL-1β和IL-6水平的测定 取结肠组织置于3 mL PBS(0.1 mol·L−1,pH7.4)在4 ℃环境下均化,离心(4 ℃,10000×g,5 min)。根据ELISA试剂盒说明书,分别测定结肠组织中TNF-α、IL-1β和IL-6水平。
1.2.10 结肠组织中TNF-α、IL-1β、IL-6、iNOS和COX-2的mRNA表达 用Trizol试剂分离得到总RNA,加入氯仿,离心(25 ℃,13000×g,15 min)。取上清液,以1:1的比例将异丙醇与上清液充分混合,离心(13000×g,15 min)沉淀RNA。弃上清液,加入乙醇洗涤沉淀后,加入经焦碳酸二乙酯(diethy pyrocarbonate,DEPC)处理的无RNase的水充分溶解RNA,使用UV-2401 PC分光光度计测量在260 nm下的吸光度,定量。制备1×逆转录酶缓冲液,dNTPs(1 mmol·L−1),OligodT18引物(500 ng),MMLV逆转录酶(140 U)和RNA酶抑制剂混合物(40 U),取1 μg RNA加入等量混合物中进行逆转录,放入自动热循环仪进行PCR,25~30个循环(94 ℃30 s,55 ℃ 30 s和72 ℃ 40 s)后,72 ℃下延伸8 min。PCR产物以2%琼脂糖凝胶电泳分离,EtBr染色,β-肌动蛋白(β-actin)为内参。
1.3 数据处理
数据以平均值±标准差表示。使用Duncan's的多重范围测试,通过单因素方差分析评估各组之间平均值的差异,P<0.05表示统计学上有显著差异。SAS v9.1统计软件包(SAS Institute Inc.,USA)用于分析实验中获得的数据。
2 结果与分析
2.1 CME对结肠炎小鼠症状的影响
DSS溶液诱导结肠炎模型是目前应用最为广泛的实验方法之一,模型的临床症状、病理学表现和病变部位与人类UC最为相似,即出现典型的体重减轻,结肠短缩和肠壁增厚,并出现腹泻和血便等特点[22−23]。与正常组小鼠相比,模型组能够显著引起结肠炎小鼠的体重减轻、结肠缩短(5.7 cm)、结肠重量/长度比以及总DAI指数显著升高(P<0.05)(表1)。表明自由饮用DSS溶液能引起小鼠出现相应的UC临床症状。经CME剂量组干预后,剂量组小鼠的各项指标较模型组小鼠均具有显著差异性,并呈现出剂量效应关系(P<0.05)(表1)。相较于模型组,CME剂量组小鼠体重呈现上升趋势;小鼠结肠缩短现象得到有效抑制,低剂量组和高剂量组结肠长度分别恢复至7.5、8.6 cm(P<0.05);小鼠的结肠重量/长度比以及总DAI指数呈现显著的下降趋势(P<0.05)。表明CME能有效改善结肠炎小鼠体重减轻、结肠缩短和肠壁增厚的现象,缓解结肠炎小鼠的症状。
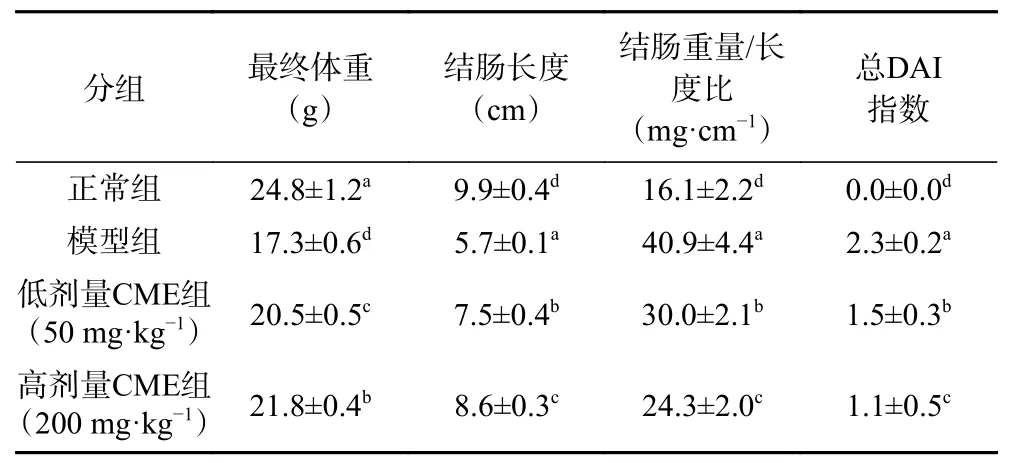
表1 CME对结肠炎小鼠最终体重、结肠长度、结肠重量长度比和总DAI指数的影响Table 1 Effects of CME on the final body weight, colon length,ratio of colon weight to lengthand total DAI index of colitis mice
2.2 CME对结肠炎小鼠结肠组织学变化和结肠组织中MPO酶活性的影响
大量炎症细胞(如中性粒细胞和巨噬细胞)浸润结肠组织,能够诱导粘膜破裂和溃疡,最终引起结肠炎性腹泻和出血[24]。如图1A所示,正常组小鼠结肠组织切片中上皮完整,隐窝腺、基质和粘膜下层结构未受破坏。相反,模型组小鼠的组织切片显示明显扭曲的隐窝上皮、广泛的粘膜损伤和大量炎症细胞浸润(图1B)。经CME剂量组处理能够减轻DSS所致结肠上皮损伤,抑制炎性细胞浸润,维持肠上皮和隐窝腺的完整(图1C和D)。MPO是主要存在于嗜中性粒细胞的溶酶体蛋白,其活性是作为中性粒细胞浸润组织和急性炎症的重要生物标志物之一[25]。模型组小鼠结肠中MPO酶活性较正常组小鼠显著升高(P<0.05)。而高剂量CME组处理则显著抑制了结肠炎小鼠的结肠组织中的MPO蓄积(图1E)(P<0.05)。结肠组织中MPO酶活性的降低代表着的中性粒细胞积聚得到抑制[26]。

图1 CME对结肠炎小鼠结肠组织学改变(A~D;HE,×100)及结肠中MPO(E)的影响Fig.1 Effects of CME on colonic histological changes (A~D;HE,×100) and MPO (E) in colon of colitis mice
2.3 CME对结肠炎小鼠结肠组织中MDA、GSH和SOD水平的影响
中性粒细胞和巨噬细胞等免疫细胞浸润结肠组织是结肠炎的典型特征,局部炎症反应能刺激活性氧(ROS)和活性氮(RNS)的产生,引起生物膜上不饱和脂肪酸发生脂质过氧化反应,从而导致组织氧化应激损伤的发生[27−28]。丙二醛(MDA)是脂质过氧化终产物,是反映机体氧化应激的重要指标之一。此外,肠道抗氧化防御系统失衡与UC的发病机制有关,过量的ROS/RNS显著破坏氧化剂/抗氧化剂平衡,如降低结肠组织中非酶性抗氧化物GSH含量和内源性抗氧化酶SOD活性,减弱了对自由基的清除能力,加速结肠组织的炎症反应和损伤[28−29]。
如表2所示,模型组小鼠结肠组织中的MDA水平较正常组小鼠显著升高(P<0.05)。经CME剂量组处理后,低剂量组和高剂量组小鼠结肠组织中MDA水平较模型组分别降低19.5%和36.3%(P<0.05)。与正常组小鼠相比,模型组小鼠结肠组织中的GSH和SOD水平显著降低(P<0.05),这一结果与刘志龙等[30]的研究结果相似。而经CME剂量组处理后,结肠组织中GSH和SOD水平显著升高(P<0.05),低剂量组和高剂量组GSH水平分别是模型组的1.8倍和2.3倍;SOD水平分别是模型组的1.4倍和1.7倍。结果提示小蓬草是一种良好的自由基清除剂,具有较好的抗氧化活性[12,16]。

表2 CME对结肠炎小鼠的结肠组织中MDA、GSH和SOD水平的影响Table 2 Effects of CME on the levels of MDA, GSH and SOD in colon tissue of colitis mice
2.4 CME对结肠炎小鼠结肠组织中TNF-α、IL-1β和IL-6水平的影响
TNF-α、IL-1β、IL-6和IL-8等促炎细胞因子分泌水平异常升高是导致结肠组织炎性损伤的主要原因之一[31]。如表3所示,较正常组小鼠相比,模型组小鼠的结肠组织中TNF-α、IL-1β和IL-6分泌水平显著提高(P<0.05)。高剂量CME组干预处理后,能显著抑制结肠炎小鼠结肠组织中TNF-α、IL-1β和IL-6的异常分泌(P<0.05)。低剂量组和高剂量组能使TNF-α水平分别较模型组降低7.0%和19.7%;IL-1β水平分别降低20.4%和32.5%;IL-6水平分别降低10.1%和24.3%。表明CME能够抑制促炎因子的释放,减轻结肠炎的炎性反应。

表3 CME对结肠炎小鼠结肠组织中TNF-α、IL-1β和IL-6水平的影响Table 3 Effects of CME on the levels of TNF-α, IL-1β and IL-6 in colon tissue of colitis mice
2.5 CME对结肠炎小鼠结肠组织中TNF-α、IL-1β和IL-6的mRNA表达的影响
结肠黏膜组织中炎性细胞因子异常表达在IBD的病理过程中起着重要作用。单核-巨噬细胞分泌的TNF-α是炎症级联反应中主要的促炎因子之一,能通过募集并激活中性粒细胞,释放炎性因子,导致UC患者结肠粘膜炎性损伤[31−32]。IL-1β和IL-6也是UC炎症进展的关键因子,抑制IL-1β不仅能减轻结肠炎症状,且还能抑制IL-6的过度表达[33]。如图2所示,与正常组相比,DSS处理能引起小鼠结肠组织中的TNF-α,IL-1β和IL-6的mRNA表达显著增强(P<0.05)。经低剂量和高剂量的CME干预后能显著降低结肠炎小鼠结肠组织中的TNF-α、IL-1β和IL-6的mRNA表达(P<0.05)。而抑制结肠组织中炎性细胞因子的过度表达对IBD防治具有重大意义[34]。

图2 CME对结肠炎小鼠结肠组织中TNF-α、IL-1β和IL-6的mRNA表达的影响Fig.2 Effects of CME on the mRNA expression of TNF-α,IL-1β and IL-6 in colon tissue of colitis mice
2.6 CME对结肠炎小鼠结肠组织中iNOS和COX-2 mRNA表达水平的影响
iNOS和COX-2是炎症信号通路中的经典酶,其过度表达与UC的发生发展密切相关[35]。肠粘膜中iNOS和COX-2的异常活化能分别促进炎性介质NO和PGE2的释放,加剧UC症状[36]。如图3所示,模型组小鼠结肠组织中的iNOS和COX-2的mRNA表达水平较正常组显著上升(P<0.05)。而高剂量CME组干预后,结肠炎小鼠结肠组织中iNOS和COX-2的mRNA表达水平显著低于模型组(P<0.05)。抑制iNOS和COX-2的过度表达能有效减轻肠黏膜中炎症水平,控制IBD的发展[37]。表明CME对结肠炎可能具有较好的抗炎作用。

图3 CME对结肠炎小鼠结肠组织中iNOS和COX-2的mRNA表达的影响Fig.3 Effects of CME on the mRNA expression of iNOS and COX-2 in colon tissue of colitis mice
3 结论
本研究利用DSS诱导构建UC小鼠模型来研究CME对结肠炎小鼠的抗炎作用效果。实验结果提示,CME能有效改善结肠炎小鼠体重减轻、结肠缩短和肠壁增厚的现象,缓解结肠炎小鼠的症状。通过提高结肠组织中抗氧化物质GSH和SOD的活性,进一步减轻结肠粘膜中的氧化应激损伤。同时,CME还能明显抑制结肠组织中MPO酶活性以及抑制结肠组织中炎性细胞因子(TNF-α、IL-1β和IL-6)的异常分泌和炎性介质(TNF-α、IL-1β、IL-6、iNOS和COX-2)的过度表达。综上所述,CME对结肠炎可能具有较好的抗炎作用,能够修复结肠炎的炎症反应,故可进一步为小蓬草的开发利用及结肠炎的临床研究提供支持。

