阿尔茨海默病与microRNA研究进展
朱苗骏
摘 要 阿尔茨海默病是一种以进行性认知损害为特征的神经退行性疾病,被认为是最常见的痴呆病症,其特征是b淀粉样蛋白斑的积累和神经元纤维缠结的形成,但目前还没有可靠的生物标志物或非侵入性技术可用于其早期检测。近年来随着生物标志物和分子生物学技术的快速发展,越来越多的证据表明,包括组织、血液和脑脊液在内的microRNA的特异性表达与脑神经退行性疾病有关,预示着这些microRNA作为阿尔茨海默病诊断标志物的巨大潜力。本文综述了近年来microRNA和阿尔茨海默病的研究进展。
关键词 非编码RNA 小RNA 阿尔茨海默病
中图分类号:R749.16 文献标志码:A 文章编号:1006-1533(2021)13-0043-05
Research advances of Alzheimers disease and microRNA
ZHU Miaojun
(Shanghai Biovue Technology Co., Ltd., Shanghai 200063, China)
ABSTRACT Alzheimers disease is a neurodegenerative disease characterized by progressive cognitive impairment, the commonest cause of dementia. Two major physical hallmarks of the disease are the accumulation of beta amyloid plaques and the formation of neurofibrillary tangles. However, there are no reliable biomarkers or non-invasive techniques yet for its early detection. In recent years, with the development of molecular biology, more and more evidences have showed that the specific microRNAs expressed in tissue, blood and cerebrospinal fluid are related to neurodegenerative diseases. It is indicated that the great potential of these non-coding RNAs may be possibly used as diagnostic markers for Alzheimers disease. This article mainly reviews the research progress of microRNAs and Alzheimers disease in recent years.
KEy WORDS ncRNA; microRNA; Alzheimers disease
RNA不仅承担遗传信息中间载体的角色,而且更多地承担了各种调控功能。在高等生物和人的基因组中非编码区占到基因组序列的大部分,如人类基因组中编码蛋白的序列只占有约3%~5%,其余约95%~97%为非编码区[1]。这些长短不一、结构各异的非编码RNA(ncRNA)在生物体内发挥着各种不同功能。随着高通量测序技术的飞速发展和非编码RNA组学的不断进步,人们也逐渐认识到这些基因在神经退行性疾病中也发挥着重要的生物学功能。神经退行性疾病包括有阿尔茨海默病(Alzheimers disease, AD)、亨廷顿病(Huntingtons disease, HD)、帕金森病(Parkinsons disease, PD)和肌萎缩性侧索硬化症等常见神经系统疾病。AD作为最常见的痴呆病症(dementia disorder)被研究的最多[2]。本文着重探讨微小RNAs(microRNA,miRNA或miR)与AD发病关系及在诊疗中应用的研究进展。
1 AD
AD也被称为阿尔茨海默型老年性痴呆(dementia of Alzhermers disease),是慢性进行性中枢神经系统变性病导致的痴呆,是痴呆最常见的病因和最常见的脑神经退行性疾病,目前AD患者预计全球超过4 700万[3]。临床AD以渐进性记忆障碍、认知功能障碍、人格改变以及语言障碍等神经精神症状为特征,表现为缓慢的、渐进性的、且不可逆的认知和记忆功能丧失。由于神经元和突触的破坏,最终导致痴呆和死亡。AD的病因及发病机制迄今尚不明确,可能为多因素参与复杂的异质性疾病,包括遗传因素、神经递质、免疫因素和环境因素等[4]。研究人员认为主要有两大学说:Aβ类淀粉样蛋白(amyloid beta-protein, Aβ)学说和Tau(tubulin associated unit,Tau)蛋白学說。Aβ的过量积累是由于AD病理导致其蛋白前体(amyloid precursor protein, APP)异常剪切成为对神经元有毒性作用的不溶性Aβ42,这也是构成老年斑的核心成分[5]。而Tau蛋白的过度磷酸化或乙酰化可能是AD病理形成,使神经纤维缠结(neurofibrillary tangles, NFTs)而沉积于脑中导致神经元变性[6],此外还有其他假说,如胆碱能神经元及突触丧失、高胆固醇、2型糖尿病以及外伤造成的脑损伤等均造成罹患AD的可能性。甚至最新的大数据研究显示,AD的形成可能与病毒感染有关[7]。其中大量的研究揭示年龄是AD的重要危害因素[8],按年龄可分为早老性痴呆(小于65岁出现的AD,也被称为early-onset AD)或家族性痴呆(familiar AD, FAD)和老年性痴呆(65岁之后出现的AD,也被称为late-onset AD, LOAD)或者散发性痴呆(sporadic AD, SAD),随着全球性的老龄化,预计至2050年,80岁以上老人将超过3.7亿,按年龄增长AD患病风险系数也增加来计算,至2050估计可能将有超过1.3亿AD患者[9]。
自1906年第1例AD患者被发现并定义以来,还没有真正能在临床症状出现之前及早诊断的AD或实时监测及预后AD的生物标志物。目前,也还没有能治疗或预防进展期AD的药物,药物只能缓解症状。因此,用于AD治疗过程中评价被测药物疗效的生物标志物也亟待开发。
2 AD标志物
目前被用于认知AD的标志物主要就是Aβ蛋白、Tau蛋白和磷酸化的Tau蛋白(P-Tau),在脑脊髓液(cerebrospinal fluid,CSF)和循环血中检测Aβ、Tau和P-Tau浓度的方法已有报道[10-11]。有数据表明CSF中Aβ42蛋白浓度的降低可能和AD患者脑中Aβ42沉积有关联,且发现利用CSF中Aβ42/Aβ40浓度比来判断AD患者脑中Aβ蛋白的沉积情况[12-13]。而CSF中Tau蛋白和P-Tau蛋白的增加反应了神经元的退化,但研究发现仅从CSF中P-Tau蛋白的浓度并不能特异性地诊断出AD[14]。临床也有利用正电子发射断层显像技术(positron emission tomography, PET)、核磁共振成像技术(magnetic resonance imaging, MRI)和生化分析等方法对Aβ蛋白和Tau蛋白进行显像。至目前为止,还没有用于临床AD诊断或预后的生物标志物。
3 AD发病机制和miRNA
随着人类基因组(ENCODE Project)计划的完成及表观遗传学的快速发展,非编码RNA是当今发展最为迅速的生命科学领域之一。其中,miRNAs作为研究最多的非编码RNA成员,自1993年第一个miRNA(Lin-4)被发现十多年来[15],人体中已经发现2 800多个成熟miRNAs(http://www.mirbase.org)。miRNA是一类长度约为19~24个核苷酸的内源性、保守的单链非编码RNA分子,它通过mRNA剪切和抑制蛋白翻译的方式负调控靶基因。90%的miRNAs和Ago2蛋白结合以游离态形式存在,也可以被细胞外囊泡(extracellular vesicles)例如囊泡小体(exosome)运输,而这些miRNA均可通过miRNA芯片、深度测序和实时定量PCR的方法测定。
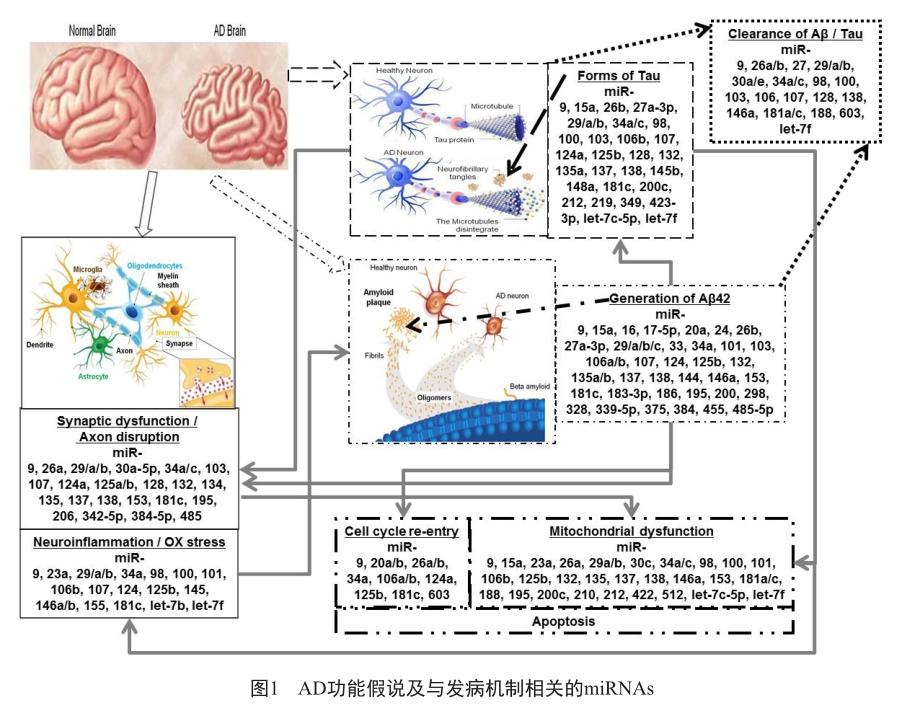
研究表明,在已发现的miRNAs中,脑中表达的miRNAs种类约有70%[16]。近年来,由于miRNA的作用机制比较清晰,在AD组织、细胞系和小鼠模型中越来越多与AD发病机制有关的miRNAs被阐明(如BDNF、Tau蛋白、BACE1和APP蛋白等);也越来越多地发现与其他与脑功能机制相关的miRNA(如Aβ蛋白运输子ABCA1、脂类运输相关的ApoE、突触功能異常等)。笔者总结了与AD发病机制相关的miRNAs,详见图1。
Millan等[17]在2017年就病理生理学角度整合了非编码RNA和AD发病机制的综述。Swarbrick等[18]在2019年综述了miRNA在AD的组织和血液以及脑脊液中的研究状况。Slota等[19]则从神经炎症方面总结了相关联miRNAs。Moradifard等[20]整理文献并统计分析了179个差异表达的miRNAs和1 404个不同表达的基因,指出miR-30a-5p和miR-335是与AD关系最密切的miRNAs。Nagaraj等[21]则在最新的文献分析中指出在AD组织和正常组织中有136个不同的miRNAs差异表达,其中有36个不同的miRNAs被两组以上独立研究团队所报道,miR-125b被研究的最多(共6次);在AD脑脊液中则有166个差异表达的miRNAs,而在比较了脑组织、血液和脑脊液miRNA后,只有3个miRNA(miR-125b、miR-146a和miR-135a)被证明具有表达一致性。
4 临床AD诊断和miRNA生物标志物
miRNA的变化已经被越来越多地应用于疾病的诊断,也包括神经退行性疾病。迄今为止的大量研究发现,miRNA不仅在组织细胞内发挥作用,而且在外周循环血及其他体液(如眼泪、支气管灌洗液、尿液、胸水,腹水和脑脊液等)中也可以稳定存在,并被尝试作为特异性的标志物用于包括AD在内的神经退行性疾病的诊断与分类。
4.1 AD和脑脊液miRNAs
自2008年起由Cogswell等[22]发表第一篇CSF中miRNA作为AD的诊断标志物的报道以来,已有10年的发展历史。由于血脑屏障(blood brain barrier, BBB)的存在使得CSF中的miRNAs更能体现出神经系统(central nervous system, CNS)中miRNAs的特异性,而且有研究已证明CSF miRNAs的表达变化相对血液miRNAs能更稳定且客观地反映AD患者的状态[23]。Cogswell等[22]的研究通过实时定量PCR探针法检测超过了200个在CSF中不同表达的miRNAs,并比较不同期AD患者和健康对照组中发现了60个差异表达的miRNAs。随后,一些相关的文献报道指出CSF中miRNAs作为诊断标志物的
巨大潜力[24-25]。Dangla-Valls等[26]首次发现并利用双盲实验佐证了AD患者在CSF中高表达的miR-222和miR-125b。而McKeever等[27]则在CSF囊泡小体中发现miR-16-5p可能与AD的早期发病有关联。虽然这些工作非常振奋人心,但这些研究样本的数量太少,且还没有区分AD与其他神经退行性疾病的CSF miRNAs的相关报道。由于CSF与脑直接关联,能客观地反映神经系统的生化信号变化,因此,CSF中miRNAs的相关研究是非常有意义的,但CSF需要穿刺获得,具有一定的侵入性,并会造成患者的不适感,故不适合做实时检测。
4.2 AD和血miRNAs
众所周知,血液样品容易获得,且适宜实时监测,作为液体活检的标志性样本,预示着循环血中miRNAs可能成为AD诊疗的重要生物标志物[28]。早在2013年,Leidinger等[29]是第一个利用循环血中miRNA生物标志物来预测AD,他们测定了215例病人和正常外周血样本的miRNA表达情况,发现了140个差异表达的miRNAs,并找到由12个miRNA组成的指纹图谱可以准确(准确度74%~78%)地从正常人或其他神经退行性疾病中区分AD患者。Tan等[30]則在血清中首先通过高通量测序比较了AD患者和对照组中的miRNA表达情况,再利用实时定量PCR的方法在158例AD患者和155例对照中验证了这些miRNA,发现miR-342-3p的灵敏度(81.5%)和特异性(70.1%)是最好的。Li等[31]详述了囊泡小体miRNAs和神经退行性疾病的相互关系,Lugli等[32]则通过illumina高通量测序检测了血浆exosome miRNAs,发现了在AD患者中差异表达的20个miRNAs,并通过生物信息统计分析得到由7个miRNAs组成的指纹图谱可高准确度(83%~89%)地判断出AD,而且有意义的是,该团队也发现miR-342-3p在60%的AD患者中高表达,其可负调控锚蛋白(AnKG蛋白,一种与神经轴突有关联的蛋白),而且与该蛋白和miRNA有关的另一miR-32b则在AD患者中低表达。另一篇文献则报道了血清exosome miRNAs:miR-135a、miR-193b和miR-384可以区分AD、PD和血管性痴呆(vascular dementia)[33]。Takousis等[34]统计了500多篇文献,发现70篇相关研究和1 000多个不同的miRNAs及miR-342-3p是在血液中表达差异最大的miRNA,而在CSF中则是miR-127-3p表达差异最显著。Fransquet等[35]统计了基于血液miRNAs检测AD的文献,包括36篇相关文献和395个miRNAs,统计还发现了6个差异性表达的miRNAs均在AD患者血液中低表达,交叉比对这些研究后发现只有13篇报道进行了受试者工作特征曲线(ROC曲线)分析,其中仅有3篇文献构建了支持向量机(support vector machine,SVM)模型进行预测计算。关于AD和miRNA的研究虽然取得了一些进展,但由于AD发病机制和miRNA功能的复杂性,想要利用循环miRNA作为AD临床诊疗的标志物仍是路漫漫其修远兮。
5 展望
虽然科学家们指出miRNAs作为治疗药物的巨大潜力,特别是在神经细胞丢失之前的临床前阶段进行干预,但目前miRNAs的递送方法(如脂质或病毒载体)仍缺乏足够的特异性、可靠性和稳健性。虽然生物信息统计方法的快速发展,也为我们发现AD发病相关重要基因、miRNA功能以及miRNA-mRNA等分子机制提供了新的思路,但如何系统地利用这些技术及设定标准化,高效地利用生物信息方法进行大数据统计和分析,发现可靠且经过大样本量验证的miRNAs生物标志物用于AD的诊疗,特别是如何开创深化外周血miRNA作为AD生物标志物的热点领域,将会是我们未来面临的巨大挑战。 miRNA将为未来神经退行性疾病中关键发病机制研究以及精确诊断提供新思路,并为探寻精准治疗及预后方面提供新途径。
参考文献
[1] Venter JC, Adams MD, Myers EW, et al. The sequence of the human genome[J]. Science, 2001, 291(5507): 1304-1351.
[2] Calderon-Garciduenas AL, Duyckaerts C. Alzheimer disease[J]. Handb Clin Neurol, 2017, 145: 325-337.
[3] Robinson RA, Amin B, Guest PC. Multiplexing biomarker methods, proteomics and considerations for Alzheimers disease[J]. Adv Exp Med Biol, 2017, 974: 21-48.
[4] Bondi MW, Edmonds EC, Salmon DP. Alzheimers disease: past, present, and future[J]. J Int Neuropsychol Soc, 2017, 23(9/10): 818-831.
[5] Hardy JA, Higgins GA. Alzheimers disease: the amyloid cascade hypothesis[J]. Science, 1992, 256(5054): 184-185.
[6] Iqbal K, Wisniewski HM, Grundke-Iqbal I, et al. Chemical pathology of neurofibrils. Neurofibrillary tangles of Alzheimers presenile-senile dementia[J]. J Histochem Cytochem, 1975, 23(7): 563-569.
[7] Readhead B, Haure-Mirande JV, Funk CC, et al. Multiscale analysis of independent Alzheimers Cohorts finds disruption of molecular, genetic, and clinical networks by human herpesvirus[J]. Neuron, 2018, 99(1): 64-82; e67.
[8] Bennett DA, Wilson RS, Arvanitakis Z, et al. Selected findings from the religious orders study and rush memory and aging project[J]. J Alzheimers Dis, 2013, 33(Suppl 1): S397-S403.
[9] Suh YH, Checler F. Amyloid precursor protein, presenilins, and alpha-synuclein: molecular pathogenesis and pharmacological applications in Alzheimers disease[J]. Pharmacol Rev, 2002, 54(3): 469-525.
[10] Humpel C, Hochstrasser T. Cerebrospinal fluid and blood biomarkers in Alzheimers disease[J]. World J Psychiatry, 2011, 1(1): 8-18.
[11] Rosen C, Zetterberg H. Cerebrospinal fluid biomarkers for pathological processes in Alzheimers disease[J]. Curr Opin Psychiatry, 2013, 26(3): 276-282.
[12] Mizoi M, Yoshida M, Saiki R, et al. Distinction between mild cognitive impairment and Alzheimers disease by CSF amyloid beta40 and beta42, and protein-conjugated acrolein[J]. Clin Chim Acta, 2014, 430: 150-155.
[13] Pannee J, Portelius E, Minthon L, et al. Reference measurement procedure for CSF amyloid beta (Abeta)1-42 and the CSF Abeta1-42 /Abeta1-40 ratio — a cross-validation study against amyloid PET[J]. J Neurochem, 2016, 139(4):651-658.
[14] Hampel H, Buerger K, Zinkowski R, et al. Measurement of phosphorylated tau epitopes in the differential diagnosis of Alzheimer disease: a comparative cerebrospinal fluid study[J]. Arch Gen Psychiatry, 2004, 61(1): 95-102.
[15] Lee RC, Feinbaum RL, Ambros V. The C. Elegans heterochronic gene lin-4 encodes small RNAs with antisense complementarity to lin-14[J]. Cell, 1993, 75(5): 843-854.
[16] Fineberg SK, Kosik KS, Davidson BL. MicroRNAs potentiate neural development[J]. Neuron, 2009, 64(3): 303-309.
[17] Millan MJ. Linking deregulation of non-coding RNA to the core pathophysiology of Alzheimers disease: an integrative review[J]. Prog Neurobiol, 2017, 156: 1-68.
[18] Swarbrick S, Wragg N, Ghosh S, et al. Systematic review of miRNA as biomarkers in Alzheimers disease[J]. Mol Neurobiol, 2019, 56(9): 6156-6167.
[19] Slota JA, Booth SA. MicroRNAs in neuroinflammation: implications in disease pathogenesis, biomarker discovery and therapeutic applications[J]. Noncoding RNA, 2019, 5(2): 35.
[20] Moradifard S, Hoseinbeyki M, Ganji SM, et al. Analysis of microRNA and gene expression profiles in Alzheimers disease: a meta-analysis approach[J]. Sci Rep, 2018, 8(1): 4767.
[21] Nagaraj S, Zoltowska KM, Laskowska-Kaszub K, et al. microRNA diagnostic panel for Alzheimers disease and epigenetic trade-off between neurodegeneration and cancer[J]. Ageing Res Rev, 2019, 49: 125-143.
[22] Cogswell JP, Ward J, Taylor IA, et al. Identification of miRNA changes in Alzheimers disease brain and CSF yields putative biomarkers and insights into disease pathways[J]. J Alzheimers Dis, 2008, 14(1): 27-41.
[23] Burgos K, Malenica I, Metpally R, et al. Profiles of extracellular miRNA in cerebrospinal fluid and serum from patients with Alzheimers and Parkinsons diseases correlate with disease status and features of pathology[J]. PLoS One, 2014, 9(5): e94839.
[24] Lusardi TA, Phillips JI, Wiedrick JT, et al. MicroRNAs in human cerebrospinal fluid as biomarkers for Alzheimers disease[J]. J Alzheimers Dis, 2017, 55(3): 1223-1233.
[25] Muller M, Jakel L, Bruinsma IB, et al. MicroRNA-29a is a candidate biomarker for Alzheimers disease in cell-free cerebrospinal fluid[J]. Mol Neurobiol, 2016, 53(5): 2894-2899.
[26] Dangla-Valls A, Molinuevo JL, Altirriba J, et al. CSF microRNA profiling in Alzheimers disease: a screening and validation study[J]. Mol Neurobiol, 2017, 54(9): 6647-6654.
[27] McKeever PM, Schneider R, Taghdiri F, et al. MicroRNA expression levels are altered in the cerebrospinal fluid of patients with young-onset Alzheimers disease[J]. Mol Neurobiol, 2018, 55(12): 8826-8841.
[28] Zendjabil M. Circulating microRNAs as novel biomarkers of Alzheimers disease[J]. Clin Chim Acta, 2018, 484: 99-104.
[29] Leidinger P, Backes C, Deutscher S, et al. A blood based 12-miRNA signature of Alzheimer disease patients[J]. Genome Biol, 2013, 14(7): R78.
[30] Tan L, Yu JT, Tan MS, et al. Genome-wide serum microRNA expression profiling identifies serum biomarkers for Alzheimers disease[J]. J Alzheimers Dis, 2014, 40(4): 1017-1027.
[31] Li D, Li YP, Li YX, et al. Effect of regulatory network of exosomes and microRNAs on neurodegenerative diseases[J]. Chin Med J (Engl), 2018, 131(18): 2216-2225.
[32] Lugli G, Cohen AM, Bennett DA, et al. Plasma exosomal miRNAs in persons with and without Alzheimer disease: altered expression and prospects for biomarkers[J]. PLoS One, 2015, 10(10): e0139233.
[33] Yang TT, Liu CG, Gao SC, et al. The Serum exosome derived microRNA-135a, -193b, and -384 were potential Alzheimers disease biomarkers[J]. Biomed Environ Sci, 2018, 31(2): 87-96.
[34] Takousis P. Analysis of micro-RNA expression by qPCR on a microfluidics platform for Alzheimers disease biomarker discovery[J]. Methods Mol Biol, 2018, 1750: 283-292.
[35] Fransquet PD, Ryan J. MicroRNA as a potential bloodbased epigenetic biomarker for Alzheimers disease[J]. Clin Biochem, 2018, 58: 5-14.

