降低牛乳致敏性方法的研究进展
王明礼,钱珊珊,李艾黎,姜瞻梅,侯俊财
(1.东北农业大学 食品学院,哈尔滨150030;2.东北农业大学 国资处,哈尔滨150030)
0 引 言
牛乳是日常膳食中常见的食品,被认为是母乳的良好替代品。尽管如此,近些年,牛乳在一些西方国家的消费量有降低的趋势[1]。除饮食习惯外,造成这一现象的主要原因是乳及乳制品在食用后会出现胃肠道不适和呼吸道症状,严重者会休克甚至死亡[2]。牛乳过敏(Cow's milk allergy,CMA)是一种针对乳蛋白的异常免疫反应,由一种或多种乳蛋白与免疫机制的相互作用产生,同时也是婴幼儿时期最常见的食物过敏类型[3-4]。针对牛乳过敏问题,现阶段的研究聚焦在通过蛋白质改性技术和调节机体免疫过程以降低蛋白的致敏性。本文主要介绍牛乳中主要的致敏蛋白及其致敏机理,同时对近些年国内外降低牛乳致敏性方法进行综述,为低致敏型乳制品开发提供理论参考。
1 牛乳过敏的发生
牛乳蛋白过敏的发生一方面是由于牛乳中蛋白组分和含量与母乳中蛋白的差异,另一方面则与机体的消化系统和胃肠黏膜的免疫能力密切相关。表位是引起免疫反应的主要原因,根据与抗体结合的氨基酸形式的不同,可以将其分为构象表位和线性表位[5]。构象表位是指蛋白质的空间结构通过折叠等聚集在一起,而在一级序列中距离较远的氨基酸形成的表位,这种表位的形成主要依赖于蛋白质的空间结构,而线性表位是指抗体能够连续识别的氨基酸序列形成的表位[6]。CMA患者中最常见的3种过敏原:α-酪蛋白(α-casein,α-CN),β-乳球蛋白(β-Lactoglobulin,β-LG)和α-乳白蛋白(α-Lactalbumin,α-LA)[7]都含有能被机体免疫系统识别的构象表位或线性表位而表现出致敏性。牛乳酪蛋白组分中,4种蛋白组分以胶束的形式形成直径在100~300 nm之间的球形有序聚集体[8]。乳酪蛋白由于与母乳中酪蛋白的组分、含量和结构上的差异而存在致敏性,不同哺乳动物酪蛋白之间的氨基酸序列同源性高达90%,因此具有广泛的交叉过敏性[9]。在酪蛋白中,αs1-酪蛋白(αs1-casein,αs1-CN)是牛乳中含量最高的蛋白质,同时也是最具致敏性的蛋白质。β-LG主要以天然二聚体形式或单体的形式存在,由于其对蛋白酶和酸性条件水解的高度稳定性以及在母乳中不存在等原因而具有致敏性[10]。α-LA通过4个二硫键保持结构稳定的单体球状蛋白,从牛到人和啮齿类动物的序列分析发现α-LA氨基酸序列具有高达75%的同源性,也具有较高的交叉过敏性[11]。
通常,可以将CMA分为IgE介导、非IgE介导和两者混合介导3种类型,其中以IgE介导的过敏反应居多[12]。对于IgE介导的免疫反应来说,当人体首次接触牛乳过敏原时,牛乳蛋白被树突状细胞摄取、加工后提呈给初始CD4+淋巴细胞,在过敏原和其他细胞因子刺激下分化成Th1、Th2、Th17和Treg等不同的效应T细胞,而后刺激B细胞合成IgE抗体,IgE抗体通过特定的Fc受体与肥大细胞结合,随后过敏原与受体结合的IgE结合,使机体处于致敏阶段[13]。当机体再次接触致敏乳蛋白时,乳蛋白与肥大细胞表面的IgE结合,使肥大细胞脱粒,释放出组胺等活性物质,引起机体的过敏反应(如图1)。
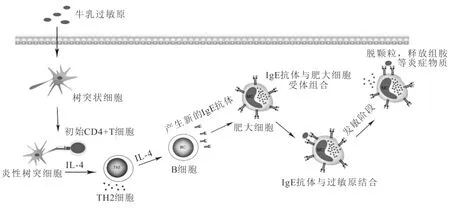
图1 牛乳过敏的反应机理[13]
2 牛乳蛋白改性方法
现阶段,一些应用于乳蛋白的改性方法主要有热处理、加压处理、射线、超声、化学物质修饰、酶的作用、复合改性以及基因改性等。由于酪蛋白中缺少三级结构,致敏表位以线性表位为主,乳清蛋白含有稳定的空间结构,既含有线性表又含有构象表位,因此,通过蛋白质改性技术,能够使乳蛋白的三维结构发生变化,构象表位会随空间结构的展开而丢失,只留下线性表位,线性表位在化学物质或生物成分的作用下被遮蔽或水解,达到降低致敏性的目的。
2.1 物理改性
2.1.1 热处理
热处理是较为常见的食物处理方式,通过热处理可能会对牛乳的致敏性产生影响。一方面,热处理诱导的蛋白结构修饰会引起表位片段化、掩蔽和解掩蔽等变化,使大部分的构象表位被破坏[14];另一方面,乳蛋白会与乳中含有的乳糖等还原糖会在升温过程中加速美拉德反应过程,产生的聚合物由于引入了糖分子,空间位阻和电荷作用修饰蛋白的抗原表位,对致敏性产生影响[15]。然而,对蛋白结构的改变,可能会潜在的促进蛋白的敏感性或暴露和形成新的致敏表位从而增加牛乳的致敏性[16](如图2)。因此针对不同类型的乳蛋白,通过热处理可能会降低、增加和不影响致敏性。牛乳蛋白的致敏性差异不仅取决于加热的温度和时间,还取决于与其他食物基质成分的相互作用,所以热处理可以作为生产低致敏性食品工艺中的一部分。

图2 热处理引起的食物过敏原的构象变化及其对免疫反应的影响
2.1.2 加压改性
高压加工是一种新型的非热加工技术,较高的压力能通过影响蛋白分子中的氢键、离子键和疏水键等相互作用去改变蛋白的高级结构,以调节其致敏性[17-18]。通过压力处理能有效影响乳蛋白的致敏性,Bogahawaththa等[19]研究了脱脂牛乳在不同压力处理后的变化,发现高压通过硫醇/二硫键交互作用诱导形成蛋白聚集体,使蛋白质二级结构变化导致蛋白质变性,使蛋白质的免疫原性减弱。动态高压微流化技术是一种涉及到强剪切力、高颠簸、迅速释放压力和气穴作用等综合作用的新型高压技术[18],现有的研究表明使用低于80 MPa的动态高压处理会导致β-LG抗原性增加,而高于80 MPa的处理则会导致致敏性明显降低[20]。
尽管许多研究都集中在压力对牛乳的影响,但目前为止,加压处理的牛乳产品尚未商业化生产,其中限制因素之一就是成本。此外,加压处理还会影响牛乳的颜色,通过影响酪蛋白胶束的结构导致胶束发生不可逆变化,较小的胶束变得不透明,使牛乳的颜色从白色变成淡黄色[21],这无疑也影响了消费者的购买欲望。
2.1.3 射线辐照改性
辐照技术是通过60Co-γ射线或电子束处理食物的方法,在辐照处理下,一方面牛乳溶液中的致敏蛋白会直接吸收辐照能,另一方面,辐照作用于食物中的水分子,产生能与致敏蛋白的氨基发生反应的·H和·OH等自由基,使牛乳溶液中共价键被破坏,引起蛋白质二级和三级构象的变化,减弱牛乳过敏原激发Th2型过敏反应的能力[22-23]。
α-LA和β-LG对γ射线的敏感性高于其他蛋白质,同时辐照对蛋白结构和免疫反应性的影响还取决于使用的剂量。Yang等[24]发现使用5k Gy辐照处理后,β-LG的聚集性增加,表面疏水性降低,β-LG诱导的Ca2+内流被抑制,减缓了IgE介导的过敏反应。先前的研究中表明使用剂量3 k Gy和10 k Gy辐照处理时,β-LG由于聚集体的形成降低了IgE结合能力,尽管更高剂量的处理也能破坏抗原表位,但也会导致牛乳风味变差和营养品质的下降[25]。尽管有了一些成果,但辐照处理技术还仍处于发展初级阶段,其产物安全性研究也未开展研究。
2.1.4 超声波处理
超声处理在食物干燥、灭菌、过滤和肉嫩化等方面具有广泛的应用,但在减少食物过敏原方面是一种新兴技术。在乳制品系统中,高功率超声通过液体介质时会产生空化效应,液体中溶解气泡在超声的影响下振荡,随着时间的推移两个或多个气泡可以通过合并而结合,当达到一定尺寸时会导致塌缩[26],能量的释放会增加介质中的温度和压力,这些作用诱导了蛋白天然结构的多种变化,例如:二级结构变化、分子内或分子间相互作用的产生和二硫键的重组等变化[27],对牛乳的致敏性产生影响(如图3)。与其他改性方式不同,日常食品加工中很少直接使用超声波处理降低食物的致敏性,而是选择与其他技术联合使用或将超声作为预处理过程,一些超声波联用技术如表1所示。

图3 超声波空化效应及应用

表1 超声波复合改性技术
2.2 化学改性
2.2.1 糖基化
糖基化反应在牛乳中通常以美拉德反应的形式发生,通过美拉德反应能改变蛋白质的分子结构,引入的糖分子会对致敏表位进行修饰,得到致敏性较低的乳糖-β-乳球蛋白,牛乳中自身存在的乳糖与β-LG的反应可以增强其免疫原性。
除乳糖外,还可以利用一些低聚糖与乳蛋白的反应改善牛乳的致敏性[34]。Zhang等[35]对比了葡萄糖、麦芽糖和麦芽低聚糖与α-LA反应后的抗原性变化,发现糖基化反应可以显著改变α-LA的结构,所有糖基化样品的抗原性均随反应时间而显著降低。杨铮[36]探究了糖基化对β-LG与αs1-CN免疫原性的影响,发现采用低聚半乳糖与低聚壳聚糖均能有效降低β-LG与αs1-CN的抗原性。使用糖基化方法能够有效的降低牛乳的致敏性,同时还克服了使用酶水解方式产生的苦味,推动了乳及乳制品的发展。但该处理能否获得有效成果还取决于反应条件、反应程度以及糖类的数量和分子量,还有可能带来不需要的颜色变化和风味化合物以及大量的蛋白质变性和聚集等不良后果。
2.2.2 其他化学修饰
除了利用糖基化反应外,还可以通过乙酰化、琥珀酰化、磷酸化和甲基化等(如表2)对蛋白质进行化学修饰,以改善牛乳品质。

表2 乙酰化、琥珀酰化和磷酸化处理对乳蛋白的影响
2.3 生物法改性
2.3.1 酶法水解
利用酶法改性最常见的方式就是使用各种蛋白水解酶进行酶水解,通过酶水解,蛋白构象表位迅速崩溃,线性表位被裂解,因此为了降低致敏性,可以选择将牛乳蛋白水解为不会引起过敏的小肽和游离氨基酸,同时还能增加牛乳的吸收率[44]。由于直接对生牛乳进行水解比较困难,所以一般在水解前进行加热、加压等预处理,通过这些预处理过程能将蛋白的构象展开使酶水解过程更加彻底[45]。由于不同乳蛋白的致敏原表位不同,所以选择恰当的酶仍然是酶法改性的关键,目前一些用于工业化生产的酶及作用位点如表3所示。

表3 一些工业生产酶及作用效果
2.3.2 发酵改性
乳酸菌(Lactic acid bacteria,LAB)是牛奶微生物的组成部分,一些LAB菌株产生的蛋白酶能够水解负责CMA蛋白质的致敏表位并降低免疫球蛋白的识别能力从而降低其致敏潜力。例如,Kordesedehi等[51]对从骆驼生乳样品中分离的粪肠球菌进行试验,发现其能够水解αs1-CN中主要过敏原表位在内的许多位点,有效的降低了αs1-CN的致敏性。除LAB外,其他微生物、动物或植物的蛋白酶也能用于水解乳蛋白并降低其抗原性,但在水解过程中会产生一些苦味肽,这极大地影响了乳制品的开发和应用[52]。
2.3.3 酶法交联
酶法交联技术是利用酶催化蛋白质分子内或分子间通过形成共价键发生蛋白交联的过程,在反应过程中,原有的过敏原蛋白的空间结构会随之改变,原有的过敏表位参与交联被破坏或被埋藏在蛋白分子内部,使蛋白致敏性降低,但近些年在这当面的研究相对较少。
程伟[53]探究了多酚氧化酶交联对α-LA致敏原性的影响,发现α-LA交联产物的IgG和IgE的结合能力均显著降低。Wróblewska等[54]将转谷氨酰胺酶添加到发酵的牛奶中制备成开啡尔饮品,发现在饮品中未检测到β-LG与特异性抗体之间的反应。
2.4 基因技术
牛遗传学一直致力于研究定量特征位点或与重要生物表型有关的遗传变异,多年来一直是研究的活跃领域。在牛乳中使用转基因方法主要是为了增加乳汁产量或改变乳汁成分,通过基因方式可以对乳蛋白过敏原表位的基因进行编码,使之无法生成过敏原表位,基因重组也可以改变过敏原的基因序列,从而去除其过敏性[55]。Wei等[56]应用了精确的受精卵介导的基因组编辑以消除致敏性的β-LG,发现孕育的小牛由于缺失9个碱基对,产生了不含β-LG的乳汁,这证实了通过基因技术安全生产低反应原性牛乳的可行性。在山羊上采用类似的方法,通过核移植在引入人类乳铁蛋白基因的同时,产生了完全去除β-LG的山羊乳,这使得生产含有高浓度人类乳铁蛋白的牛奶成为可能[57]。
DNA甲基化(DNA methylation,DNAm)是一种表观遗传机制,是通过将S-腺苷蛋氨酸中的甲基添加到DNA链上实现的,DNAm的改变在T细胞分化和维持Th1/Th2平衡中起关键作用[58-59]。现有的研究表明IgE介导的CMA患儿具有更明显的Th1和Th2细胞因子基因DNA甲基化模式,这都表明DNA甲基化可能是CMA防治的一个靶点[60],但这一研究领域仍处于起步阶段,仍需要大量的探究去确认。
3 调节免疫反应缓解致敏性
通过对蛋白的改性能有效降低机体识别能力与IgE的结合能力,最近的研究也表明肠道菌群和益生菌通过调节免疫反应同样对过敏反应起作用。根据分泌的细胞因子的不同,将CD4+T细胞分为Th1和Th2两个亚型,各种类型的亚型T细胞通过分泌不同的细胞因子共同调节机体的免疫反应,Th1型细胞主要分泌IFN-γ、IL-12等细胞因子,Th2型细胞主要分泌IL-3、IL-4、IL-5、IL-9和IL-13等细胞因子,这些细胞因子对肥大细胞、嗜碱性粒细胞、嗜酸性粒细胞和黏液生成细胞的分化、存活和活性等密切相关[61]。当CMA儿童接触过敏原时,机体内T细胞活化后倾向于向Th2型分化,原本的Th1/Th2平衡被打破,Th2细胞分泌过多的IL-4会促进IgE的分泌水平,影响过敏反应[62],此外,Treg/Th17的失衡也会诱发过敏症状。
3.1 肠道菌群与牛乳过敏
肠腔中定居着成千上万种共生微生物,当人出生时这些微生物就定植在肠道中,但随着人的生长,微生物的种类也发生着改变。当机体处于健康状态时,肠道菌群会保持着动态平衡,但这种平衡被破坏,肠道菌群对先天性淋巴细胞调节发生紊乱导致过敏反应。与健康儿童相比,CMA儿童的肠道菌群失调,粪便细菌多样性显著降低[63],梭状芽孢杆菌纲和疣微菌科在肠道菌群中的丰度显著增加,一些菌对T细胞受体信号传导、IL-4信号传导起着调节作用,所以菌群的变化对过敏性疾病有相关的作用[64]。Feehley等[65]用健康儿童和CMA儿童的粪便培养无菌小鼠,在小鼠中确定了一种可以防止食物过敏反应的梭状芽胞杆菌,通过这种菌株小鼠对牛乳蛋白的反应性降低,这表明肠道细菌对调节饮食抗原的过敏反应也至关重要。
食物在肠道中代谢的产物能够向机体一些信号,不同的膳食代谢后产生的营养物质不同,会产生不同的肠道菌群组成,调节不同的免疫应答[66]。膳食纤维消化后产生的短链脂肪酸能与G蛋白偶联受体结合,促使肠上皮细胞激活炎性小体产生IL-18,以维持肠道的完整性和修复肠上皮细胞损伤,同时还能作用于树突状细胞,促进Th0细胞分化为Foxp3+Treg或促进Foxp3+Treg自身增殖[64]。Foxp3+Treg能够分泌TGF-β、IL-10、IL-35维护口服耐受性或促进分泌IgA/IgG4型B细胞维护口服耐受性[66]。此外,胎儿从出生时免疫反应表现为Th2优势,出生后暴露于各种微生物下,导致免疫反应逐渐向Th1转化,有利于维护免疫耐受及Th1/Th2的平衡[67]。
3.2 益生菌与牛乳过敏
益生菌是一类对宿主有益的活性微生物,现阶段对益生菌的研究主要集中在乳杆菌属和双歧杆菌属。当机体出现过敏症状时,肠道黏膜上皮细胞的形态可能没有明显的损伤,但是黏膜免疫屏障已经被破坏,肠道的通透性显著增加[68],益生菌能够抑制病原菌生长和增加屏障功能,促进肠内抗原的降解/结构修饰,促使肠道内异常原生微生物菌群正常化,从而影响肠道微环境和免疫系统[69]。Basturk等[70]探究了鼠李糖乳杆菌和无乳饮食对CMA患者的效果,结果表明接受饮食4周后,食用益生菌试验组的婴儿在血便、腹泻、镇静和腹胀症状方面有显著改善(p≤0.001),粘液性粪便(p=0.038)和呕吐(p=0.034)的症状显著改善,这表明婴儿在接受鼠李糖乳杆菌饮食后其过敏症状明显改善。
益生菌调节牛乳过敏反应的作用还体现在其对Th1/Th2、Th17/Treg细胞平衡的调控。变应性炎症的效应细胞受Treg细胞促进和抑制等功能的调控,Treg细胞抑制Th2细胞及其细胞因子的产生,产生的IL-10和转化生长因子-β在抑制IgE的产生的同时,诱导非炎症性免疫球蛋白IgG4的产生[61]。Zhang等[71]发现通过嗜酸乳杆菌KLDS 1.0738能有效改善过敏小鼠的Treg/Th17失衡,降低了β-LG的过敏症状。Wróblewska等[72]评估了一些潜在的益生菌对乳蛋白免疫活性的影响,发现益生菌会影响调节性细胞因子的分泌,使Th1/Th2平衡朝着Th1反应转变,降低了过敏反应。益生菌能够除了通过诱导Treg细胞生成,抑制Th2细胞极化,促进Th1细胞分化,还能促进树突状细胞的成熟和IgE的产生[73](如图4)。益生菌还能够通过调节树突状细胞多表达MHC-Ⅱ、CD80和CD86等共刺激分子,调控树突状细胞的成熟和细胞因子的分泌,以调节机体黏膜免疫反应与耐受的平衡[74]。虽然益生菌能有效缓解过敏症状,但如今的研究还只是局限于动物实验的基础上,鲜有临床的应用,所以下一步的研究应向临床应用迈进。

图4 副干酪乳杆菌L9减缓牛乳过敏的机制[75]
4 结束语
综上所述,乳蛋白中存在的线性表位与构象表位是引起免疫学反应的基础,可以通过物理方法、化学方法、生物方法和基因技术改变乳蛋白的不同结构,通过对构象的破坏以达到减缓牛乳过敏的目的。其中,通过酶法水解或发酵技术能有效降低牛乳的致敏性,与其他方式相比拥有较好的优越性,有较好的市场前景。同时,与单一技术相比,多种技术复合使用时可以发挥协同作用展现出较好的抑制效果;例如,超声与其他方式结合使用时由于协同作用,效果较单一技术应用时要好。通过肠道菌群和益生菌的作用可以调节Th1/Th2和Treg/Th17细胞失衡,降低IgE的产生,减缓过敏症状。但如何在能降低过敏反应的同时,开发更具安全、有效的脱敏技术,开发满足人们营养与口感的新型乳制品仍需要进一步的深入研究和探讨。

