载基因/化疗药物双层纳米粒的制备及其体内外抗乳腺癌效应初步研究
马姝蕊,秦靖雯,宋梦清,胡丹慧,万国运,姬盛路,张其清,陈红丽
0 引 言
血管内皮生长因子(vascular endothelial growth factor,VEGF)不仅有促血管生成作用,而且是表达VEGF受体(vascular endothelial growth factorreceptor, VEGFR)的癌细胞的生存和自分泌生长因子,随着VEGF在肿瘤中作用的研究进展,引发了人们对其用于抗肿瘤治疗的关注,针对血管内皮生长因子通路的抗血管生成疗法用于临床治疗癌症已经超过十年,除了多种VEGF抑制剂外,沉默VEGF的表达是一种潜在疗法。与小分子抑制剂不同的是,小干扰RNA (small interfering RNA, siRNA)分子作用持久、具有高度特异性的靶基因沉默能力,VEGF siRNA可以通过抑制VEGF的表达,从而抗肿瘤血管增生,比传统的治疗具有优势,这已经成为抑制肿瘤生长的有力工具[1-4]。近些年来,采用DNA、siRNA等核酸疗法来下调突变基因,正在成为一种新型方法来抑制肿瘤细胞的生长和侵袭,然而,游离siRNA是一种阴离子亲水性双链小RNA,不易被细胞吸收,siRNA的亲水性和负电荷的性质也使其不能轻易穿过带负电荷的生物膜,在血清中的半衰期短,易被核酸酶降解,诸多因素使其在临床应用方面仍然存在着很大的挑战。因此,需要设计一个输送系统改善上述不足,目前,有许多纳米材料被用于构建siRNA治疗的输送载体,包括聚合物、脂质金、二氧化硅和氧化铁基纳米粒子,可以有效改善游离siRNA在应用中存在的问题。因此,有效的VEGF siRNA联合化疗等治疗方式以及与纳米递送系统的最佳组合为siRNA的临床治疗提供了思路,成为肿瘤治疗新的发展方向[5-9]。
课题组前期制备了双层纳米粒(DL NPs)作为治疗乳腺癌的药物输送体系,mPEG-g-CS作为DL NPs的外壳,内层为聚乳酸聚羟基乙酸共聚物(PLGA)纳米粒,内外层可分别负载不同药物[10-11]。本研究在前期研究基础上首先探索质粒(pDNA)与mPEG-g-CS复合成mPEG-g-CS-pDNA聚合物,考察基因负载能力,进一步验证载VEGF siRNA和盐酸表阿霉素(EPI)的DL-siRNA NPs的体内外抑瘤效应。化疗和抗血管生成基因治疗联合作用在乳腺癌等肿瘤治疗上的协同作用机制有待做进一步研究。
1 材料与方法
1.1 材料和仪器PLGA(分子量30 000 000,乳酸:羟基乙酸比为50:50)购于山东省医疗器械研究所,EPI购于浙江海正药业股份有限公司,mPEG-g-CS(采用甲醛连接法合成,聚乙二醇接枝率为12.54%)课题组合成[11],VEGF siRNA(正义链5′GGAGUACCCUGAUGAGAUCUU3′,反义链5′GAUCUCAUCAGGGUACUCCUU3′)由上海生工生物工程有限公司合成。荧光分光光度计(Spectramaxplus 384,美国分子仪器公司)、纳米粒度分析仪(nanoZS,英国马尔文仪器有限公司)。
1.2纳米粒的制备与表征
1.2.1 mPEG-g-CS/pDNA聚合物的制备超纯水溶解mPEG-g-CS,使其终浓度为0.1 mg/mL,超纯水稀释pDNA储存液,向一定体积的pDNA溶液中加入适量体积的mPEG-g-CS溶液,涡旋振荡30 s后静置获得不同N/P比(mPEG-g-CS聚合物与pDNA 的相对比例)的mPEG-g-CS-pDNA NPs。
1.2.2纳米粒包载siRNA复合物的制备及其理化表征不同N/P比的纳米粒-siRNA复合物(mPEG-g-CS-siRNA NPs,DL-siRNA NPs)的制备:将纳米粒溶液加入到20 μmol/L的 siRNA溶液中,涡旋振荡30 s,静置20~30 min,即可获得。
1.2.3纳米粒粒径分析及表面Zeta电位测定将上述纳米粒用超纯水稀释成适当浓度的溶液,动态光散射(DLS)法测定纳米粒的平均粒径和Zeta电位。
1.3琼脂糖凝胶电泳阻滞实验为了评估mPEG-g-CS对于siRNA缩合凝聚的效果,先将mPEG-g-CS与pDNA按N/P分别为0、0.1、0.2、0.4、0.8、1.2、2.0的比例混合,形成复合物,后依次上样进行琼脂糖凝胶电泳实验,于凝胶成像系统中观察电泳条带。
1.4纳米粒体外细胞毒及抑瘤实验CCK8试剂法考察纳米粒体外细胞毒效应:将2种细胞分别接种于96孔板,置于37 ℃,5% CO2培养箱中培养。细胞贴壁后,将培养基更换成含不同浓度的纳米粒或PEI的新鲜培养基,再次置于培养箱分别孵育24 h和48 h。每孔加入CCK-8试剂,继续孵育1.5 h,酶标仪450 nm 处测定各孔的吸光度,计算细胞存活率。体外抑瘤实验中,考察不同载药纳米粒对细胞活力影响,DL-NPs siRNA中EPI的载药量为4.48%[10-11],EPI组加入的游离药物浓度分别与对应组别纳米粒包载EPI浓度相等。
1.5纳米粒体内抑瘤效应雌性BALB/c-Nude 裸鼠,约5周龄,体重约18 g,北京维通利华实验动物技术有限公司。实验动物合格证号:No.1100111911057095,适应温度(25±2)℃,相对湿度45%~60%的标准条件。右侧腋窝皮下接种MCF-7细胞悬液,待肿瘤生长至约100 mm3,将裸鼠随机数字表法分成4组,每组6只,重复3次:等渗盐水组,游离EPI组、mPEG-g-CS-siRNA NPs组以及DL NPs-siRNA组,EPI给药剂量为25 mg EPI/kg,mPEG-g-CS-siRNA以及DL-siRNA NPs给药剂量为65 μg siRNA/ kg,开始进行治疗。定期测量肿瘤长宽,22 d时处死裸鼠,取出肿瘤组织、称重。当双层空白纳米粒作为转染试剂,siRNA浓度为100 nmol/L和150 nmol/L时,MCF-7细胞存活率分别为83.34%和80.21%,发现siRNA在100 nmol/L和150 nmol/L这两种浓度下对于细胞活力的影响没有显著性差别,综合材料用量以及效果的考虑,本实验认为100 nmol/L为siRNA的最佳转染浓度。
2 结 果
2.1 纳米粒表面形貌表征N/P比例对于纳米粒zeta电位有显著影响,在N/P比例区间范围为5~40内逐渐增加时,mPEG-g-CS-siRNA与DL NPs-siRNA的Zeta 电位从负电位逐渐增加,最终变为正电位。此外N/P比例和纳米粒子的组成对于纳米粒的尺寸大小也有一定影响,并且纳米粒的尺寸大小并不随着N/P比例的递增呈现趋势。当N/P比例为5时,mPEG-g-CS-siRNA的粒径最小[(-12.70±0.42)nm],当N/P比例为10时,mPEG-g-CS-siRNA的粒径次大[(178.50±20.61)nm];而对DL NPs-siRNA而言,当N/P比例为20时其粒径最小[(153.82±30.15)nm],当N/P比例为5时其粒径次大[(160.00±30.02)nm]。
2.2琼脂糖凝胶电泳阻滞分析琼脂糖凝胶电泳条带结果如图1所示,以 N/P = 0即裸pDNA为对照,可以看出有明显的荧光条带,并且mPEG-g-CS 对于pDNA的缩合凝聚能力随N/P比例增加增加;当 N/P 比例为0.1时,可以看到有少量的 pDNA迁移,此时 mPEG-g-CS 不能完全缩合pDNA;当 N/P 比例为0.4及之上,pDNA完全被 mPEG-g-CS 阻滞,mPEG-g-CS完全缩合pDNA。

1:Marker 5000; 2-8:分别为N/P为0、0.1、0.2、0.4、0.8、1.2、2.0
2.3体外细胞毒评价结果显示,以聚乙烯亚胺(PEI)为阳性对照,MCF-7细胞、HUVEC细胞与纳米粒共孵育24、48、72h后,mPEG-g-CS-pDNA NPs 都显示出较低的毒性。但是随着培养时间的延长,mPEG-g-CS-pDNA NPs的毒性增加,见图2。

a:MCF-7; b:HUVEC
与本课题组制备的材料相比,当PEI作为基因负载材料,siRNA浓度为100 nmol/L时,MCF-7细胞存活率为78.66%,HUVEC的细胞存活率为85.69%,毒性更大;与空白载体相比,细胞毒性随载siRNA浓度的增大而增加。见图3。

a:MCF-7; b:HUVEC
2.4体外抑瘤效果在孵育24 h时,DL NPs-siRNA浓度为0.5、50和500 μg/mL时MCF-7细胞的平均存活率分别是92.4%、78.1%和51.4%,且随着孵育时间的延长,各组细胞存活率均降低。相同条件下DL NPs-siRNA组抑制MCF-7和HUVEC细胞效果显著高于mPEG-g-CS- siRNA NPs和EPI组。见图4。

a:MCF-7 24 h; b:MCF-7 48 h; c:HUVEC 24 h; d:HUVEC 48 h
2.5基因/化疗药物双层纳米粒体内抑瘤效应对照组的肿瘤体积不断增长;与对照组相比,EPI、mPEG-g-CS-siRNA、DL NPs-siRNA组均表现出明显的抗肿瘤效果。治疗4 d后,游离EPI组的肿瘤体积持续攀升,而mPEG-g-CS-siRNA、DL NPs-siRNA组肿瘤体积开始减小,并且DL NPs-siRNA联合治疗组对于肿瘤生长有显著抑制作用(P<0.01);治疗22 d后,游离EPI组、mPEG-g-CS-siRNA组、DL NPs-siRNA组的肿瘤抑制率分别为22.36%、85.01%和99.90%。22 d后,解剖小鼠,取出肿瘤组织,对照组的肿瘤体积和质量最大,DL NPs-siRNA组最小,肿瘤几乎完全消失。见图5。
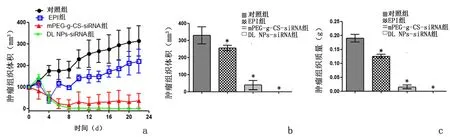
与对照组比较,*P<0.05
3 讨 论
VEGF是一种特异性作用于血管内皮细胞的细胞因子,可促进肿瘤血管生成。已知siRNA不产生耐药,可以特异性抑制靶基因的表达,而不会造成显著的毒性[12-13],VEGF siRNA将通过抑制VEGF的表达,发挥抗肿瘤血管生成的作用[14-16]。VEGF siRNA和化疗药物联合,可发挥协同治疗肿瘤的功效,有望成为一种潜在的有用的治疗高血管化肿瘤的方式。
亲水性的聚乙二醇在血液中具有稳定长循环特点,可以自组装成纳米粒,并且聚乙二醇化的纳米粒在全身给药物/基因后可以靶向肿瘤,增加药效。除此之外,静脉注射聚乙二醇化siRNA脂质体还可显著降低siRNA在肺内的积累[17-20]。壳聚糖的阳离子性质使其可以复合丰富的阴离子核酸,保护血清中核酸酶的降解,实现高效的基因治疗。此外,壳聚糖包裹基因后,形成尺寸很小的纳米粒,容易穿透细胞膜,是一种有效的基因载体[21-26]。
因此,本研究利用课题组前期制备的双层纳米粒(DL NPs)作为乳腺癌联合化疗用的药物输送体系,外层为mPEG-g-CS,包载VEGF siRNA,内层为PLGA,包载EPI。结果表明,N/P比例和纳米粒子的组成对于纳米粒的尺寸大小和Zeta电位有明显的影响,考虑到纳米粒的尺寸大小和Zeta电位的影响,进行凝胶电泳阻滞实验。pDNA和siRNA都属于核酸类分子,且分子量大,条带区分明显,除此之外,RNA易在空气中被降解。因此,我们制备 mPEG-g-CS/pDNA 聚合物,代替mPEG-g-CS负载siRNA,进行凝胶电泳阻滞实验。证明N/P比例还对纳米粒对于pDNA的缩合凝聚能力有显著的影响,当N/P 为0.4时,mPEG-g-CS与pDNA充分结合。在所有阳离子聚合物中,聚乙烯亚胺(PEI)因其具有较强的基因络合性和较高的转染效率而成为研究最多的基因传递阳离子聚合物。但其毒性问题严重,在临床试验中的应用受到限制。因此,我们以其为阳性对照,探究纳米粒的体外细胞毒性,发现双层空白纳米粒与PEI相比,毒性更小。凝胶电泳阻滞实验和体外细胞毒实验均表明,mPEG-g-CS可以作为基因载体。载基因和化疗药物的双层纳米粒体内外抑瘤效应的结果显示,载基因和化疗药物纳米粒对MCF-7细胞和HUVEC细胞的抑制作用均具有浓度和时间依赖性;化疗药物和抗血管增生基因治疗联合治疗时,肿瘤体积明显更小,初步表明负载VEGF siRNA和EPI的药物输送体系体系在体内外发挥了较好的抗肿瘤的作用。
综上所述,本研究作为输送载体的DL NPs,制备简单,毒性小,mPEG-g-CS在N/P 为0.4时,可以完全缩合pDNA,是一种有效的基因载体。本研究选用抗VEGF siRNA与化疗药物联合治疗,有效的抑制了乳腺癌的生长。因此,DL NPs有望成为一种有前景的药物输送体系。