阿魏酸对人肝癌HepG2细胞增殖、侵袭和凋亡的影响
音金萍 卓少元

中圖分类号 R965 文献标志码 A 文章编号 1001-0408(2021)13-1565-07
DOI 10.6039/j.issn.1001-0408.2021.13.05
摘 要 目的:研究阿魏酸对人肝癌HepG2细胞增殖、侵袭和凋亡的影响。方法:采用CCK-8法筛选阿魏酸的给药浓度;采用Western blot法筛选白细胞介素6(IL-6)诱导磷酸化信号转导蛋白及转录激活子3(p-STAT3)蛋白高表达的HepG2细胞模型的最佳造模浓度。将HepG2细胞分为空白对照组、模型组、阿魏酸组(0.5 mmol/L)和阳性对照组(p-STAT3抑制剂C188-9,10 μmol/L),除空白对照组外,模型组加入IL-6、各给药组加入IL-6和相应药物分别进行培养。采用CCK-8法、 Transwell法和Annexin V-FITC/PI双染色法分别检测各组细胞存活率、侵袭数和早期、晚期凋亡率;采用Western blot法检测各组细胞中p-STAT3、胱天蛋白酶3(caspase-3)、锌指蛋白(ZBP-89)和波形蛋白(vimentin)的表达水平。基于PDB蛋白数据库,以STAT3高度相似晶体结构1BG1为对接模板,以Tyr705周围的区域为假定的结合口袋,进行阿魏酸与STAT3蛋白的分子对接分析。结果:选择以0.5 mmol/L 阿魏酸干预HepG2细胞48 h作为后续实验条件,以50 ng/mL IL-6为造模条件。与空白对照组比较,模型组细胞侵袭数和p-STAT3/STAT3比值、vimentin蛋白表达水平均显著增加或升高(P<0.05或P<0.01),细胞晚期凋亡率和caspase-3蛋白表达水平均显著降低(P<0.05或P<0.01)。与模型组比较,阿魏酸组和阳性对照组细胞存活率、侵袭数、p-STAT3/STAT3比值和vimentin蛋白表达水平均显著减少或降低(P<0.05或P<0.01),细胞早期凋亡率(阿魏酸组除外)、晚期凋亡率和caspase-3、ZBP-89(阳性对照组除外)蛋白表达水平均显著升高(P<0.05或P<0.01)。分子对接结果表明,阿魏酸的羧酸基团与Asn581、Lys591分别存在1.9?、2.0?的氢键作用,结合能为-4.4 kcal/mol。结论:阿魏酸可能通过与STAT3磷酸化位点直接结合来抑制p-STAT3的活性;并可通过STAT3依赖性途径上调caspase-3蛋白表达,或可通过STAT3非依赖性途径上调ZBP-89蛋白表达,进而下调vimentin蛋白表达,从而抑制HepG2细胞的增殖、侵袭与凋亡。
关键词 阿魏酸;人肝癌HepG2细胞;信号转导蛋白及转录激活子3;胱天蛋白酶3;波形蛋白
Effects of Ferulic Acid on the Proliferation, Invasion and Apoptosis of HepG2 Hepatocellular Carcinoma Cells
YIN Jinping,ZHUO Shaoyuan(School of Basic Medical Science, Guangxi University of TCM, Nanning 530200, China)
ABSTRACT OBJECTIVE: To study the effects of ferulic acid on the proliferation, invasion and apoptosis of HepG2 hepatocelluar carcinoma cells. METHODS: CCK-8 assay was used to screen the concentration of ferulic acid. Western blot assay was adopted to screen the optimal concentration of interleukin 6 (IL-6) to induce HepG2 cell model with high expression of phosphorylated signal transduction protein and activator 3 (p-STAT3) protein. HepG2 cell were divided into blank control group, model group, ferulic acid group (0.5 mmol/L) and positive control group (p-STAT3 inhibitor C188-9, 10 μmol/L). Except for blank control group, model group treated with IL-6, while administration groups were treated with IL-6 and relevant drugs. Cell survival rate, invasion and apoptosis rate in early and late stage were detected by CCK-8 assay, Transwell assay and Annexin V-FITC/PI double staining, respectively. Western blot assay was used to detect the expression of p-STAT3, caspase-3, ZBP-89 and vimentin proteins in each group. On the basis of the PDB protein database, using 1BG1, a highly similar crystal structure of STAT3, as docking template, using the region around Tyr705 as the putative binding pocket, the docking analysis of ferulic acid with STAT3 protein was carried out. RESULTS: It is selected to use 0.5 mmol/L ferulic acid intervention for 48 h as the follow-up experimental condition; 50 ng/mL IL-6 was selected as the modeling condition. Compared with blank control group, the number of cell invasion, p-STAT3/STAT3 ratio and protein expression of vimentin were increased significantly in model group (P<0.05 or P<0.01), while late apoptosis rate and protein expression of caspase-3 were decreased significantly (P<0.05 or P<0.01). Compared with model group, cell survival rate, the number of cell invasion, p-STAT3/STAT3 ratio and protein expression of vimentin were decreased significantly in ferulic acid group and positive control group (P<0.05 or P<0.01); early apoptotic rate (except for ferulic acid group), late apoptotic rate, the protein expression of caspase-3 and ZBP-89 (except for positive control group) were increased significantly (P<0.05 or P<0.01). The results of molecular docking showed that the carboxylic groups of ferulic acid could interact with 1.9 ? hydrogen bond of Asn581 and 2.0 ? hydrogen bond of Lys591, with binding energy of -4.4 kcal/mol. CONCLUSIONS: Ferulic acid may inhibit the activity of p-STAT3 by directly binding to the phosphorylation site of STAT3; it may up-regulate the protein expression of caspase-3 via STAT3 dependent pathway, or up-regulate the protein expression of ZBP-89 via STAT3 independent pathway and then down-regulate the protein expression of vimentin, so as to inhibit the proliferation, invasion and apoptosis of HepG2 cells.
KEYWORDS Ferulic acid; HepG2 hepatocellular carcinoma cell; STAT3; Caspase-3; Vimentin
原发性肝癌是全球第六大常见癌症,2020年其新发病例约90.6万,病死病例约83万;其中最常见的是肝细胞癌,约占原发性肝癌的75%~85%[1]。
阿魏酸是来源于阿魏和当归等中药的一种酚酸类成分,其性质稳定、毒性低,具有解毒、保肝等作用,且可有效抑制肝癌细胞的生长、促进肝癌细胞的凋亡[2-3],但其抗肝癌的分子机制及作用靶点尚未完全明确。研究表明,信号转导蛋白及转录激活子3(STAT3)和波形蛋白(vimentin)均在肝癌组织或肝癌细胞株中过度表达,并作为一种重要的信号分子和转录因子,参与肝癌细胞的快速增殖、侵袭和转移[4-6]。当肝癌细胞受到刺激后,促进白细胞介素6(IL-6)等炎症因子激活STAT3的磷酸化[7-8],然后磷酸化STAT3(p-STAT3)以二聚体的形式转入细胞核,调控细胞凋亡关键分子胱天蛋白酶3(caspase-3)或抑癌因子锌指蛋白(ZBP-89),进而增强vimentin表达,从而促进肝癌细胞增殖、侵袭并抑制其凋亡[9-12]。但阿魏酸是否可通过STAT3-vimentin信号通路发挥抗肝癌作用尚不明确。
基于此,本研究利用人重组因子IL-6诱导p-STAT3高表达的人肝癌HepG2细胞模型,以p-STAT3抑制剂C188-9为阳性对照[13],基于STAT3-vimentin信号通路探讨阿魏酸对HepG2细胞增殖、侵袭和凋亡的影响,并結合分子对接技术预测阿魏酸与STAT3的结合位点,探讨阿魏酸抗肝癌作用的靶点与分子机制,以期为其临床应用提供实验基础。
1 材料
1.1 主要仪器
本研究所用主要仪器有MCO-18AIC型 CO2细胞培养箱(日本Sanyo公司),Epoch 型全波长酶标仪(美国 BioTek公司),LSRFortessa型流式细胞仪(美国BD公司),PowerPac TM Universal Power Supply型电泳仪、全能型成像分析系统(美国 Bio-Rad公司),垂直式电泳槽和转膜仪(北京六一生物技术有限公司),MDF-U7386S型超低温冰箱、ST 16R型高速离心机(美国Thermo Fisher Scientific公司)等。
1.2 主要药品与试剂
本研究所用主要药品与试剂有高糖DMEM培养基、Annexin V-FITC/PI凋亡检测试剂盒(美国 Wisent 公司,批号分别为319006023、A211-01),0.25%胰蛋白酶、胎牛血清(美国Gibco公司,批号分别为2120917、2148169CP),p-STAT3抑制剂C188-9(美国Mce公司,批号31595),CCK-8细胞增殖检测试剂盒(南京诺唯赞生物科技有限公司,批号7E271E8),Matrigel基质胶(美国BD公司,批号354234),十二烷基硫酸钠-聚丙烯酰胺(SDS-PAGE)凝胶快速配制试剂盒(上海碧云天生物技术有限公司,批号120319191206),Transwell小室(美国Corning公司,批号09420061),阿魏酸(成都曼斯特生物科技有限公司,批号MUST-20060511,纯度≥98%),人重组因子IL-6(美国Peprotech公司,批号0215102c2793),BCA 蛋白定量试剂盒(武汉博士德生物工程有限公司,批号14G08A46),ECL 发光试剂盒(北京中杉金桥生物技术有限公司,批号7E34E9),RIRA裂解液(北京索莱宝生物技术有限公司,批号20190922),蛋白磷酸酶抑制剂(杭州弗德生物科技有限公司,批号20200114),兔源caspase-3多克隆抗体、兔源p-STAT3单克隆抗体(美国CST公司,批号分别为34、18),兔源GAPDH多克隆抗体、兔源STAT3多克隆抗体、兔源vimentin多克隆抗体、山羊抗兔免疫球蛋白G(IgG)二抗(武汉三鹰生物技术有限公司,批号分别为00078427、00081195、00086320、20000217),兔源ZBP-89多克隆抗体(北京博奥森生物技术有限公司,批号AC07172366);其余试剂为实验室常用规格,水为纯净水。
1.3 细胞
本研究所用人肝癌细胞株HepG2由广西中药药效研究重点实验室提供。
2 方法
2.1 细胞培养
采用含10%胎牛血清的高糖DMEM培养基(以下简称培养基)于37 ℃、5%CO2的培养箱中常规培养HepG2细胞。当细胞生长至80%时,向培养瓶中加入0.25%胰酶消化,经培养基中和后,制成细胞悬液,以进行传代和后续研究。
2.2 阿魏酸的干预时间和给药浓度的筛选
采用CCK-8法进行筛选。取对数生长期的HepG2细胞,加入0.25%胰酶消化,制成密度为5×104 mL-1的细胞悬液;取100 μL细胞悬液接种于96孔板中,然后分为空白对照组和阿魏酸不同浓度组(0.125、0.25、0.5、1、2、4 mmol/L,浓度参考文献[14]设置),每组设3个复孔;并设置调零孔(只加培养基不加细胞,下同)。将细胞于37 ℃、5% CO2的培养箱中培养24 h后,给药组加入100 μL含相应浓度阿魏酸的无血清培养基,空白对照组加入100 μL无血清培养基。分别于作用12、24、48 h时,根据CCK-8细胞增殖检测试剂盒说明书操作,采用酶标仪于450 nm波长处测定各组的光密度(OD)值,并计算细胞存活率[细胞存活率=(OD给药组-OD调零孔)/(OD空白对照组-OD调零孔)×100%],以筛选阿魏酸的干预时间和给药浓度。
2.3 IL-6造模浓度的筛选
参考文献[15-16]方法进行筛选。取对数生长期的HepG2细胞,加入0.25%胰酶消化,制成2.5×105 mL-1的细胞悬液;取2 mL细胞悬液接种于6孔板中,然后分为空白对照组和IL-6不同造模浓度组(12.5、25、50、100、200 ng/mL,浓度参考文献[15-16]设置),每组设3个复孔。待HepG2细胞生长至80%时,IL-6不同造模浓度组加入含相应质量浓度IL-6的无血清培养基2 mL,空白对照组加入不含IL-6的无血清培养基2 mL,于37 ℃、5% CO2的培养箱中培养48 h后,用细胞刮刮取细胞,并以 1 000 r/min離心5 min获得细胞沉淀。取细胞沉淀,加入RIPA裂解液、PMSF和蛋白磷酸酶抑制剂(体积比为100 ∶ 1 ∶ 1)适量,于冰上裂解30 min;于4 ℃条件下以12 000 r/min离心5 min,取上清液,采用BCA 蛋白定量试剂盒检测蛋白浓度。蛋白经变性处理后进行SDS- PAGE电泳,转膜,于封闭液中封闭30 min;以TBST洗膜30 min,分别加入GAPDH一抗(稀释度为1 ∶ 5 000)、p-STAT3一抗(稀释度为1 ∶ 2 000)、STAT3一抗(稀释度为1 ∶ 2 000),孵育过夜;以TBST洗膜30 min,加入二抗(稀释度为1 ∶ 5 000),孵育1 h;以TBST洗膜30 min,加入显影液,经凝胶成像系统成像。采用Image J v1.8.0软件进行分析,以p-STAT3蛋白灰度值与STAT3蛋白灰度值的比值表示STAT3的磷酸化程度,该比值越大,则表示STAT3磷酸化程度越高(下同)。
2.4 分组、造模与给药
取对数生长期的HepG2细胞,分为空白对照组、模型组、阿魏酸组(0.5 mmol/L)和阳性对照组(C188-9,10 μmol/L,浓度根据文献[17]设置)。待细胞生长至80%时,空白对照组加入无血清培养基(6孔板加入培养基2 mL,96孔板加入培养基100 μL,下同),模型组加入含50 ng/mL IL-6的无血清培养基,阿魏酸组加入含50 ng/mL IL-6和0.5 mmol/L阿魏酸的无血清培养基,阳性对照组加入含50 ng/mL IL-6和10 μmol/L C188-9的无血清培养基,再继续培养48 h后进行后续检测。
2.5 细胞存活率的检测
采用CCK-8法进行检测。取对数生长期的HepG2细胞,加入0.25%胰酶消化,制成5×104 mL-1的细胞悬液;取100 μL细胞悬液接种于96孔板中,于37 ℃、5% CO2的培养箱中培养48 h后,按“2.4”项下方法分组、造模与给药,每组设3个复孔,并设置调零孔。然后根据CCK-8细胞增殖检测试剂盒说明书操作,采用酶标仪于450 nm波长处测定各孔的OD值,并计算细胞存活率。
2.6 细胞侵袭能力的检测
采用Transwell小室法进行检测。取对数生长期的HepG2细胞,按“2.4”项下方法分组、造模与给药;培养过程中另取培养基稀释Matrigel基质胶(体积比为1 ∶ 8),两者混匀后,以50 μL/孔加入Transwell小室上层,并于培养箱中过夜风干;取上述各组细胞制成2.5×105 mL-1的细胞悬液,然后分别取细胞悬液100 μL加入至Transwell小室上层中,小室下层中加入700 μL含10%胎牛血清的培养基,于37 ℃、5%CO2的培养箱中培养24 h;取出小室,经甲醛固定、结晶紫染色、棉签拭去未侵袭细胞后,于显微镜下随机选取3个视野观察被染成蓝紫色的细胞,即为侵袭细胞,并统计各组的侵袭细胞数。
2.7 细胞凋亡率检测
采用Annexin V-FITC/PI双染色法进行检测。取对数生长期的HepG2细胞,加入0.25%胰酶消化,制成2.5×105 mL-1的细胞悬液;取2 mL细胞悬液接种于6孔板中,于37 ℃、5%CO2的培养箱中培养24 h后,按“2.4”项下方法分组、造模与给药,每组设3个复孔。然后根据Annexin V-FITC/PI凋亡检测试剂盒说明书方法操作,采用流式细胞仪进行细胞凋亡率检测。
2.8 细胞中p-STAT3、STAT3、ZBP-89、caspase-3、vimentin蛋白表达水平检测
采用Western blot法进行检测。取对数生长期的HepG2细胞,加入0.25%胰酶消化,制成2.5×105 mL-1的细胞悬液;取2 mL细胞悬液接种于6孔板中,按“2.4”项下方法分组、造模与给药,每组设3个复孔。培养结束后,刮取各组细胞,按“2.3”项下“于4 ℃条件下以12 000 r/min离心5 min获得细胞沉淀……于封闭液中封闭30 min”步骤操作,然后以TBST洗膜30 min,分别加入GAPDH一抗(稀释度为1 ∶ 5 000)、p-STAT3一抗(稀释度为1 ∶ 2 000)、STAT3一抗(稀释度为1 ∶ 2 000)、ZBP-89一抗(稀释度为1 ∶ 1 000)、vimentin一抗(稀释度为1 ∶ 1 000)、caspase-3一抗(稀释度为1 ∶ 1 000),孵育过夜;以TBST洗膜30 min,加入二抗(稀释度为1 ∶ 5 000),孵育1 h;以TBST洗膜30 min,加入显影液,经凝胶成像系统成像。采用Image J v1.8.0软件进行分析,以p-STAT3蛋白灰度值与STAT3蛋白灰度值的比值表示STAT3的磷酸化程度,以ZBP-89、vimentin 、caspase-3蛋白灰度值与内参蛋白GAPDH的灰度值的比值表示其表达水平。
2.9 阿魏酸与STAT3蛋白的分子对接分析
通过PDB蛋白数据库(https://www.rcsb.org/)获得STAT3蛋白分子4个高度相似的晶体结构(PDB条目分别为4E68、1BG1、6QHD、3CWG)。通过查阅文献发现,抑制剂C188-9主要通过作用于STAT3蛋白的SH2结构域,抑制Tyr705位点的磷酸化[13]。因此,笔者假定该结构域为阿魏酸与STAT3蛋白的结合位点,以1BG1为对接模板、以Tyr705周围的区域为假定的结合口袋(包括氨基酸Lys591、Arg609、Phe610、Ser611、Ser613、Thr620、Ser636、Val637、Pro639),进行分子对接分析。
2.10 统计学分析
采用 SPSS 17.0 軟件进行统计分析。将符合正态分布的数据以x±s表示,采用单因素方差分析;不符合正态分布的数据采用秩和检验。P<0.05表示差异有统计学意义。
3 结果
3.1 阿魏酸干预时间和给药浓度的筛选结果
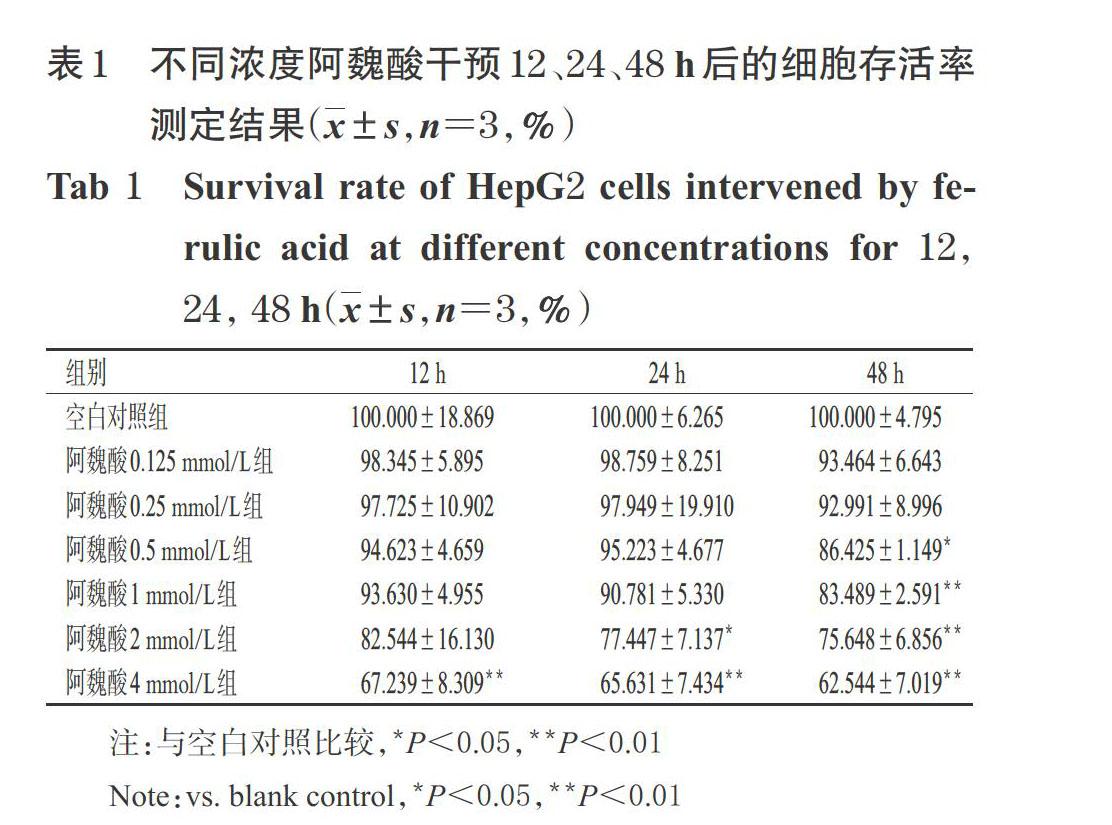
阿魏酸干预12 h后,与空白对照组比较,阿魏酸4 mmol/L组细胞存活率显著降低(P<0.01),阿魏酸其余浓度组细胞存活率差异无统计学意义;阿魏酸干预24 h后,与空白对照组比较,阿魏酸2、4 mmol/L组细胞存活率显著降低(P<0.05或P<0.01);阿魏酸干预48 h后,与空白对照组比较,阿魏酸0.5、1、2、4 mmol/L组细胞存活率均显著降低(P<0.05或P<0.01),详见表1。基于此,本研究采用以0.5 mmol/L 阿魏酸干预48 h的条件进行后续试验。
3.2 IL-6造模浓度的筛选结果
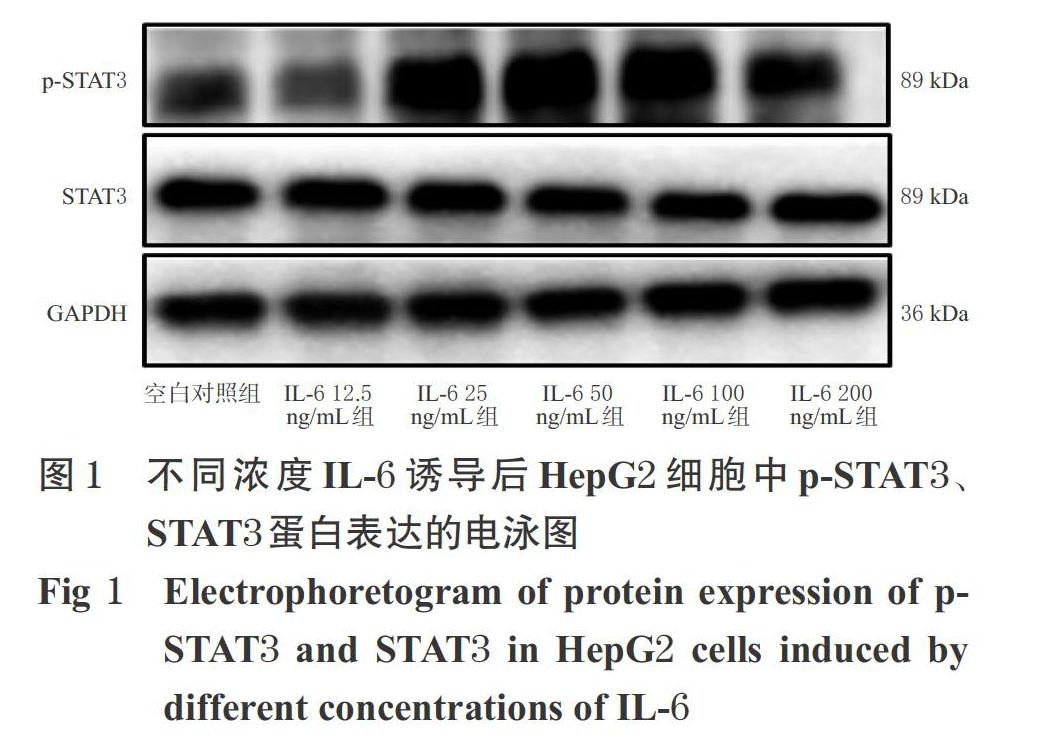
与空白对照组比较,IL-6 25、50、100、200 ng/mL组细胞中p-STAT3/STAT3比值均显著升高(P<0.05或P<0.01);与IL-6 50、100 ng/mL组比较,IL-6其余浓度组细胞中p-STAT3/STAT3比值均显著降低(P<0.05或P<0.01),但IL-6 50、100 ng/mL两组间比较差异无统计学意义(P>0.05)。基于此,后续试验采用50 ng/mL IL-6来诱导建立p-STAT3蛋白高表达的HepG2细胞模型,详见图1、表2。
3.3 阿魏酸对HepG2细胞存活率的影响
与空白对照组比较,模型组细胞存活率差异无统计学意义(P>0.05);与模型组比较,阿魏酸组和阳性对照组细胞存活率均显著降低(P<0.05或P<0.01);与阳性对照组比较,阿魏酸组细胞存活率显著升高(P<0.01),详见表3。
3.4 阿魏酸对HepG2细胞侵袭能力的影响
与空白对照组比较,模型组HepG2细胞侵袭数显著增加(P<0.01);与模型组比较,阿魏酸组和阳性对照组细胞侵袭数显著减少(P<0.01);与阳性对照组比较,阿魏酸组细胞侵袭数显著增加(P<0.05),详见图2、表3。
3.5 阿魏酸对HepG2细胞凋亡的影响
与空白对照组比较,模型组HepG2细胞的早期凋亡率差异无统计学意义(P>0.05),晚期凋亡率显著降低(P<0.05);与模型组比较,阿魏酸组细胞的晚期凋亡率和阳性对照组细胞的早期、晚期凋亡率均显著升高(P<0.05或P<0.01);与阳性对照组比较,阿魏酸组细胞的早期、晚期凋亡率均显著降低(P<0.01),详见图3、表4。
3.6 阿魏酸对HepG2细胞中p-STAT3、STAT3、ZBP- 89、caspase-3和vimentin蛋白表达的影响
与空白对照组比较,模型组细胞中p-STAT3/STAT3比值、vimentin蛋白表达水平均显著升高(P<0.05或P<0.01),caspase-3蛋白表达水平显著降低(P<0.01);与模型组比较,阿魏酸组和阳性对照组细胞中p-STAT3/STAT3比值、vimentin蛋白表达水平均显著降低(P<0.05或P<0.01),caspase-3、ZBP-89(阳性对照组除外)蛋白表达水平均显著升高(P<0.05或P<0.01);与阳性对照组比较,阿魏酸组细胞中p-STAT3/STAT3比值、vimentin和ZBP-89蛋白表达水平均显著升高(P<0.05或P<0.01),详见图4、表5。
3.7 阿魏酸与STAT3蛋白分子对接结果
选取1BG1为对接模板,以Tyr705周围的区域为假定的结合口袋进行分子对接。结果表明,阿魏酸的羧酸基团与Asn581、Lys591分别存在1.9?、2.0?的氢键作用,结合能为-4.4 kcal/mol,详见图5。
4 讨论
临床研究表明,STAT3及其激活型p-STAT3在大多数肝细胞癌患者的肝癌组织中高表达[18],且STAT3信号通路的激活在肝细胞癌进展与转移中发挥着重要作用[19]。STAT3通常以非活化形式存在于细胞质中,当细胞受到刺激时,IL-6等炎性因子可通过与细胞膜受体结合,作用于gp130蛋白,激活非受体酪氨酸激酶(JAK),进而磷酸化修饰STAT3蛋白分子;p-STAT3以二聚体形式转入细胞核,调控癌基因表达[4,20]。研究表明,p- STAT3可通过结合ZBP-89或抑制caspase-3表达,从而促进vimentin蛋白的表达及其在癌细胞中的作用[9-12]。ZBP-89是vim基因启动子区域的负调控因子,其与p-STAT3直接相互作用后,不仅可促进vim基因抗沉默子元件的作用来增强vimentin的表达,还可减弱自身募集组蛋白去乙酰化酶1(HDAC1)到vim启动子区域的能力,从而使vimentin乙酰化增强,进而促进癌细胞的迁移[9-10];凋亡关键分子caspase-3可裂解vimentin蛋白,而p-STAT3可通过抑制caspase-3的表达,降低后者对vimentin蛋白的裂解能力进而上调vimentin表达[11-12]。
本研究确定以0.5 mmol/L 阿魏酸干预HepG2细胞48 h的条件进行研究,且以50 ng/mL IL-6诱导的p- STAT3高表达HepG2细胞模型最佳。然后基于此进行后续研究发现,与空白对照组比较,模型组细胞侵袭数显著增加,p-STAT3/STAT3比值、vimentin蛋白表达水平均显著升高,细胞晚期凋亡率和caspase-3蛋白表达水平均显著降低,表明STAT3蛋白磷酸化水平的升高可抑制caspase-3(而不是ZBP-89)蛋白表达,进而上调肝癌细胞中vimentin的蛋白表达。经阿魏酸和阳性对照干预后,阿魏酸组和阳性对照组细胞存活率、细胞侵袭数、p-STAT3/STAT3比值、vimentin蛋白表达水平均显著降低,细胞早期凋亡率(阿魏酸组除外)、晚期凋亡率、caspase-3和ZBP-89(阳性对照组除外)蛋白表达水平均显著升高,表明阿魏酸可能通过下调STAT3蛋白磷酸化水平,上调caspase-3蛋白表达,进而促使vimentin蛋白下调。另外分子对接的分析结果也进一步证实了阿魏酸可作用于STAT3的SH2结构域,从而影响STAT3蛋白的磷酸化。尽管本研究结果也证实阿魏酸可明显上调ZBP-89蛋白的表达,但与阳性对照结果不一致,提示阿魏酸对ZBP-89蛋白的上调可能与STAT3无关。
综上所述,阿魏酸可能通过与STAT3蛋白磷酸化位点直接结合来抑制p-STAT3活性;并可通过STAT3依赖性途径上调caspase-3蛋白表达,或可通过STAT3非依赖性途径上调ZBP-89蛋白表达,进而下调vimentin蛋白表达,从而抑制HepG2细胞的增殖、侵袭与凋亡。
参考文献
[ 1 ] SUNG H,FERLAY J,SIEGEL R L,et al. Global cancer statistics 2020:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin,2021,70(4):313.
[ 2 ] DAS U,MANNA K,ADHIKARY A,et al. Ferulic acid enhances the radiation sensitivity of lung and liver carcinoma cells by collapsing redox homeostasis:mechanistic involvement of Akt/p38 MAPK signalling pathway[J]. Free radical research,2019,53(9/10):944-967.
[ 3 ] EZHUTHUPURAKKAL P B,ARIRAMAN S,ARUMUGAM S,et al. Anticancer potential of ZnO nanoparticle-ferulic acid conjugate on Huh-7 and HepG2 cells and diethyl nitrosamine induced hepatocellular cancer on Wistar albino rat[J]. Nanomedicine,2018,14(2):415-428.
[ 4 ] 音金萍,岳紫晨,卓少元. STAT3:慢性炎癥介导肝癌进程的关键分子[J].临床肝胆病杂志,2020,36(4):948- 952.
[ 5 ] 谢金玲,卓少元. Vimentin在原发性肝癌发生发展及凋亡过程中的作用[J].中国肿瘤,2017,26(2):130-134.
[ 6 ] 孙志欣,张莹.桔皮素对人肝癌HepG2细胞体外增殖和侵袭的影响及机制研究[J].中国药房,2016,27(34):4800-4803.
[ 7 ] HENDRAYANI S F,AL-HARBI B,AL-ANSARI M M,et al. The inflammatory/cancer-related IL-6/STAT3/NF-κB positive feedback loop includes AUF1 and maintains the active state of breast myofibroblasts[J]. Oncotarget,2016,7(27):41974.
[ 8 ] CAMPANA L,LEWIS P J S,PELLICORO A,et al. The STAT3-IL-10-IL-6 pathway is a novel regulator of macrophage efferocytosis and phenotypic conversion in sterile liver injury[J]. J Immunol,2018,200(3):1169-1187.
[ 9 ] WU Y,DIAB I,ZHANG X,et al. STAT3 enhances vimentin gene expression by binding to the antisilencer element and interacting with the repressor protein,ZBP-89[J]. Oncogene,2004,23(1):168-178.
[10] WU Y,ZHANG X,SALMON M,et al. The zinc finger repressor,ZBP-89,recruits histone deacetylase 1 to repress vimentin gene expression[J]. Genes Cells,2007,12(8):905-918.
[11] SHIN S,SUNG B J,CHO Y S,et al. An anti-apoptotic protein human survivin is a direct inhibitor of caspase-3 and -7[J]. Biochemistry,2001,40(4):1117-1123.
[12] 卓少元,谢金玲.健脾益气方含药血清通过Caspase-3/Vimentin促进人肝癌MHCC-97H 细胞凋亡[J].中国实验方剂学杂志,2016,22(24):161-166.
[13] SILVA K A,DONG J,DONG Y,et al. Inhibition of STAT3 activation suppresses caspase-3 and the ubiquitin-proteasome system,leading to preservation of muscle mass in cancer cachexia[J]. J Biol Chem,2015,290(17):11177- 11187.
[14] 汤浩,高庆剑,陆铖,等.阿魏酸和异阿魏酸对HepG2细胞增殖及其细胞色素P450酶的影响[J].中草藥,2014,45(12):1726-1730.
[15] 朱全杰,段晓明,何蜜,等. HA转hGM-CSF HepG2疫苗对IL-6诱导HepG2细胞EMT的影响及机制[J].湖南师范大学学报(医学版),2016,13(6):4-7.
[16] KIM B,PARK B. Saffron carotenoids inhibit STAT3 activation and promote apoptotic progression in IL-6-stimula- ted liver cancer cells[J]. Oncol Rep,2018,39(4):1883- 1891.
[17] REDELL M S,RUIZ M J,ALONZO T A,et al. STAT3 signaling in acute myeloid leukemia:ligand-dependent and-independent activation and induction of apoptosis by a novel small-molecule STAT3 inhibitor[J]. Blood,2011,117(21):5701-5709.
[18] GOU Z,WANG D,ZHOU L. STAT3 protein expression profile and its clinical significance in hepatocellular carcinoma[J]. J Clin Hepatol,2013,29(7):520-524.
[19] ZHANG X P,JIANG Y B,ZHONG C Q,et al. PRMT1 promoted HCC growth and metastasis in vitro and in vivo via activating the STAT3 signalling pathway [J]. Cell Physiol Biochem,2018,47(4):1643-1654.
[20] XIONG S,WANG R,CHEN Q,et al. Cancer-associated fibroblasts promote stem cell-like properties of hepatocellular carcinoma cells through IL-6/STAT3/Notch signaling
[J]. Am J Cancer Res,2018,8(2):302-316.
(收稿日期:2021-03-01 修回日期:2021-05-19)
(编辑:唐晓莲)

