从提钒固废中回收硫化钠的工艺研究
张士举
攀枝花学院 钒钛学院,四川 攀枝花 617000
引 言
含钒铁水经过预脱硫和转炉吹炼后得到钒渣。钒渣经钠化焙烧—水浸—铵盐沉钒后会产生大量含盐废水,废水经蒸发浓缩后得到结晶淤泥,此结晶淤泥为提钒后的固体废弃物的重要污染来源[1,2]。提钒后的固体废弃物含有硫酸钠、铬和铁等物质,若处理不当,会以扬尘和泥泞水的形式污染地下水及土壤,从而对经济和环境造成巨大的损失[3-5]。
螺纹钢执行新国家标准后致钒价大涨,钒产能激增,而提钒后的固体废弃物回收利用技术滞后,相关研究较少,固体废弃物处理行业发展落后,造成环境污染和资源浪费。提钒后的固体废弃物中含有大量硫酸钠,可采用煤粉还原芒硝法制备成附加值较高的硫化钠。本文运用热力学软件对提钒后的固体废弃物回收硫化钠过程进行了理论计算。试验中研究了还原时间、浸取温度、浸取时间对硫化钠产率和产品中Na2S含量的影响,制备出了满足工业硫化钠国标GB 10500—2009的硫化钠产品,避免了其对环境的污染,创造了经济效益,实现了资源的综合利用。
1 还原芒硝法的热力学计算
提钒后的固体废弃物中主要含有硫酸钠和硫酸铵,采用煤粉还原芒硝法,即通过碳还原硫酸钠制得硫化钠。煅烧过程中发生的反应如下[3]:
Na2SO4+2C=Na2S+2CO2
(1)
Na2SO4+4C=Na2S+4CO(g)
(2)
Na2SO4+4CO(g)=Na2S+4CO2(g)
(3)
在以上反应中主要发生的反应为式(1),除了以上发生的反应以外,还会有 硫酸铵的分解反应和芒硝(Na2SO4·10H2O)结晶水的脱除反应。
(NH4)2SO4=SO(g)+H2O(g)+2NG3(g)
(4)
Na2SO4·10H2O=Na2SO4+10H2O(g)
(5)
运用HSC 6.0软件得到式(1)~式(5)在不同温度下的△G,并由得到的数据做温度与△G关系图,如图1所示。
由图1可知,式(1)在660 K时就开始发生,随着温度的升高反应趋势加剧。当还原温度为700 K时,但试验结果表明,Na2SO4还原温度在700 K时,Na2S产率及产品品位过低,远远不能达到工业硫化钠的要求;通过查阅文献,并结合实际工业生产数据,确定还原温度为1 150 ℃。
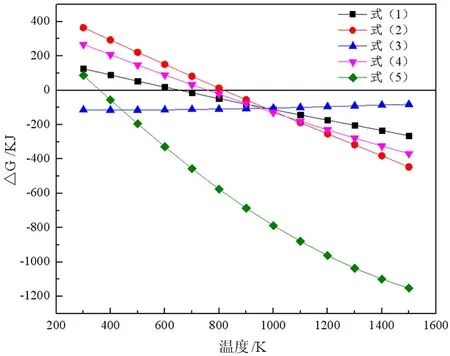
图1 各反应温度与△G之间的关系
在700 K(426.85 ℃)时式(4)反应即开始发生,随着温度的升高反应趋势加剧,为了适当提高硫酸铵的分解反应速度,确定硫酸铵分解温度为500 ℃。
式(5)在360 K(86.85 ℃)时即开始发生,随着温度的升高反应趋势加剧,当反应温度取360 K时Na2SO4·10H2O的分解反应速度缓慢,当反应发生1h时,Na2SO4·10H2O的结晶水未完全脱除;通过查阅文献,并结合实际工业生产数据,确定反应温度为250 ℃。
2 试验
2.1 试验原料
以攀枝花本地提钒后的废水浓缩得到的固体废弃物为原料,其成分如表1所示,主要成分为硫酸钠和硫酸铵等;以工厂用无烟煤为还原剂,固定碳含量为70%。
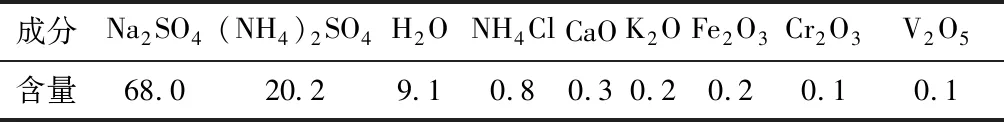
表1 提钒后的固体废弃物主要化学成分 /%
为了保持试验过程中的还原氛围,采用煤粉1.7倍过量的质量比例配加,即每100 g提钒后固体废弃物配加28 g无烟煤粉。
2.2 试验方案
采用FM-1型制样粉碎机,分别将提钒后的固体废弃物和无烟煤磨至-74 μm,按比例称取原料并充分混合,将混合料放入刚玉坩埚置于真空气氛炉中,升温还原煅烧。真空气氛炉内温度在250 ℃保温1 h,开启真空泵抽真空至10-2MPa,抽出反应生成的水蒸气;在500 ℃保温1 h,开启真空泵抽除硫酸铵分解产生的SO3和NH3;在1 150 ℃保温一定时长,此时发生的主要反应为碳还原硫酸钠,生成硫化钠。为探讨还原时间对产品质量和产量的影响规律,分别设定本段煅烧时间为1.5、2、2.5、3、3.5、4、4.5、5和5.5 h。
待整个升温过程结束后,炉体自然冷却到200~300 ℃,将坩埚中样品转移至热水中浸出,浸出热水的温度为70、75、80和85 ℃,浸出时间为4、5、6和7 h。取浸出后的上清液,采用电炉加热至90 ℃恒温浓缩至结晶。
3 试验结果与分析
3.1 还原时间对产品品位和产率的影响
样品在1 150 ℃下还原不同时间,在70 ℃热水中浸出4 h,取上清液浓缩结晶后进行成分分析,并计算回收率,所得试验结果如图2所示。
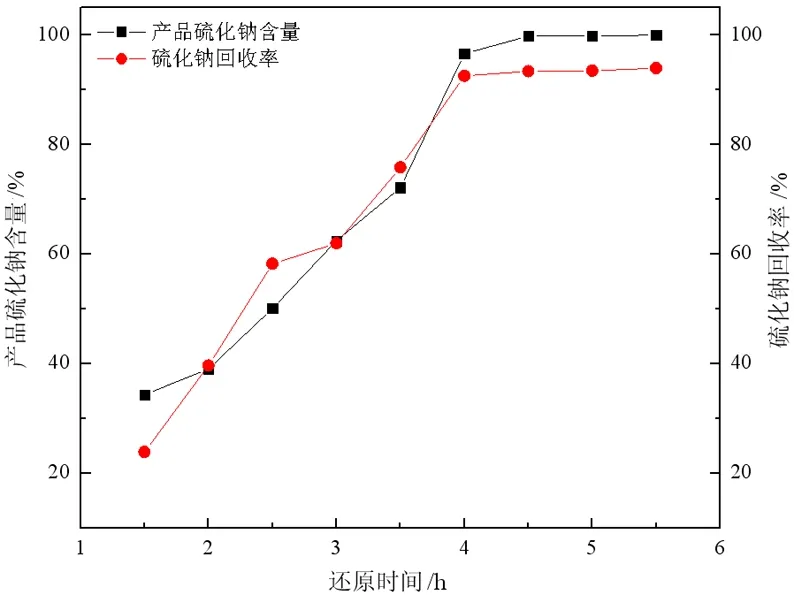
图2 还原时间对产品品位和产率的影响
结果表明,在浸出温度与浸出时间相同的条件下,随还原时间的延长,所得产品中硫化钠品位以及产率均增加,且呈一定相关性。还原时间对试样中Na2S的含量和产率影响较大,随着还原时间的延长,还原反应进行愈加彻底,产品中Na2S含量和产率均会增大;还原时间为4 h时,Na2S的含量达96.61%,产率达92.53%,之后增加还原时间,产品中Na2S含量以及产率增加幅度小;还原时间达4.5 h以上,Na2S的含量达99.81%以上,回收率达93.38%以上。
3.2 浸出时间对产品品位和产率的影响
样品在1 150 ℃下还原4 h,分别在不同温度下浸出不同时间,取上清液浓缩结晶进行成分分析,并计算回收率,所得试验结果如图3和图4所示。
由图3和图4可以看出,在相同的还原时间条件下,硫化钠的回收率和含量随浸出温度与浸出时间的变化趋势呈现相同的规律,随浸出时间的延长,所得产品中硫化钠品位以及产率均增加,且两者增幅均在浸取时间为5~6 h增幅最大,浸取时间达到6 h后两者增幅较小。产品中硫化钠含量与回收率有相同变化趋势是因为随着浸出时间延长,溶于水中硫化钠含量增加,当浸出时间达到6 h时,样品中的硫化钠基本全部溶解,因此若继续延长时间,产率和产品中硫化钠含量几乎不变。
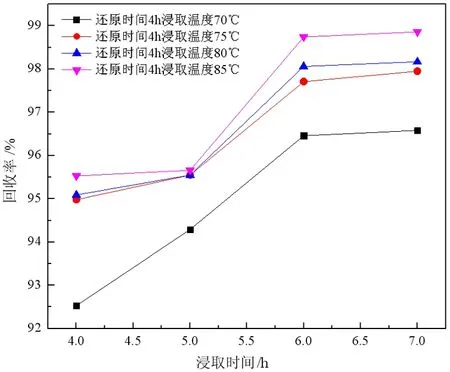
图3 各浸出温度下产率与浸取时间的关系
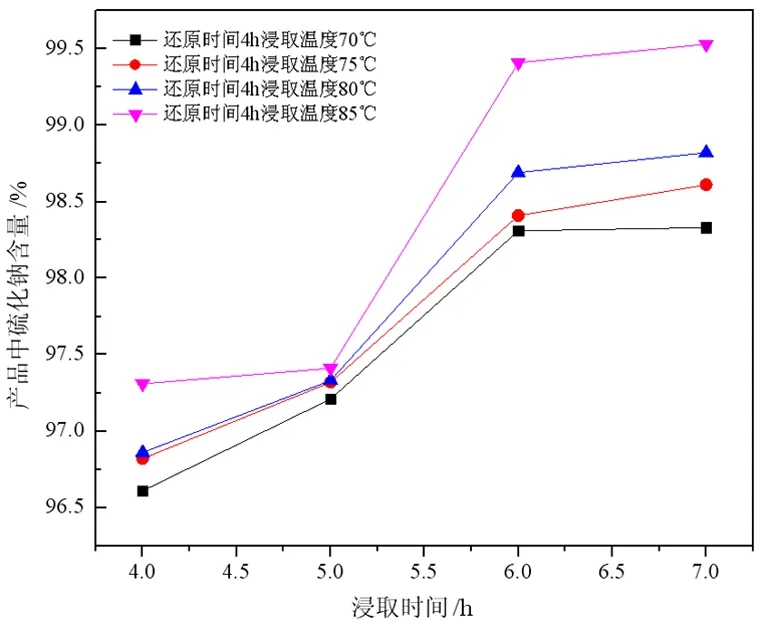
图4 各浸出温度下浸取时间与硫化钠含量的关系
3.3 浸出温度对产品品位和产率的影响
样品在1 150 ℃下还原4 h,分别在不同温度下浸出不同时间,取上清液浓缩结晶进行成分分析,并计算回收率,所得试验结果如图5、6所示。
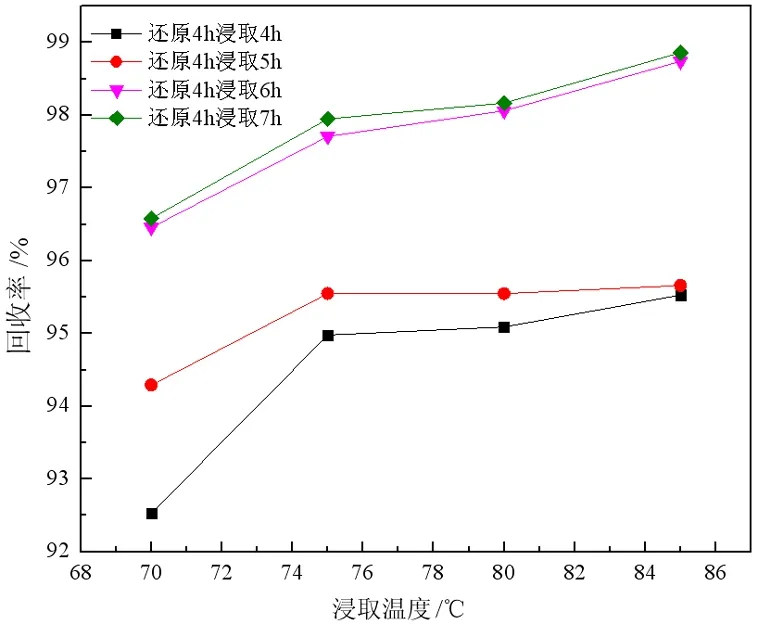
图5 各浸取时间下浸出温度与产率的关系
结果表明,在相同的还原温度和浸出时间的条件下,随浸出温度的升高,产品中硫化钠品位以及产率均增加,变化趋势相似。浸取温度由70 ℃增加至75 ℃时,两者增加较为明显;由75 ℃增加至85 ℃,二者有所升高但相对并不明显,这主要是因为随着浸出温度的增加,硫化钠在水中溶解速度加快,在75 ℃水中浸出6~7 h后样品中硫化钠已基本溶解,再继续升高浸液温度对硫化钠含量以及回收率提升不大,浸出温度为75 ℃较为适宜。
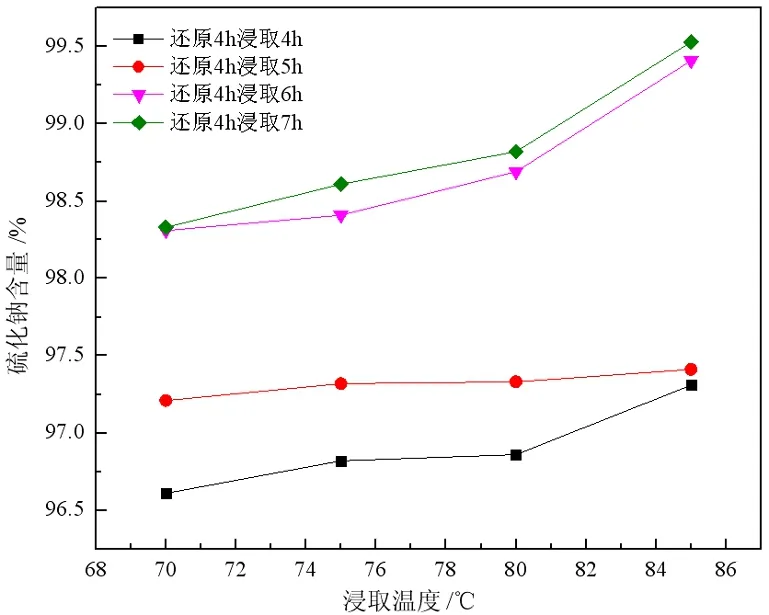
图6 各浸出时间下硫化钠含量与浸取温度的关系
4 结论
采用煤粉还原芒硝法,即通过煅烧—浸出—蒸发结晶实现了从提钒后的固体废弃物中提取硫化钠,最适工艺条件为还原时间4 h、浸取温度75 ℃、浸取时间6 h,此条件下得到的产品硫化钠含量为98.41%,产率可达97.71%,产品为符合工业硫化钠国标GB10500-2009的一类一等品。

