车前草高效再生体系的建立
杨鸿淋,张欣钰,何金玉,邹利娟
(绵阳师范学院生命科学与技术学院,四川绵阳 621006)
0 引言
车前草(PlantagoasiaticaL.)为车前草属多年生草本植物,又名车轮草、猪耳草、牛耳朵草等,具有极高的药用价值和食用价值[1-2].车前草主要含有黄酮类、多糖类、三萜类等化学成分,具有抗菌消炎、消肿利尿、清热明目、凉血解毒、镇咳抗炎等功能,在临床上常用于治疗流行性腮腺炎、尿潴留、慢性活动性肝炎、痛风与细菌性痢疾等[3-4].随着现代药理研究的深入,人们发现车前草所含的多种成分都有抗肿瘤、抗突变、抗氧化和诱导癌细胞分化、增强细胞免疫力等作用[5-6].车前草具有多种化学成分类型和广泛的药理作用[7-8].同时车前草作为可食用性蔬菜,市场需求量极大,人们的过度采挖导致野生车前草资源量骤然下降.
对于车前草组织培养已有报道,李平等以大车前草子叶和叶片诱导再生芽[9];曾建军等以车前草下胚轴和子叶为外植体诱导不定芽[10];王晓旭等以平车前草根颈、叶片和叶柄为外植体,建立了车前草再生体系[11-12],这些数据为本实验提供了重要参考,但不同外植体在含有不同植物生长调节剂的培养基上诱导率和增殖效果也有很大差异.本实验以车前草为对象,以规模化生产为目的,系统探讨植物生长调节剂组合对幼芽和叶片愈伤组织诱导、不定芽分化、增殖及生根培养的影响,筛选出不同阶段的最佳培养基,从而成功建立完整的车前草再生体系.本实验对于保护车前草植物资源、实现可持续利用,研究次生代谢物质生物合成机制、实现工业化生产等,具有一定的参考价值.此外,为利用基因工程对车前草进行遗传改造,培育高活性物质的转基因植株提供了研究基础.
1 材料与方法
1.1 材料准备
车前草种子,2020年9月采于绵阳市磨家镇,经绵阳师范学院罗明华教授鉴定.将收集的车前草种子播种于实验室营养土中,待植株长至4~6叶片时取其幼芽作为外植体,用75%酒精消毒30 s,再用10%NaClO灭菌6~8 min,无菌水洗涤3~5次,无菌滤纸沥干水分后备用.
1.2 实验方法
从生芽诱导:幼芽接种于含有生长素NAA(萘乙酸),细胞分裂素KT(激动素)和TDZ(噻苯隆)的培养基上进行培养.20 d后统计幼芽诱导丛生芽情况.
愈伤组织及不定芽诱导:待接种后的幼芽有新的叶片长出,将无菌叶片剪为0.5 cm×0.5 cm大小,进行叶片愈伤组织诱导,愈伤组织经过增殖培养后进行不定芽分化.叶片接种15 d后统计愈伤诱导率,第35天后统计不定芽诱导状况.
再生芽增殖:将获得的再生芽转接至TDZ2.0 mg/L培养基上进行芽的生长增殖.
生根及移栽:获得的再生芽转移至添加IAA(吲哚乙酸)、NAA和ZT(玉米素)的培养基上诱导生根.生根培养3周后进行驯化移栽.
以上实验重复3次.
1.3 基本培养基及培养条件
供试培养基均为MS培养基添加3%蔗糖和0.6%琼脂,pH5.8±0.2并于121 ℃灭菌20 min.培养条件为:温度(25±2)℃,光照时间12 h/d,光照强度3 000 lx.
2 结果与分析
2.1 丛生芽的诱导(幼芽)
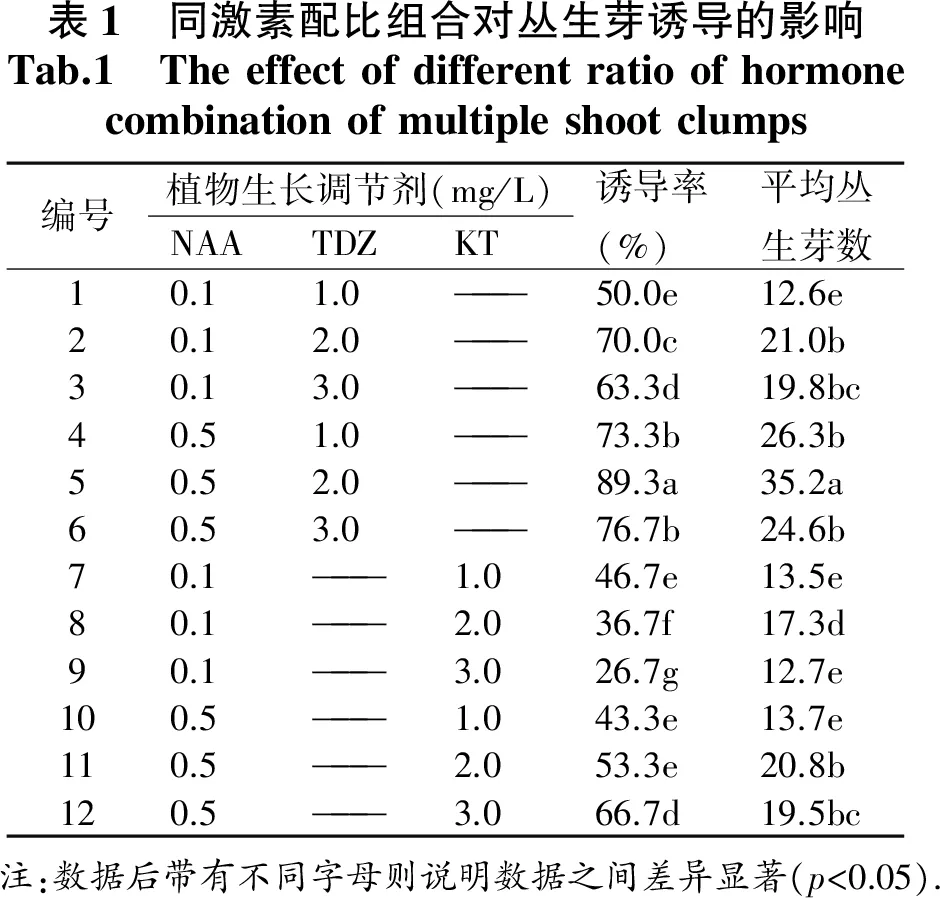
车前草幼芽(图1)接种在供试的12种培养基上,统计结果见表1,供试的12种培养基均可诱导车前草丛生芽的产生,但诱导率和每个外植体产生的丛生芽个数存在很大的差异.幼芽诱导丛生芽生长过程记录如下:接种15 d左右,幼芽基部开始膨大;约20 d,芽体基部产生大量绿色致密愈伤组织(图1-B1),此时统计诱导率;在原培养基上继续转接,35 d左右愈伤组织分化出绿色小芽体(图2-B2),基部愈伤部分褐化;45 d后芽体不断分化增长(图2-B3),此时由于愈伤团较大,吸收营养有限,可以切割成小团,分别接种在原培养基培养,60 d后发育成健壮的无菌苗(图2-B4).

12种处理中,1-6号培养基使用生长素NAA和细胞分裂素TDZ,7-12号培养基使用生长素NAA和细胞分裂素KT,数据分析分析得出:无论是诱导率还是产生的丛生芽个数,NAA配比TDZ的使用效果要比NAA和KT组合的使用效果好.其中5号培养基诱导率达89.3%,诱导产生的丛生芽不仅数量多,而且长势最好,叶片大而深绿,平均芽达到35.2个,和其他处理均存在显著差异.因此,丛生芽的最佳培养基为MS+NAA0.5 mg/L+TDZ2.0 mg/L,TDZ作为细胞分裂素更适合车前草诱导丛生芽的产生.
2.2 不定芽的诱导和增殖培养(叶片)
车前草幼芽(图1-B)接种于培养基MS+NAA0.5 mg/L+6-BA1.0 mg/L上,幼芽不断伸长生长叶片伸展,15 d左右可获得大量无菌叶片,将叶片切割成0.5 cm×0.5 cm大小,进行叶片愈伤组织及不定芽诱导.叶片诱导愈伤及分化过程记录如下:接种7 d叶片卷曲膨大;15 d后叶片切口处出现少量愈伤组织(图1-A1),切口处有褐化;约24 d,切口处愈伤组织分化不定芽(图2-A2);不定芽增殖分化,将不定芽切割成芽从在原培养基上继续培养32 d(图2-A3);60 d后芽长成可见健壮芽从(图2-A4).

由表2可知,12种处理中,均可诱导叶片产生愈伤组织.IAA+ZT培养基与IAA+TDZ培养基的诱导效果(愈伤诱导率和不定芽平均个数)存在显著差异.其中11号培养基愈伤组织诱导率达91.7%,不定芽分化率为61.2%,每个外植体产生的不定芽平均数为14.2个,与其他处理均存在显著差异.因此,叶片愈伤组织及分化的最佳培养基为MS+IAA0.5 mg/L+TDZ2.0 mg/L,细胞分裂素TDZ更适合车前草叶片诱导及分化.叶片愈伤组织继代可添加AgNO3500 mg/L,有效防止褐化和提高不定芽分化.
将获得的不定芽切割成含2~4个芽的芽从,转接到含有TDZ(1.0、2.0、3.0 mg/L)和AgNO3500 mg/L培养基上进行继代增殖培养(表3),无菌苗长势良好(图3-ABC),褐化现象得到缓解.在2.0 mg/L的TDZ培养基上,再生芽的增殖系数达7.2,与其他处理存在显著差异.


图3 不定芽增殖及生根培养Fig.3 Adventitious bud proliferation and rooting cultureA-TDZ1.0 mg/L +AgNO3500 mg/L不定芽增殖;B-TDZ3.0 mg/L +AgNO3500 mg/L不定芽增殖;C-TDZ2.0 mg/L +AgNO3500 mg/L不定芽增殖;D-生根培养
2.3 生根培养
将生长健壮的丛生芽或不定芽切割成单芽接种到生根培养基中,每种处理接种15个单芽.培养28 d后的统计结果见表4.由表可见,车前草生根较容易,生根培养15 d后,各组培养基中的芽均开始有根长出,但由于各组培养基的激素组合和配比不同,生长状况也各有差异.各培养基之间平均根长和诱导率差别不大,1号和2号仅添加了生长素NAA,但生根状况不佳,不仅根少,而且苗生长状况不好,部分泛黄;3号和4号仅添加了生长素IAA,虽然根较多,但主要为须根,主根不明显,苗的长势较好;5号添加了生长素IAA和细胞分裂素ZT,平均根长、生根条数及诱导率均高于其他处理,有生长粗壮明显的绿色主根,且苗的长势良好(图3-D).综合比较,车前草生根最佳培养基为MS+IAA1.0 mg/L+ZT2.0 mg/L,在此培养基上,生根诱导率100%,平均根长7.9 cm,平均根数30条.组培苗经驯化移栽后成活率可达100%.

表4 不同激素配比组合对生根诱导的影响Tab.4 The effect of different assemblage with hormone concentration on rooting induction
3 讨论
3.1 TDZ对不定芽、丛生芽诱导和增殖培养的影响
车前草属的组织培养的文献中,多以下胚轴直接诱导丛生芽,子叶、叶片、叶柄与根颈先经愈伤组织再分化不定芽,但愈伤组织分化率和分化成芽数较低,分化率为25%,平均每块愈伤产生2.8个芽[9-12].本实验中叶片经愈伤组织在MS+IAA0.5 mg/L+TDZ2.0 mg/L培养基上分化率可达61.2%,诱导产生的不定芽平均数为14.2个.这可能与使用的植物生长调节剂不同,TDZ作为类似细胞分裂素在芽的诱导和植株再生方面具有较强的活性,能够诱导多种植物产生直接不定芽,并在众多的工作中得到了证实[13-14].本研究在进行丛生芽、不定芽的诱导过程中,生长素IAA和细胞分裂素TDZ或KT的不同组合中,TDZ的效果比KT的效果更好.且较高浓度细胞分裂素利于芽的形成,但是细胞分裂素的浓度也不宜过高,在诱导不定芽、丛生芽的12种培养基组合中(表1和表2),4-6号随编号的增大TDZ的浓度也逐渐增大,但对芽诱导效果却并未逐渐增强,6号的效果反而比5号差.因此,本研究中诱导丛生芽的TDZ的最佳浓度为2.0 mg/L,即诱导产生丛生芽的最佳培养基为5号培养基MS+(IAA0.5+TDZ2.0)mg/L,诱导产生的丛生芽健壮,叶片硕大且颜色深绿;诱导不定芽的TDZ最佳浓度为2.0 mg/L,诱导不定芽的最佳培养基为MS+(IAA1.0+TDZ2.0)mg/L,诱导产生的不定芽长势最好.本实验建立的车前草再生体系,可以满足大规模市场化的生产,并为利用基因工程对车前草进行遗传改造及种质资源保护提供了理论参考.
3.2 实验中玻璃化现象
玻璃化是指植物在组织培养过程中发生的一种形态和生理紊乱,由于水分摄入过多,导致叶片呈半透明、肿胀、卷曲、易碎的状态.产生玻璃化现象与外植体状态、通风条件、温度、光照以及培养基成分等因素有关[15-16].本实验在叶片分化不定芽培养过程中,出现了部分玻璃化现象(图2-A3).研究证明,通过增加植物的抗氧化作用或消除过氧化物及活性氧自由基可有效减少组培苗的玻璃化[16].本实验中在叶片愈伤组织继代及芽从增殖培养基中分别加入500 mg/LAgNO3和500 mg/L抗坏血酸后,结果发现,在加入500 mg/LAgNO3的培养基中明显缓解组培苗玻璃化现象.

