胃癌切除术后Petersen疝的临床特征分析
柳万忠
(绵阳市中心医院 普外科,四川 绵阳 621000)
胃癌在我国的发病率仅次于肺癌,居第2位,病死率居第3位[1]。胃癌的治疗是以外科为主的综合治疗。胃癌切除术后消化道重建的方式常常采用Billroth-Ⅱ式、Roux-en-Y吻合等,会引起解剖结构的异常,从而形成异常的裂孔、缺损,腹腔内器官和组织疝入后容易形成Petersen疝。Petersen疝是胃癌切除术后少见的并发症,但其起病急骤,病情进展快,若不及时有效诊治容易引起肠绞窄坏死、肠穿孔甚至脓毒症休克而导致死亡。Petersen疝临床表现缺乏特异性,术前诊断较困难,易延误诊治。有关Petersen疝的诊治国内外报道相对较少。早期诊断、及时进行外科手术是治疗成功的关键。本研究对10例胃癌切除术后Petersen疝患者的临床资料进行分析,以期为胃癌术后Petersen疝的临床诊断和治疗提供参考。
1 资料与方法
1.1 一般资料回顾性分析2013年1月至2020年4月绵阳市中心医院普外科收治的10例胃癌切除术后Petersen疝患者的临床资料,见表1。10例患者中,初次手术为全胃癌根治性切除2例,初次手术为远端胃癌根治性切除8例;接受食管空肠Roux-en-Y吻合2例,接受胃空肠Roux-en-Y吻合2例,接受胃空肠毕-Ⅱ式吻合6例,Roux-en-Y吻合均采用结肠前吻合方式;开腹手术切除8例,腹腔镜手术切除2例。患者均为男性,年龄35~71岁,中位年龄55岁。发生Petersen疝距原胃癌手术时间间隔为20 d~7 a,中位时间36.3个月。本研究通过绵阳市中心医院医学伦理委员会审核批准,批号为p2020049。
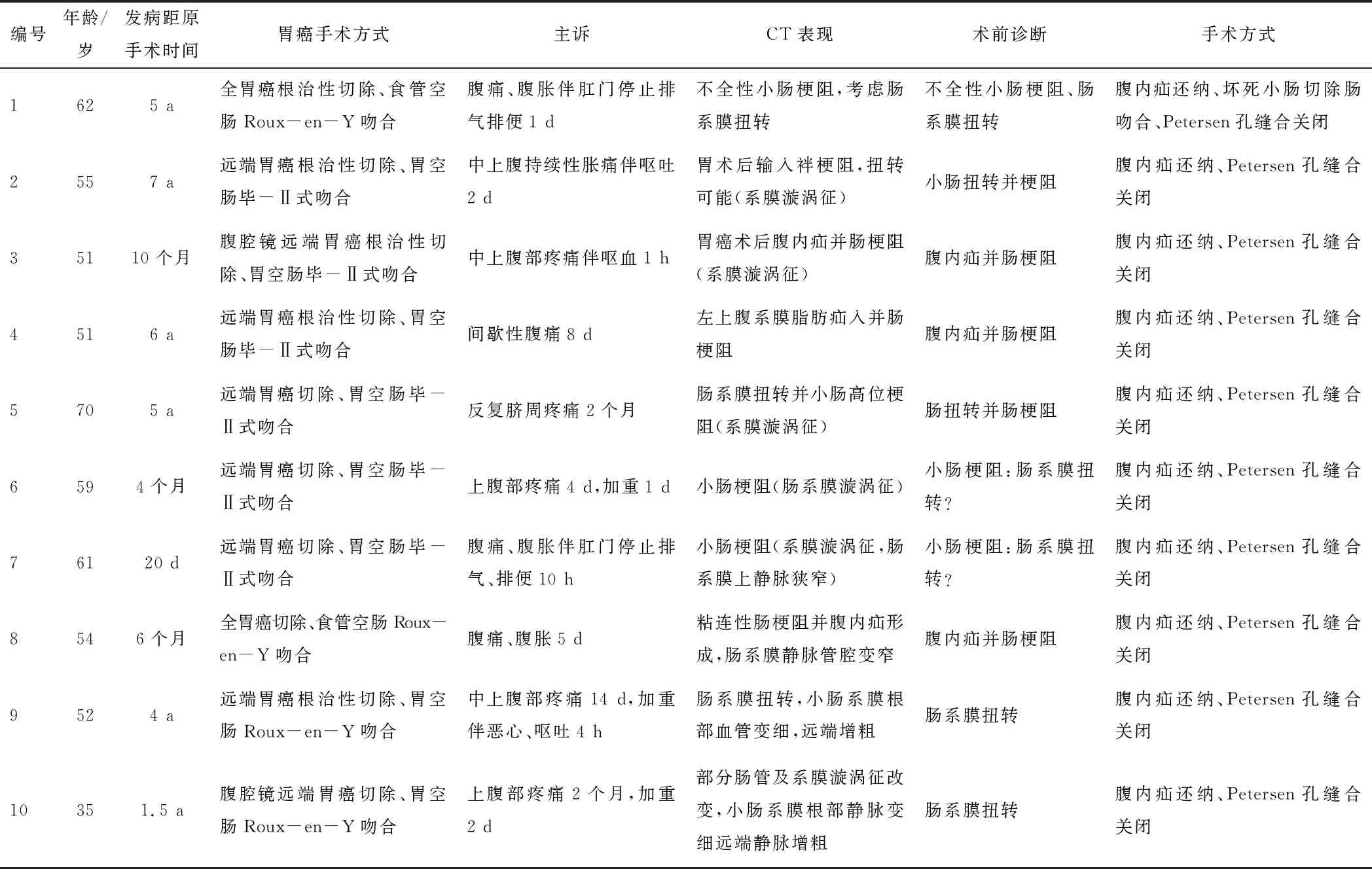
表1 胃癌术后Petersen疝患者的临床资料
1.2 治疗方法所有患者完善相关检查,根据病情严重程度选择保守治疗或经腹探查手术治疗。保守治疗效果差需及时行经腹手术探查治疗。根据病情选择开腹手术或腹腔镜手术。根据术中探查结果,行腹内疝复位、Petersen孔缝合关闭手术,若合并肠坏死需行肠切除、肠吻合术。
2 结果
2.1 临床表现10例患者均以腹部疼痛为主要临床表现,入院前腹痛症状持续1 h到2个月,中位时长4.5 d;疼痛程度轻重不一,其中腹痛程度较剧烈6例,腹痛间断性反复发作4例;合并恶心、呕吐、腹胀等肠梗阻症状8例。所有患者均有不同程度的腹部压痛,其中伴腹部压痛、反跳痛及腹肌紧张的腹膜炎体征1例。10例患者胃癌切除术后体质量指数(body mass index,BMI)均下降2.3~5.1 kg·m-2,中位下降3.5 kg·m-2。
2.2 辅助检查10例患者白细胞水平均升高[绵阳市中心医院正常参考值为(3.5~9.5)×109L-1],白细胞水平(11.3~17.6)×109L-1,中位水平13.7×109L-1。10例患者全血C反应蛋白均升高[正常参考值为(0~10)mg·L-1],C反应蛋白水平15.1~28.4 mg·L-1,中位水平为21.6 mg·L-1。10例患者均接受全腹部螺旋增强CT检查,其中肠系膜扭转伴有小肠梗阻征象6例,腹内疝伴小肠梗阻征象2例,肠系膜扭转(见图1 A)未合并肠梗阻2例。术前CT提示肠系膜上静脉回流受阻征象4例,见图1 B。

注:图1A为肠系膜血管漩涡征(箭头处);图1B为肠系膜上静脉鸟嘴征(箭头处)。
2.3 术前诊断及治疗措施所有患者入院后均接受禁食水、胃肠降压、维持水电解质平衡及抗感染等治疗,合并肠梗阻患者接受生长抑素治疗,并积极完善术前准备。术前10例患者均未能明确诊断为Petersen疝,其中诊断为肠系膜扭转伴小肠梗阻6例,诊断为腹内疝伴小肠梗阻2例,诊断为肠系膜扭转2例。10例患者均行手术治疗,6例患者因症状较重于入院后急诊接受开腹手术治疗。3例患者经保守治疗后病情不缓解安排开腹手术治疗;1例患者经保守治疗后腹痛缓解,但因之前反复腹痛2月,安排腹腔镜手术治疗。术中探查发现肠坏死1例,肠缺血改变5例,腹内疝还纳后肠管血运恢复正常,未见明确肠坏死。术中探查发现有乳糜样腹水1例,腹内疝还纳术后腹腔引流液未再呈乳糜样。10例患者术中均明确诊断为Petersen孔疝,其中接受腹内疝复位、缝合关闭Petersen孔9例,1例因小肠坏死行腹内疝复位、小肠部分切除吻合、缝合关闭Petersen孔。10例患者均治愈出院。
3 讨论
Walther Petersen于1900年首次报道了1例胃空肠吻合术后发生腹内疝患者,疝即发生于上提的空肠和横结肠之间的系膜间隙,后来这个系膜间隙被命名为Petersen间隙,这一类腹内疝被称命名为Petersen疝[2]。之后也有研究报道了这一类的腹内疝[3-4]。Kang[5]在研究中报道,胃癌切除术后Petersen疝的发病率为0.42%。Petersen疝发病率低,对胃癌切除术后Petersen疝的研究较少,但它是胃癌术后一种严重的并发症。本研究分析了胃癌切除术后Petersen疝的临床特征,为临床诊治提供参考。
相比开腹手术,腹腔镜胃癌切除手术后腹内疝的发病率升高[6],可能与接受腹腔镜手术后患者的腹腔粘连相对较轻有关,肠蠕动或活动后更容易引起小肠疝入Petersen间隙。本研究仅有2例患者腹腔镜手术切除术后出现Petersen疝,考虑可能与近年来绵阳市中心医院腹腔镜胃癌手术中常规关闭Petersen间隙后Petersen疝发病率降低有关。本研究结果显示,术后所有患者BMI均下降,提示胃癌切除术后BMI下降是Petersen疝发生的一个潜在因素,与文献报道一致[6]。由于体质量减轻,肠系膜脂肪组织减少可使Petersen间隙增大,增加了Petersen疝的发生风险。有研究报道,胃癌切除术后腹内疝的发病率男性高于女性[6]。李沣员等[7]的研究显示,胃癌切除术后90%的Petersen疝患者为男性。本研究中所有患者均为男性,这与文献报道相似[7],提示男性为Petersen疝发生的一个潜在因素。考虑可能和男女患者体脂分布状态有关,男性的体脂主要分布于腹腔,男性胃癌切除术后肠系膜脂肪减少,引起Petersen间隙增大,容易出现Petersen疝。本研究有2例患者有发病前饱餐后运动史,1例患者有腹痛症状出现前腹泻史,提示胃癌切除术后Petersen疝的形成可能与肠道功能紊乱有关,与文献报道一致[8],可能是由于餐后剧烈运动、暴饮暴食、腹泻等肠道功能紊乱导致肠道活动失去正常规律,小肠易疝入腹腔间隙所致。
本研究所有患者入院前腹痛症状持续1 h到2个月不等,中位时间4.5 d,提示Petersen疝病程长短不一,既有急性发作,又有反复发作。其中腹痛程度较剧烈6例,腹痛间断性反复发作4例,提示腹痛程度不一,考虑腹痛的严重程度可能与疝入Petersen疝的小肠和小肠系膜的卡压程度以及肠系膜扭转程度有关。肠系膜扭转轻者表现为肠系膜上静脉回流受阻,引起类似慢性肠系膜上静脉栓塞综合征表现,重者表现为小肠血运障碍,部分患者可出现症状与体征不符的腹痛,延误诊治进而引起肠坏死等情况。10例患者中合并恶心、呕吐、腹胀等肠梗阻症状8例,提示肠梗阻为Petersen疝的主要临床表现,与文献报道一致[9]。所有患者腹部均有不同程度的压痛,有1例伴有腹膜炎体征,该患者术中探查证实伴有肠坏死,提示若Petersen疝患者合并腹膜炎体征应警惕肠坏死。所有患者白细胞及C反应蛋白水平均升高,提示白细胞及C反应蛋白水平升高可作为Petersen疝患者诊断的实验室参考依据,与文献报道一致[10]。亦有报道肠梗阻合并乳糜腹水的临床表现[11]。本研究有1例患者术中探查发现乳糜样腹水,腹内疝还纳术后腹腔引流液未再呈乳糜样,考虑是由于Petersen疝导致疝入的小肠系膜受压,淋巴回流受阻所致。
腹部增强CT检查是诊断腹内疝首选的影像学检查[12-13]。腹部CT可见小肠梗阻、肠系膜扭转“漩涡征”、肠系膜上静脉或小肠的鸟嘴征、小肠聚集、肠系膜血管疝口处聚集、肠系膜肿胀、钩状小肠征[14](指在原手术中上提的空肠系膜血管内侧有两个或多个小肠通过)等。术前CT提示有4例患者存在肠系膜上静脉回流受阻征象,考虑是由于肠系膜血管受Petersen疝囊颈的卡压所致。肠系膜扭转和小肠梗阻的诊断腹内疝的敏感度为96%,特异度为87%[13]。CT显示肠系膜扭转伴有小肠梗阻征象者6例,腹内疝伴小肠梗阻征象者2例,肠系膜扭转未合并肠梗阻者2例,与文献报道相近[14]。本研究所有患者术前均未明确诊断为Petersen疝,提示腹部CT检查对腹内疝诊断有较高的敏感性及特异性,但术前影像学明确诊断Petersen疝困难,考虑受既往胃癌手术的影响,腹腔内解剖结构变化较大,CT检查难以明确诊断为Petersen疝。若胃癌术后患者腹部CT出现腹内疝或肠系膜扭转合并小肠梗阻征象,则高度提示Petersen疝。
本研究10例患者均接受手术治疗,术中探查发现肠坏死1例,肠缺血改变5例,提示Petersen疝患者常合并肠缺血、肠坏死,考虑是由于小肠系膜血管受疝囊颈部卡压引起小肠缺血所致,若不能及时诊断并进行手术,容易出现肠坏死,与Han WH等[15]报道一致。因Petersen疝患者常合并肠缺血、肠坏死等情况,需高度重视,一旦诊断考虑Petersen疝,均需手术治疗。症状轻者可考虑短暂保守治疗后评估疗效,若病情缓解,可择期行手术探查,若病情不缓解甚至加重则需立即安排手术治疗;若症状较重,应尽早手术探查。若症状轻且未合并肠梗阻可考虑行腹腔镜探查手术;如症状重或合并肠梗阻宜选择开腹手术探查。腹内疝还纳后,若发现肠坏死,需行肠坏死切除、肠吻合,必要时可行肠造口,并使用不可吸收缝线缝合关闭Petersen间隙;若术中观察肠管无明显坏死,则使用不可吸收缝线缝合关闭Petersen间隙。本研究中,术中探查发现肠坏死1例,肠缺血改变5例,腹内疝还纳后肠管血运恢复正常,未见明确肠坏死,故早期诊断并及时进行外科手术可避免肠坏死,是治疗成功的关键,可提高患者的救治成功率。本研究中1例患者因肠坏死接受肠坏死切除、肠吻合、缝合关闭Petersen间隙手术;其余9例无肠坏死,还纳肠管后缝合关闭Petersen间隙,均治愈出院,提示及时手术可减少肠坏死的发生,与文献报道一致[10]。
对于胃癌切除术后Petersen疝的处理除早诊断、早治疗外,还要重视预防。预防的措施:(1)尽管国内外指南针对Petersen间隙无相关处理意见,若技术条件允许,可考虑手术中常规使用不可吸收缝线关闭Petersen间隙;(2)根据手术规范,明确适宜的胃切除范围和输入袢长度;(3)术后注意肠内营养支持,尤其是化疗期间,避免营养不良引起的体质量下降;(4)术后避免出现胃肠道功能紊乱。
综上所述,胃癌切除术后Petersen疝是一种少见的并发症。胃癌切除术后Petersen疝患者的病程长短不一,临床表现轻重不一,好发于男性,常伴有胃癌术后BMI下降。肠梗阻为Petersen疝的主要临床表现,其主要症状为腹痛,可伴有恶心、呕吐、腹胀。轻者可表现为间断性腹痛,可自行缓解,部分患者进食后腹痛加重;重者表现为腹部阵发性绞痛、腹胀,伴恶心、呕吐、肛门停止排气、停止排便等肠梗阻症状;寒战、高热、腹膜炎、休克等肠坏死表现[16-17],甚至引起死亡。常伴有白细胞及C反应蛋白水平的升高。Petersen疝临床表现缺乏特异性,临床诊断困难,常合并肠缺血、肠坏死,延误诊治可能出现肠坏死、休克,甚至死亡。故有胃癌切除术病史的患者出现肠梗阻,尤其是男性患者,需尽早完善腹部CT检查,若腹部CT检查提示腹内疝或肠系膜扭转伴小肠梗阻,则高度怀疑Petersen疝。早诊断并及时进行外科手术是治疗成功的关键,可避免严重并发症的发生。若采取相应的预防措施,可预防Petersen疝的发生。

