载脂蛋白E基因多态性与房性心律失常的关系
聂娣 娄焕堃 邢团结 梅佳慧 王勋 李鹏 王飞翔 汪明琅 王怡练
1 连云港市灌云县人民医院心血管内科(江苏灌云222202);2连云港市第二人民医院心血管内科(江苏连云港222006)
房性心律失常在临床上较常见,包括房性期前收缩、房性心动过速、心房扑动和心房颤动。先天遗传、后天生活环境及生活方式等诸多因素都是房性心律失常的病因。年龄、吸烟、高血压、血脂异常、动脉粥样硬化、肥胖及多种心血管疾病[1]导致的心脏电重构和心肌重构等一直以来被认为是房性心律失常重要的发病机制。过度的氧化应激和全身性炎症是房性心律失常发生和维持的重要机制,二者会在很大程度上加重血管内皮损伤、使心肌纤维化发生或进展,心肌细胞受到损伤,进而出现心房增大,最终导致心脏的结构重构、电重构。
载脂蛋白E(ApoE)是SHORE[2]最先发现的一种由299 个氨基酸组成的糖蛋白,是血浆中的一种特殊的多态性脂蛋白,主要参与体内脂蛋白的转运、储存、利用及排泄。ApoE 基因型可分为三大种类:ε2/ε2、ε2/ε3 被称为保护类基因型;ε2/ε4、ε3/ε3 更为多见,称为大众类基因型;含有ε4 等位基因的ε3/ε4、ε4/ε4 称为风险类基因型;分别对应ApoE2、ApoE3、ApoE4 三种基因表型,与多种疾病有关[3]。
研究表明,ApoE 具有调节炎症介质分泌及抵抗氧化应激的作用,HAYEK 等[4]最先发现ApoE 具有抗氧化、抗炎作用,且ApoE 不同等位基因抗炎能力大小不同[5]。
正是基于ApoE 与上述机制存在关联,因此本研究推测ApoE 基因多态性对房性心律失常的发生发展有重要影响。本研究通过分析ApoE 基因多态性与房性心律失常的相关性,进一步探讨ApoE 基因对房性心律失常的影响。
1 资料与方法
1.1 研究对象
1.1.1 临床病例 选取2019年1月至2020年6月在连云港市灌云县人民医院、连云港市第二人民医院心血管内科就诊的(房早35 例、房速15 例、房扑20 例、房颤50 例)共120 例患者为房性心律失常组及同期门诊健康志愿者(窦性心律)120 例为对照组,其中房性心律失常组男63 例,女57 例,平均(74.57±8.12)岁;对照组男59 例,女61 例,平均(65.67±12.46)岁。
1.1.2 入选标准 依据明确的心电图或动态心电图资料结合临床症状和病史确诊房性心律失常者;有完整的病历资料和血标本;所有入选病例均签署知情同意书。房性早搏>100 次/24 h 或伴多源房早、成对、呈联律;房性心动过速简称为房速,短阵自限性不纳入本研究;心房颤动诊断标准参考中华医学会心电生理和起搏分会、中国医师协会心律学专业委员会心房颤动防治专家工作委员会制定的《心房颤动:目前的认识和治疗建议(2018)》。
1.1.3 排除标准 左心功能不全、肺源性心脏病、风湿性心脏病、扩张型心肌病、肥厚型心肌病、病毒性心肌炎、既往心脏手术史、继发性高血压、甲亢、电解质紊乱、恶性肿瘤、肝肾功能不全等疾病;严重感染、结核、代谢综合征;无知情同意书。
1.2 临床资料
1.2.1 一般资料年龄、性别、身高、体质量、体质量指数(BMI)、吸烟史、高血压病史、糖尿病病史;
1.2.2 心脏超声 左心房内径及左心室射血分数等参数由超声科特定人选完成测定。
1.3 方法
1.3.1 主要试剂与仪器 扩增用PCR 仪、基因芯片阅读仪(深圳亚能生物技术有限公司)、金属预洗脱仪、细胞超净台、离心机、ApoE 基因组DNA 检测试剂盒(达安基因股份有限公司)。
1.3.2 基因组DNA 提取 采集受检者清晨空腹外周静脉血2 mL,乙二胺四乙酸二钾(EDTA)抗凝,存于4 ℃冰箱,2 d 内提取DNA。严格按照试剂盒说明书步骤提取人全基因组DNA。
1.3.3 PCR 扩增 对所需基因片段进行PCR 扩增PCR 扩增所需引物序列:F5,⁃AACAACT⁃GACCCCGGTGGCG⁃3,R5,⁃ATGGCGCTGAGGCC⁃GCGCTC⁃3;按照以下进行操作PCR 扩增:在50、95、94、65 ℃条件下分别维持2 min、15 min、30 s、45 s,并循环操作45 次;密封保存备用。
1.3.4 基因组DNA 检测 将在冰上保存的PCR扩增产物取出10 μL,向其中加入60 μL 的直用型杂交液并混匀;去除ApoE 检测芯片保护膜,将混合液加入检测芯片对应孔,混合液需覆盖至检测芯片表面;最后用芯片阅读仪对检测芯片判读。
1.4 统计学方法 采用SPSS 21.0 软件进行医学统计分析。计量资料采用均数± 标准差表示,比较采用两独立样本t检验;计数资料比较采用χ2检验;将有无房性心律失常作为因变量,与房性心律失常发生有关的单因素作为协变量,采用二元lo⁃gistic 回归进行多因素分析;P<0.05 为差异有统计学意义。
2 结果
2.1 房性心律失常组与对照组一般资料比较 两组在性别、身高、体质量、BMI、吸烟、2 型糖尿病病史方面比较差异无统计学意义(P>0.05),在年龄、高血压病病史、LAD、LVEF 方面差异有统计学意义(P<0.05)。见表1。
表1 房性心律失常组与对照组一般资料比较Tab.1 Comparison of general data between atrial arrhythmia group and control group ±s
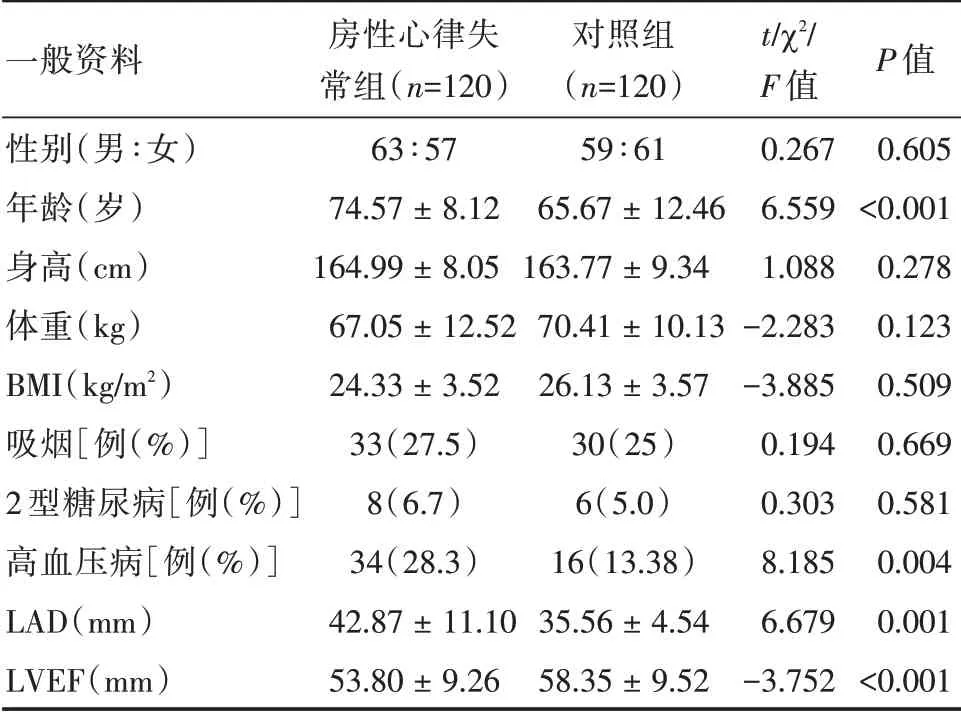
表1 房性心律失常组与对照组一般资料比较Tab.1 Comparison of general data between atrial arrhythmia group and control group ±s
注:BMI,体质量指数;LAD,左心房内径;LVEF,左心室射血分数
一般资料性别(男∶女)年龄(岁)身高(cm)体重(kg)BMI(kg/m2)吸烟[例(%)]2 型糖尿病[例(%)]高血压病[例(%)]LAD(mm)LVEF(mm)房性心律失常组(n=120)63∶57 74.57±8.12 164.99±8.05 67.05±12.52 24.33±3.52 33(27.5)8(6.7)34(28.3)42.87±11.10 53.80±9.26对照组(n=120)59∶61 65.67±12.46 163.77±9.34 70.41±10.13 26.13±3.57 30(25)6(5.0)16(13.38)35.56±4.54 58.35±9.52 t/χ2/F 值0.267 6.559 1.088-2.283-3.885 0.194 0.303 8.185 6.679-3.752 P 值0.605<0.001 0.278 0.123 0.509 0.669 0.581 0.004 0.001<0.001
2.2 ApoE 基因多态性分析 经检验两组ApoE 的基因型均符合Hardy⁃Weinberg 遗传平衡定律,说明所收集的两组资料都较为可靠,具有良好的群体代表性。房性心律失常组较对照组ε3/ε3 基因型明显减少,ε3/ε4 和ε4/ε4 基因型明显增多,差异有统计学意义(P<0.05)。见表2。
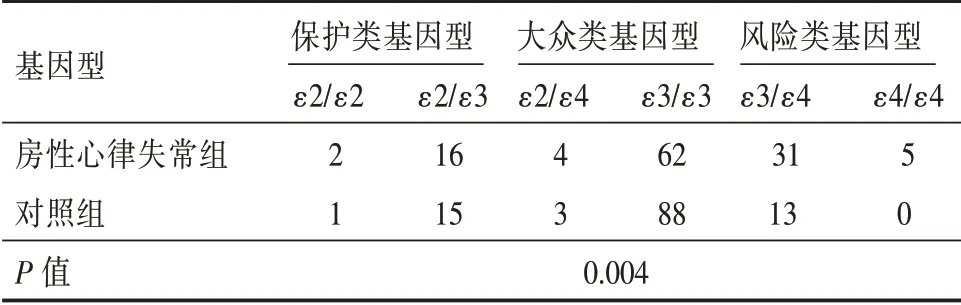
表2 两组ApoE 基因多态性分布结果Tab.2 Distribution of ApoE gene polymorphism in two groups例
2.3 两组ApoE 基因表型分布 房性心律失常组与对照组ApoE2 型分布差异无统计学意义(P>0.05),两组均以ApoE3 型为主,但房性心律失常组ApoE3 型表达较对照组明显减少,ApoE4 型表达较对照组明显增多,差异有统计学意义(P<0.05,表3);房颤组和其他房性心律失常组基因表型分布对比,房颤组ApoE2 型比例明显偏少,ApoE4 型比例明显增多(P<0.05,表4)。
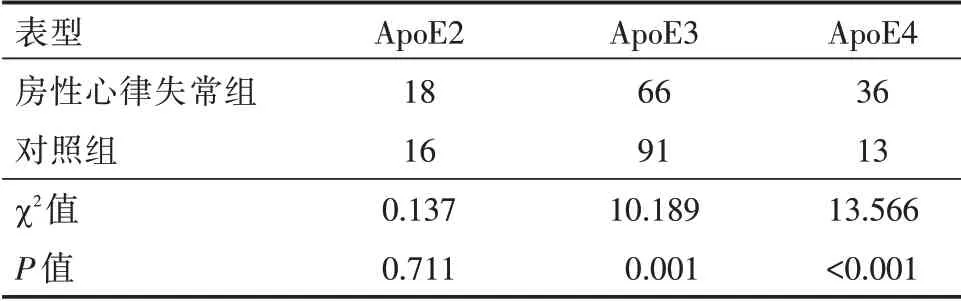
表3 两组ApoE 基因表型分布Tab.3 Phenotype of ApoE gene in two groups例
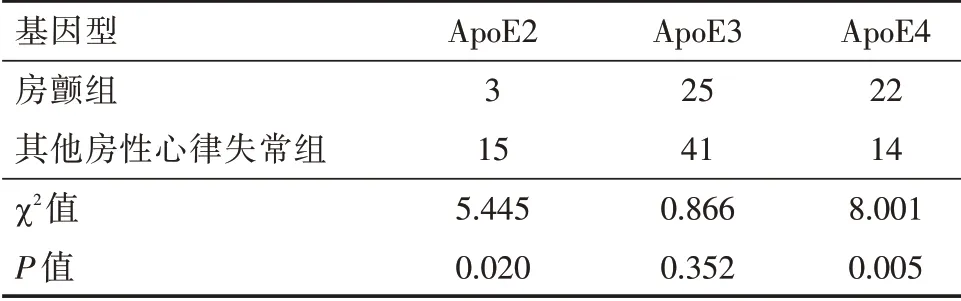
表4 房性心律失常组ApoE 基因表型分布Tab.4 Phenotype of ApoE gene in atrial arrhythmias groups例
2.4 房性心律失常发生相关因素的回归分析 分析表明年龄、LAD、LVEF、ApoEε4 为房颤发生的独立危险因素。
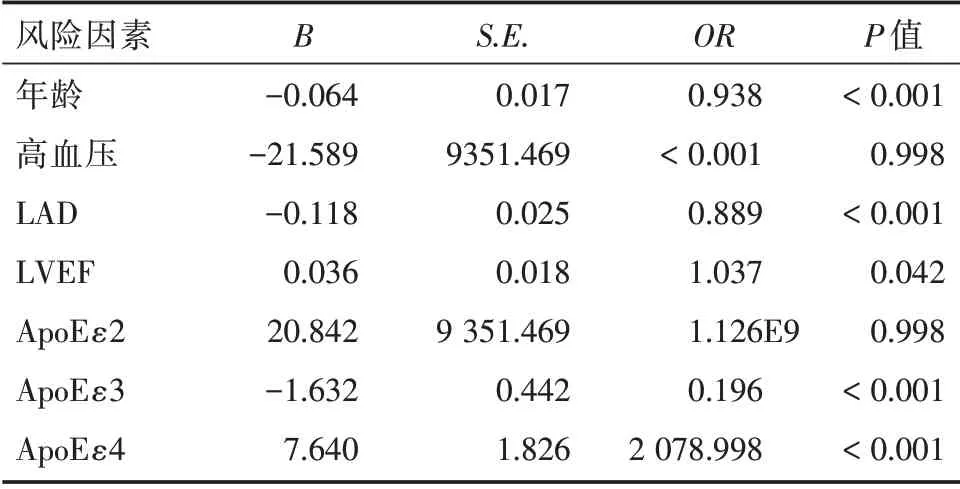
表5 房性心律失常发生相关因素的多因素logistic 回归分析Tab.5 Multivariate logistic regression analysis of related factors of atrial arrhythmia
3 讨论
ApoE 基因编码六种基因型,通过多种途径调节机体脂质代谢,具有组织修复、抑制血小板聚集和免疫调节等重要作用,与动脉粥样硬化、高脂蛋白血症等多种疾病的发生有关[6]。
房性心律失常的发生很大程度上是由于炎症因子浸润、心肌重构、心肌纤维化等多种因素共同导致。
在心房结构重构之前首先会出现电重构[7],心房电重构的主要离子基础是K+外流增多或Na+及Ca2+内流减少。肿瘤坏死因子⁃α(TNF⁃α)等炎症因子可增加心肌细胞内Ca2+浓度[8],引起L⁃型钙通道活性下调,使Ca2+内流减少,和心房电重构的离子基础相吻合;同时超载的Ca2+能激活钙激活蛋白,通过降解肌钙蛋白等心肌收缩蛋白导致心房收缩功能减退[9]继而引起心房间质纤维化,导致心房内冲动传导异常,诱发心房电重构,进一步诱发房性心律失常。
ApoE 具有调节炎症介质分泌及抵抗氧化应激的作用,但ApoEε4 等位基因促炎能力较强,并可激活核转录因子(NF⁃κB),从而引起TNF⁃α、转化生长因子⁃β1(TGF⁃β1)、单核细胞趋化蛋白⁃1(MCP⁃1)、超敏C 反应蛋白(hs⁃CRP)、白细胞介素1(IL⁃1)、白细胞介素6(IL⁃6)等炎症介质的表达[10],进而引起心肌电重构、结构重构[11],促使房性心律失常的发生。
ApoE 可引起TGF⁃β1 表达增多,TGF⁃β1 是一种重要的促心肌纤维化因子,在纤维化的心肌活检中均可发现TGF⁃β1 浸润,并且随血管紧张素Ⅱ(AngⅡ)作用的增强而升高[12],这间接支持ApoE基因与房性心律失常的相关性。
房性心律失常特别是房颤时心率加快、内皮细胞血管活性物质异常分泌、血流对血管壁冲击加剧继而导致内皮功能减退、受损,促进动脉粥样硬化[12⁃13]。ApoE 基因异常表达时易导致内皮损伤、脂质炎细胞浸润和过氧化从而进一步造成动脉粥样硬化[14]。
综合以上理论基础,笔者认为房性心律失常与ApoE 基因多态性表达有一定的关系。
本研究结果显示,房性心律失常组与对照组在性别、身高、BMI、吸烟、2 型糖尿病等方面差异无统计学意义,这表示一般人群不会因为上述因素的差异而增加房性心律失常的发生率;在年龄、高血压病、LAD、LVEF 方面差异有统计学意义,这提示年龄越大、患高血压病、左房内径越大、射血分数下降的人群房性心律失常的发生率可能更高。左房内径大、左室射血分数下降者大多伴有心肌电重构、结构重构、纤维化等,易导致房性心律失常。对于高血压病患者来说,血管壁持续性压力增加,易发生内皮细胞损伤,内皮素释放增多,进一步导致C 反应蛋白(CRP)、肿瘤坏死因子(TNF)、白细胞介素(IL)等炎症介质的浸润[15],继而出现心房电重构、结构重构、左房扩大[16],有了房性心律失常发生的病理生理基础。
本研究检出ApoE 6 种基因型,无论是房性心律失常组还是对照组均以ε3/ε3 频率最高,占总数一半以上,这与以往文献研究中ApoE 基因型人群分布大体一致[17]。本研究中房性心律失常组较对照组ε3/ε3 基因型明显减少,风险类基因型明显增多,差异有统计学意义(P<0.05),可能与ε4 等位基因具有较强的促炎作用,通过炎症途径参与房性心律失常的发生有关。同样支持ApoE4 型可能发生房性心律失常的风险高。
进一步对心律失常亚组分析发现,房颤组较其他房性心律失常组ApoE4 型明显增多,ApoE2 型比例减少,这与张秀玲等[18]研究结果相似,这可能与房颤炎症、内皮损伤程度高于其他房性心律失常有关。与ε4 等位基因相反,ε2 等位基因具有抗炎作用,可能降低房颤发生的风险。心律失常两亚组间ApoE2 型差异有统计学意义。但房性心律失常和对照组之间ApoE2 型差异无统计学差异意义,所以ApoE2 能否作为降低所有房性心律失常发生的有利因素,需要进一步的大样本研究论证。
根据房性心律失常发生相关因素的回归分析结果进一步证明,ApoE 基因多态性为房性心律失常发生的独立预测因素,ApoE4 型是房性心律失常发生的危险因素。但是在回归分析中发现高血压并不是房性心律失常发生的独立预测因素,和前面的基础资料以及相关研究不一致,可能与病例数偏少或高血压与其他导致房性心律失常的某些原因具有相关性造成统计学干扰。
综上所述,虽然目前ApoE 基因多态性与房性心律失常的相关机制尚未完全明确,但根据文献及本研究结果,房性心律失常一定程度上受ApoE基因多态性的影响,ApoE4 型是导致房性心律失常发生的主要危险表型;ApoE4 型更容易发生房颤或其他房性心律失常;ApoE 基因多态性和房性心律失常存在密切的联系,其中以房颤相关性最为明显。另外在关联因素回归分析中同样证明年龄越大、左房内径越大、射血分数下降的人群房性心律失常的发生率更高。为预防心血管事件,应重视从基因分子水平干预房性心律失常,从而减少房性心律失常的发生及其所导致的各种严重并发症。
本研究的不足之处在于所收集的样本量较局限,没有进行大范围、多地区的抽样检测,所有血标本保存、运输及检测过程未能全程监测,可能会造成非人为方面的误差。在今后的临床研究中将逐渐扩大样本量,进一步探讨ApoE2 在房性心律失常中的作用,完善细化多地区人群研究及患者长期复查及随访资料。

