健肝颗粒诱导线粒体自噬抑制乙肝肝硬化CD4+T细胞凋亡
李媛 龙富立 张衎 官志杰 姚凡 彭云鹤 舒发明 唐春回 毛德文 黄古叶
1广西中医药大学第一附属医院肝病科(南宁530023);2广西高发传染病中西医结合转化医学重点实验室培育基地(南宁530023);3广西巴马瑶族自治县民族医院(广西河池547500)
乙肝肝硬化(hepatitis B cirrhosis,HBC)是一种由乙型肝炎病毒(hepatitis B virus,HBV)持续感染所引起的慢性、弥漫性肝损伤疾病[1]。近年来,中药已成为治疗HBC 的首选药物之一[2]。健肝颗粒是依据临床经验研制的经验方,具有良好的抗肝纤维化、抗脂质过氧化物形成等效果,可显著改善乙肝患者肝功能[3],应用前景良好。CD4+T 细胞的凋亡坏死是HBV 感染后导致机体细胞免疫功能障碍的重要原因之一[4]。最新研究表明,线粒体自噬在肝脏免疫反应调节中具有重要作用[5],PINK1/Parkin/ROS 介导的线粒体自噬可提高细胞活性,抑制细胞凋亡[6],这有利于CD4+T 细胞的存活及免疫功能的发挥。故本研究拟通过采集临床HBC 代偿期患者经常规抗病毒治疗及联合健肝颗粒治疗后外周血,基于线粒体自噬PINK1/Parkin/ROS 信号通路,探究健肝颗粒对磁珠分选CD4+T细胞氧化应激及凋亡的作用机制,旨在为健肝颗粒的开发及应用提供更多科学依据。
1 材料与方法
1.1 试验药物 健肝颗粒组方(田七10 g,地龙10 g,半夏10 g,川芎10 g,白芍10 g)由我院药剂科提供。
1.2 患者一般资料 随机选取2018年7月至2019年12月在我院就诊的HBC 代偿期患者100 例,随机分为对照组和观察组,每组各50 例;其中,对照组男27 例,女23 例,年龄(40.2±9.5)岁;观察组男25 例,女25 例,年龄(40.9 ± 10.6)岁;另外,随机选取同期至我院的健康体检者共50 例为正常组,男28 例,女22 例,年龄(41.2 ± 12.8)岁。各组性别、年龄等一般资料比较差异无统计学意义(P>0.05)。患者纳入标准:患者均符合《慢性乙型肝炎防治指南(2015年)》HBC 诊断标准[7],知情并同意参与本研究(伦审2019⁃011⁃01)。患者排除标准:合并其他病毒感染,如:甲/丙/丁/戊型肝炎病毒、艾滋病毒、梅毒等,合并酒精性肝病及自身免疫性疾病,接受手术、放化疗及免疫治疗的肝癌患者等。
1.3 试剂 CD4+T 细胞阳选试剂盒(Miltenyi 130⁃090⁃860);ROS 试剂盒(mlbio,ml009876⁃1);MDA试剂盒(Elabscienc,E⁃EL⁃0060c);SOD 试剂盒(Elabscience E⁃BC⁃K019⁃S);Annexin V FITC/PI 试剂盒(Solarbio CA1020⁃50T);JC⁃1 荧光探针试剂盒(碧云天C2006);Anti⁃PINK1 antibody(abcam,ab216144);Anti⁃Parkin antibody(abcam,ab77924);Anti⁃LC3⁃Ⅱantibody(abcam,ab48394);Anti⁃Bax antibody(abcam,ab32503);Anti⁃Bcl⁃2 antibody(ab⁃cam,ab59348);Anti⁃ β ⁃actin antibody(abcam,ab8227);山羊抗鼠二抗(Sigma A9309);山羊抗兔二抗(Sigma A9169)。
1.4 仪器 细胞培养箱(新加坡ESCO,CLM⁃170B⁃8⁃NF)、流式细胞仪(BD FACSMelody)、多功能酶标仪(美国MD FilterMax F3)、电泳仪(Bio⁃Rad Power⁃Pac Basic)、凝胶成像系统(上海天能Tanon 5200)。
1.5 方法
1.5.1 治疗方法及样品处理 对照组采用恩替卡韦(博路定,国药准字H20052237,0.5 mg*7 片)治疗,0.5 mg/次,1 次/d。观察组采用健肝颗粒联合恩替卡韦治疗,恩替卡韦0.5 mg/次,1 次/d,健肝颗粒1 包/次,2 次/d,两组均治疗3 个月。分别采集对照组和观察组患者治疗前、后及正常组的外周静脉血各5 mL,进行后续实验。正常组静脉血经磁珠分选得到CD4+T 细胞后,分为Control 组、H2O2组和H2O2+CCCP(线粒体自噬激活剂)组,并进行以下处理[8]:H2O2组使用100 μmol/L H2O2培养24 h,H2O2+CCCP 组使用100 μmol/L H2O2和5 μmol/L CCCP 共培养24 h。
1.5.2 免疫磁珠分选CD4+T 细胞 使用10 mL PBS 稀释血液样本后,加入10 mL 淋巴细胞分离液,采用密度梯度离心法分离外周静脉血中单核细胞,使用含10%血清RPMI 1640 培养液重悬细胞,为单核细胞悬液。计数后按照1 × 107个细胞加入含10%磁珠的磁珠分选缓冲液100 μL,充分混匀后于4 ℃冰箱中避光孵育15 min。根据CD4+T 细胞阳选试剂盒进说明书行操作,经过柱、洗脱、洗涤及离心等步骤得到CD4+T 细胞团,使用RPMI1640 培养液洗涤重悬,按每孔2×106/2 mL 密度接种于6 孔板中培养。
1.5.3 Western blot 法检测PINK1/Parkin 通路关键蛋白的表达 各组样品使用RIPA 消化,收集细胞裂解液。BCA 法进行蛋白浓度测定,5 × Load⁃ing buffer 混匀,沸水浴5 min;每泳道上样20 μg 蛋白,SDS⁃PAGE 电泳,切胶,转膜,5%脱脂奶粉浸泡,室温封闭约1 h。将膜与一抗于4 ℃过夜孵育,1 × TBST 清洗;二抗37 ℃孵育1 h,1 × TBST 清洗;显色曝光后行底片扫描,统计蛋白灰度值。
1.5.4 Annexin V FITC/PI 检测细胞凋亡 使用4 ℃PBS 洗涤待检测细胞,离心后使用1 mL Bind⁃ing Buffer 重悬细胞,取出100 μL 细胞,加入5 μL Annexin V⁃FITC,室温避光孵育10 min,后加入5 μL PI,室温避光孵育5 min,随后加入400 μL PBS,使用流式细胞仪进行细胞凋亡检测。
1.5.5 JC⁃1 荧光探针检测线粒体膜电位 取各组细胞种于12 孔板中,待细胞融合至80%弃去培养基,加入终浓度为1 μg/mL 的JC⁃1 荧光探针染料,培养箱中孵育20 min,JC⁃1 染色缓冲液清洗后,加入1 mL 培养基,使用流式细胞仪检测红色荧光强度,红色荧光越强,线粒体膜电位越高。
1.5.6 ELISA法检测ROS、MDA、SOD的含量 根据ROS、MDA、SOD ELISA 试剂盒使用说明进行操作,于酶标仪检测各孔光密度值(OD),根据标准品结果描绘标准曲线,计算血清ROS、MDA、SOD含量及CD4+T 细胞ROS 含量。
1.6 统计学方法 采用SPSS 22.0 统计学软件进行数据分析,符合正态分布的计量资料结果以(±s)表示,多组间比较采用方差分析,多组间两两比较采用LSD⁃t检验。P<0.05 表示差异有统计学意义。
2 结果
2.1 健肝颗粒对HBC 代偿期患者氧化应激水平的影响 ELISA 检测结果显示,相较于正常组,对照组和观察组治疗前的ROS 和MDA 含量升高,SOD 含量降低(P< 0.05);相较于治疗前,对照组和观察组治疗后的ROS 和MDA 含量降低,SOD 含量升高(P< 0.05),且观察组治疗后与对照组治疗后的比较结果与之一致(P< 0.05);对照组和观察组治疗前的结果比较差异无统计学意义(P>0.05)。见图1⁃3。
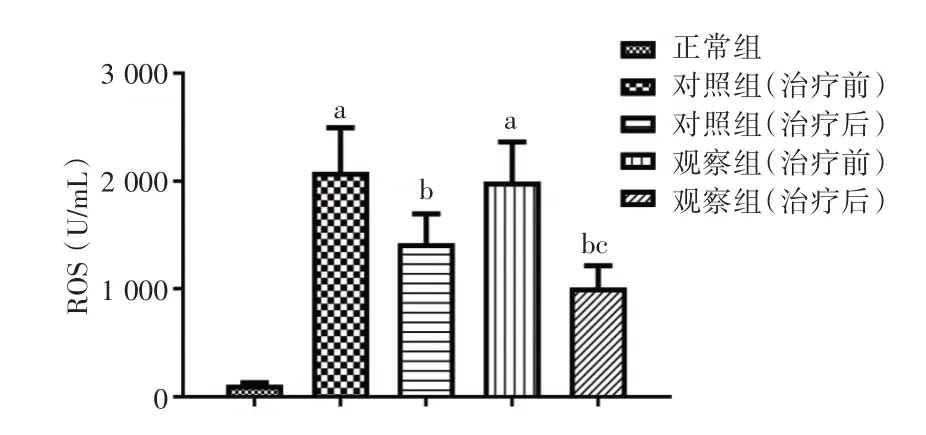
图1 各组血清中ROS 含量的比较Fig.1 Comparison of the content of ROS in serum of each group

图2 各组血清中MDA 含量的比较Fig.2 Comparison of the content of MDA in serum of each group
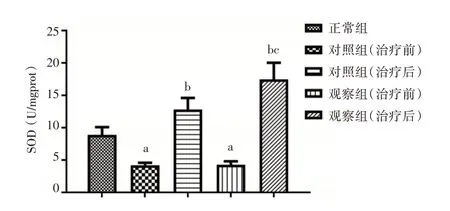
图3 各组血清中SOD 含量的比较Fig.3 Comparison of the content of SOD in serum of each group
2.2 健肝颗粒对HBC 代偿期患者CD4+T 细胞凋亡的影响 Western blot 和流式细胞术检测结果显示,相较于正常组,对照组和观察组治疗前的Bax表达和细胞凋亡率均升高,Bcl⁃2 的表达降低(P<0.05);相较于治疗前,对照组和观察组治疗后的Bax 表达和细胞凋亡率均降低,Bcl⁃2 的表达升高(P< 0.05),且观察组治疗后与对照组治疗后的比较结果与之一致(P< 0.05);对照组和观察组治疗前的结果比较差异无统计学意义(P> 0.05)。见图4、5。
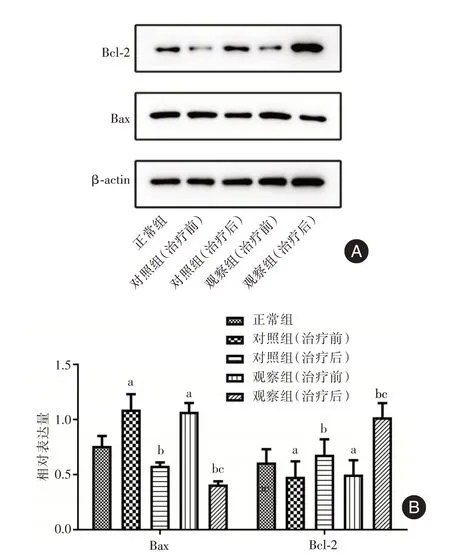
图4 各组细胞中Bax 和Bcl⁃2 蛋白表达水平比较Fig.4 Comparison of protein expression levels of Bax and Bcl⁃2 in cells of each group

图5 各组细胞凋亡率的比较Fig.5 Comparison of apoptosis rate in cells of each group
2.3 线粒体自噬对体外诱导的CD4+T 细胞氧化应激模型的影响 通过H2O2诱导建立CD4+T 细胞氧化应激模型,并使用线粒体自噬诱导剂CCCP 上调线粒体自噬水平,结果显示,相较于Control 组,H2O2组的ROS 含量和细胞凋亡率升高,LC3⁃Ⅱ的表达降低(P<0.05);而相较于H2O2组,H2O2+CCCP组的ROS 含量和细胞凋亡率降低,LC3⁃Ⅱ的表达升高(P<0.05)。见图6⁃8。
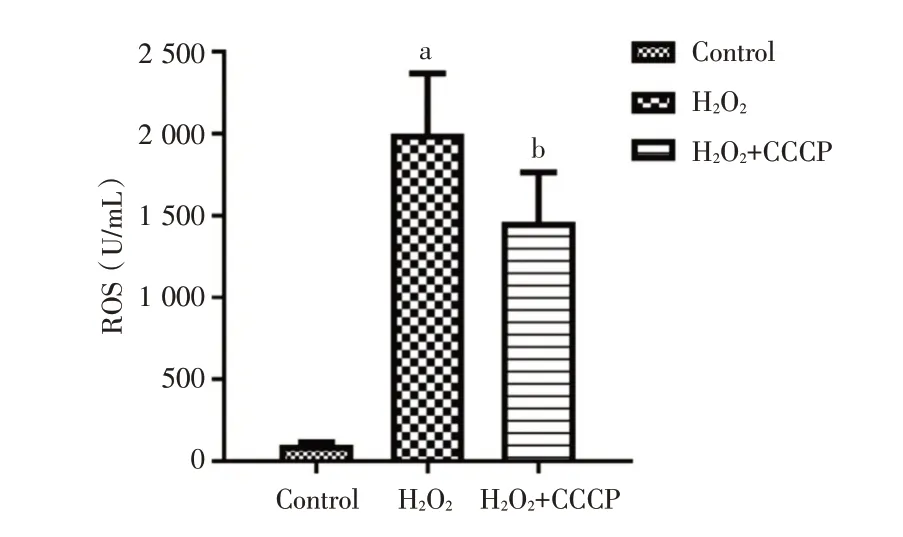
图6 各组细胞中ROS 含量Fig.6 Comparison of ROS content in cells of each group

图7 各组细胞中LC3⁃Ⅱ蛋白表达水平的比较Fig.7 Comparison of protein expression levels of LC3⁃Ⅱin cells of each group
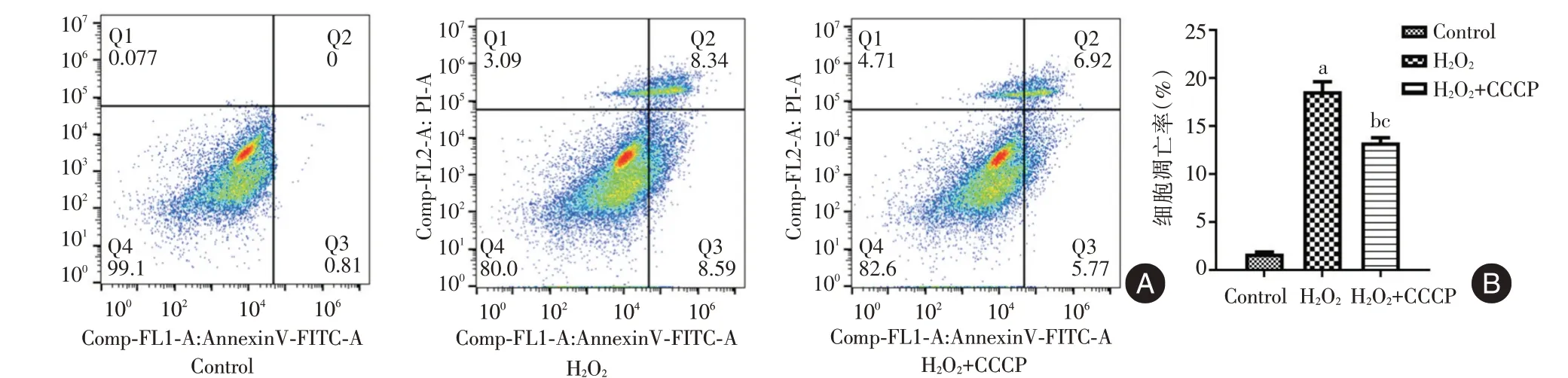
图8 各组细胞凋亡率的比较Fig.8 Comparison of apoptosis rate in cells of each group
2.4 健肝颗粒对患者CD4+T 细胞线粒体自噬的影响 Western blot 和流式细胞术检测结果显示,相较于正常组,对照组和观察组治疗前的PINK1、Parkin 和LC3⁃Ⅱ蛋白表达水平以及线粒体膜电位水平均降低(P< 0.05);相较于治疗前,对照组和观察组治疗后的PINK1、Parkin 和LC3⁃Ⅱ蛋白表达水平以及线粒体膜电位水平均升高(P< 0.05),且观察组治疗后与对照组治疗后的比较结果与之一致(P< 0.05);对照组和观察组治疗前的结果比较差异无统计学意义(P>0.05)。见图9、10。
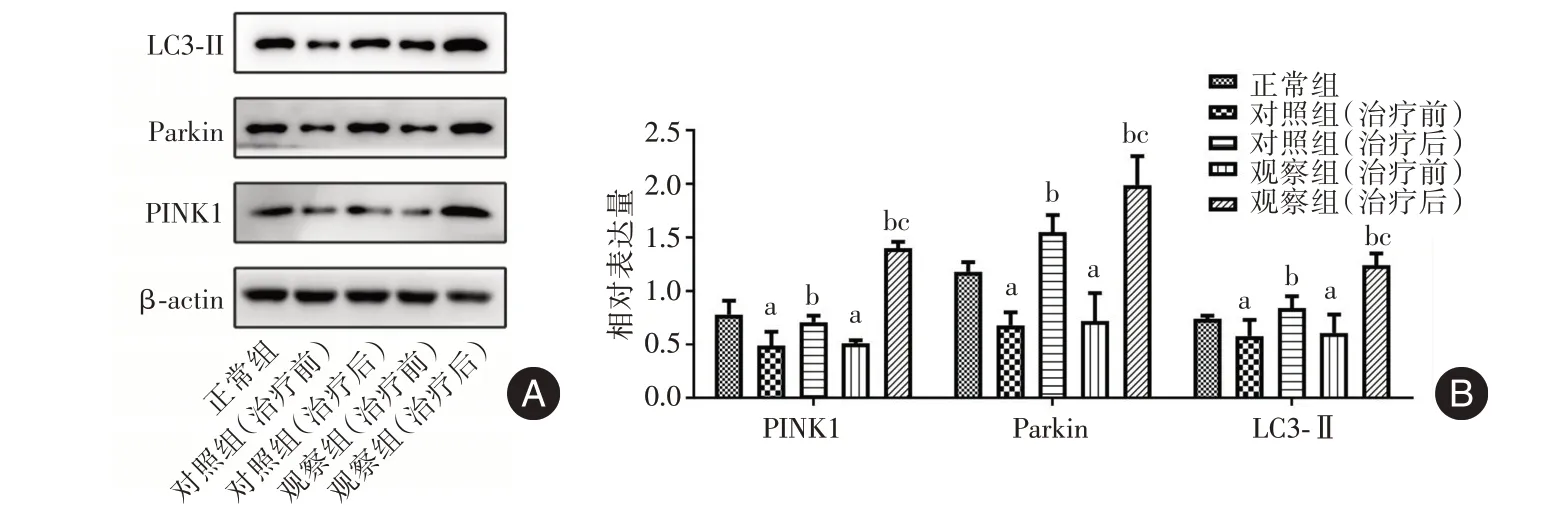
图9 各组细胞中PINK1、Parkin 和LC3⁃Ⅱ蛋白表达水平比较Fig.9 Comparison of expression levels of PINK1,Parkin and LC3⁃Ⅱin cells of each group

图10 各组细胞中线粒体膜电位水平比较Fig.10 Comparison of mitochondrial membrane potential levels in cells of each group
3 讨论
肝纤维化是慢性肝病发展至肝硬化的必经过程,代偿期是疾病进展的早期阶段,可有效逆转[9]。肝损伤和肝纤维化的初期,持续的、不可逆的氧化应激可导致肝细胞膜脂质过氧化、细胞功能异常,最终诱导细胞凋亡[10]。研究表明,ROS 的过量蓄积可促进肝纤维化的形成[11]。MDA 是细胞膜脂质过氧化反应链的终产物,SOD 是机体抗氧化体系的主要酶类。本研究发现,HBC 代偿期患者血清ROS 和MDA 含量升高,SOD 含量降低,与既往研究结果一致[12-13],表明HBC 代偿期患者机体呈现高氧化应激状态,提示抗氧化治疗是促进疾病转归的重要手段。
祖国医药认为,肝硬化属“黄疸”、“胁痛”、“瘀血”、“积聚”的范畴,其病机主要为湿热所致毒损肝络,气滞血瘀,湿浊积聚,而致毒、痰、瘀互结[14]。健肝颗粒组方,具有活血益气、去瘀生新、清肺化痰、柔肝止痛、疏肝开郁等功效。本研究发现,联用健肝颗粒治疗HBC 代偿期患者,可有效降低ROS 和MDA 含量,增加SOD 含量,降低机体氧化应激水平,且效果优于单用恩替卡韦,表明健肝颗粒可抑制HBC 代偿期患者的氧化应激水平,抗氧化效应显著。
临床研究表明,慢性HBV 持续感染会致先天性和适应性免疫反应功能障碍,涉及单核细胞/巨噬细胞、NK 细胞、T 细胞[15]。其中,特异性CD4+T细胞通过识别肝细胞表面的HBV 产生特异性细胞因子,从而参与肝脏的免疫应答,对HBV 的杀灭、清除具有关键作用。研究表明,由CD4+T 细胞介导的细胞免疫在肝硬化患者中免疫应答微弱,且CD4+T 细胞凋亡与肝硬化进程及归转有关[16-17]。在细胞凋亡机制中,促凋亡因子Bax 和抑凋亡因子Bcl⁃2 的异常表达可促进肝脏疾病进展[18⁃19]。既往研究已表明,健肝颗粒治疗乙型肝炎患者可提高外周血CD4+T 细胞计数及患者细胞免疫功能,且疗效优于单用恩替卡韦[20],提示健肝颗粒对HBC 的作用机制与CD4+T 细胞有关。本研究发现,健肝颗粒联合恩替卡韦可显著降低CD4+T 细胞凋亡率,抑制Bax,上调Bcl⁃2,效果优于单用恩替卡韦,表明健肝颗粒可能通过抑制CD4+T 细胞凋亡,进而调节HBC 患者细胞免疫功能。
机体氧化与抗氧化失衡时,可致ROS 过量生成,诱导细胞凋亡。线粒体是ROS 生成的“能量工厂”,其功能障碍可增加ROS 水平,引发机体氧化应激损伤[21],促进肝纤维化。在正常情况下,线粒体可启动线粒体自噬机制,通过选择性自噬清除受损线粒体,维持线粒体膜电位以及限制ROS 过量累积,从而维持氧化/抗氧化平衡。本研究发现,H2O2可提高CD4+T 细胞ROS 含量和细胞凋亡率,与HBC 患者机体高氧化应激状态以及细胞免疫功能障碍机制一致,而CCCP 诱导线粒体自噬发生可降低ROS 含量,减少CD4+T 细胞凋亡,表明激活线粒体自噬有利于抑制CD4+T 细胞的氧化应激和细胞凋亡,促进氧化/抗氧化平衡。
PINK1/Parkin 通路是介导线粒体自噬的重要途径。研究表明,线粒体功能障碍可加速肝纤维化进程,而上调PINK1 蛋白水平可发挥抗肝纤维化作用[22],表明PINK1/Parkin 通路与肝纤维化进程有着密切的联系。自噬标记物LC3⁃Ⅱ定位于自噬小体,是检测自噬水平的金标准。本研究发现,HBC 代偿期患者CD4+T 细胞中PINK1、Parkin 和LC3⁃Ⅱ蛋白表达以及线粒体膜电位水平均显著低于正常者,表明患者CD4+T 细胞的线粒体自噬水平被抑制,这可能是加重HBC 患者机体高氧化应激状态以及细胞免疫功能障碍的重要机制。此外,相较于单用恩替卡韦,联合健肝颗粒治疗可上调患者CD4+T 细胞中PINK1、Parkin、LC3⁃Ⅱ的表达,升高线粒体膜电位,表明健肝颗粒可能通过激活PINK1/Parkin 通路进而抑制HBC 进展。由此可推测,在HBC 患者外周血CD4+T 细胞中,PINK1/Parkin 通路介导的线粒体自噬被抑制或功能无法正常发挥,使受损线粒体无法及时清除,导致ROS过量蓄积,细胞氧化与抗氧化机制失衡,出现高氧化应激状态,促进细胞凋亡,致使细胞免疫障碍,加速了肝硬化进程。而健肝颗粒可通过上调粒体自噬水平,发挥抗氧化效应,抑制CD4+T 细胞凋亡,进而治疗HBC。
综上所述,氧化应激导致的CD4+T 细胞凋亡是促进HBV 感染,进而导致肝纤维化发展至HBC的重要因素之一。在HBC 代偿期患者中,健肝颗粒可通过PINK1/Parkin/ROS 通路诱导线粒体自噬抑制HBC 患者CD4+T 细胞凋亡,阻断肝硬化进程,极具临床应用价值,值得进一步推广。

