电喷雾串联质谱法检测干血斑中谷氨酰胺、谷氨酸及其临床初步应用*
王彦云,程威,洪冬洋,孙云,蒋涛(南京医科大学附属妇产医院&南京市妇幼保健院遗传医学中心,南京 210004)
氨甲酰磷酸合成酶、鸟氨酸氨甲酰转移酶、精氨酸琥珀酸合成酶、精氨酸琥珀酸裂解酶、精氨酸酶和鸟氨酸-δ-转氨酶缺乏可导致先天性尿素循环障碍性疾病(urea cycle disorders,UCD)[1]。鸟氨酸氨甲酰转移酶缺乏症(ornithine transcarbamylase deficiency,OTCD)是最常见的UCD,其发病率约为1/56 500[2]。氨甲酰磷酸合成酶缺乏症(carbamoyl phosphate synthetase deficiency,CPSD)与OTCD 同属于UCD。OTCD和CPSD 均表现为血浆氨、谷氨酰胺(Gln)增高,精氨酸(Arg)和瓜氨酸(Cit)降低[3]。CPSD与OTCD致死、致残率较高,患儿血液中Cit可作为筛查指标。2019年《新生儿疾病串联质谱筛查技术专家共识》[4]将OTCD和CPSD纳入新生儿遗传代谢病筛查病种。
电喷雾串联质谱(electrospray ionization-tandem mass spectrometry,ESI-MS/MS)技术可以同时检测干血滤纸片样品中的11 种氨基酸,分别为丙氨酸(Ala)、Arg、Cit、甘氨酸(Gly)、亮氨酸(Leu)、蛋氨酸(Met)、鸟氨酸(Orn)、苯丙氨酸(Phe)、脯氨酸(Pro)、酪氨酸(Tyr)、缬氨酸(Val)。国内大部分新生儿筛查中心当前均采用串联质谱技术,通过检测干血斑中Cit浓度来筛查新生儿OTCD和CPSD,暂未见用ESI-MS/MS 技术检测干血斑中Gln 和谷氨酸(Glu)[5]。在实际临床应用中,依赖Cit 浓度筛查OTCD和CPSD 的灵敏度不足50%且假阳性率高[6]。本研究拟建立一种用ESI-MS/MS 技术检测Gln和Glu的方法,该方法不影响常规临床检测、不额外消耗干血斑样品量。本研究将该方法应用于筛查新生儿OTCD 和CPSD,并初步制定本地区新生儿Gln 的参考区间,为OTCD 和CPSD 的新生儿筛查提供依据和参考。
1 材料与方法
1.1 标本来源 2020 年6—9月南京市新生儿遗传代谢病筛查足跟血干血斑样品。本研究获得南京市妇幼保健院医学伦理委员会批准(文号:宁妇伦字[2018]93号),新生儿的监护人均签署知情同意书。
1.2 主要试剂与仪器 非衍生化串联质谱检测试剂盒(美国 PE 公司);甲醇(色谱级,货号1060075000,德国默克公司);XTQD 电喷雾串联质谱检测系统(美国Waters公司);8通道微量移液器(Thermo公司);纯水仪(杭州万洁公司)。
1.3 方法
1.3.1 标本前处理 非衍生化串联质谱检测试剂盒内含流动相、萃取液、11种氨基酸内标、琥珀酰丙酮内标和13种酰基肉碱内标。首先用该试剂盒进行标本前处理,然后进行常规串联质谱检测,再用萃取液进行复溶后用ESI-MS/MS 技术检测Gln 和Glu。ESI-MS/MS技术检测干血斑Gln 和Glu 的流程见图1。

图1 ESI-MS/MS技术检测干血斑Gln和Glu的流程
将3 mm干血滤纸片(相当于3.2 μL 全血)置于温育用96孔U形板中,每孔加入100 μL萃取液和内标混合液,密封后45 ℃恒温震荡45 min,然后将上清液(约75 μL)转移至检测用96 孔V 形板中,铝膜覆盖,室温静置2.5 h,即可上样进行常规检测,每份样品进样量为15 μL。常规检测流程结束后,每孔残余样品中加入60 μL 萃取液,铝膜覆盖,室温震荡10 s混匀后即可上样检测Gln和Glu。每份样品进样量为30 μL。
1.3.2 质谱条件 采用XTQD 电喷雾串联质谱检测系统,采用正离子扫描模式,扫描时间为1.5 min,离子源温度设定为150 ℃,脱溶剂气温度500 ℃,脱溶剂气流速850 L/h,锥孔反吹气50 L/h,Leu、Gln和Glu离子采集通道分别为135.1→89.1 m/z、147.1→84.2 m/z、148.02→84.02 m/z。
1.3.3 内标选择 由于本研究直接使用残余样品溶液,不再另行添加Gln 和Glu 的内标,因此直接使用试剂盒中已经预添加的内标。当分析物没有相应的同位素内标时,可参考“内标物的峰应尽可能接近待测物的峰”原则[4],本研究选定Leu 内标d3-Leu为Gln和Glu的参考内标。
1.3.4 标准曲线 准确称取1.845 mg Gln和1.839 mg Glu溶解于5 mL 纯水中,制备成2.5 mmol/L 的混合工作液,加入适当体积的全血,最终工作浓度分别是1 250、500、250、125、50 μmol/L。以待测物和内标物的浓度比作为横坐标,待测物和内标物的离子响应强度比作为纵坐标,绘制标准曲线,要求R2不小于0.990。
1.4 方法学评价 非衍生化串联质谱检测试剂盒可常规检测11 种氨基酸,但只有9 种氨基酸有商品化质控品,另外2种氨基酸均采用样本均数法作为室内质控的补充[7]。因此,本研究也采用样本均数法对复溶后样品检测进行室内质控。在室内质控在控的情况下评价方法学性能。
1.4.1 加样回收率实验 取2份健康人的全血,以及加入50、125、250、500、1 250 μmol/L Gln 和Glu的全血,均按照上述方法测定,计算回收率。回收率=(换算后测定浓度-基础浓度)/加样浓度×100%,回收率可接受标准为70%~130%。
1.4.2 正确度 参考CLSI EP15-A2指南,检测50、125、250、500、1 250 μmol/L干血斑样品,计算检测值与理论值的相对偏倚。偏倚=(测定值-理论值)/理论值×100%,偏倚≤±30%为中国疾病预防控制中心(CDC)室间质控可接受水平。
1.4.3 精密度 参考CLSI EP15-A2指南,选高、低浓度水平样品,分别测定20次,后续每批实验重复测定2 个浓度样品2 次,验证精密度性能,以变异系数(CV)表示,CV<10%为可接受水平。
1.4.4 稳定性 通过常规串联质谱检测后剩余样品中Gln 和Glu 的检测,可以降低假阳性率。但剩余样品可能面临残留量偏少问题,因此需用试剂盒自带的萃取液进行复溶后检测。由于Gln 不稳定,需明确未复溶样品和复溶后样品中Gln 的差异。采用2020年7 月连续编号的255 份样品,完成常规串联质谱检测后,立即检测Gln和Glu,检测完成后的样品立即进行复溶,每孔中直接加入60 μL萃取液,铝箔膜密封覆盖,室温震荡10 s混匀后进样。比较复溶前后样品中Gln和Glu的稳定性。
1.5 临床初步应用 检测612 例复溶样品的Gln和Glu,观察检测值的分布情况;确诊OTCD阳性样本共计6例,其中3例为患儿陈旧性初筛干血斑样品,另外3例是将患儿的冻存抗凝静脉血溶解后滴于空白滤纸片上,制备成干血斑样品后进行检测。
1.6 统计学分析 用SPSS 22.0统计软件进行。
2 结果
2.1 标准曲线 见图2、3。在50~1 250 μmol/L范围内,Gln标准曲线为Y=0.081 3X+0.330 8,R2=0.998 6;Glu 标准曲线为Y=0.076 1X+0.19,R2=0.999 6。
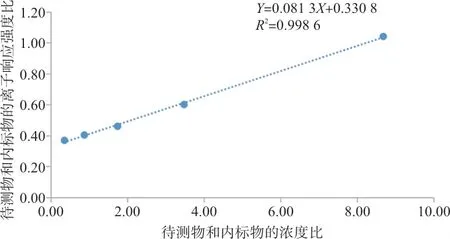
图2 ESI-MS/MS检测Gln的标准曲线

图3 ESI-MS/MS检测Glu的标准曲线
2.2 回收率 50、125、250、500、1 250 μmol/L Gln的回收率分别为170.90%、107.24%、98.16%、98.01%、101.15%,Gln 在125~1 250 μmol/L浓度范围内回收率良好。50、125、250、500、1 250 μmol/L Glu的回收率分别为191.22%、129.18%、113.65%、103.87%、102.06%,Glu在250~1 250 μmol/L浓度范围内回收率良好。
2.3 正确度 50、125、250、500、1 250 μmol/L Gln的偏倚分别为56.16%、1.33%、4.80%、3.46%、0.56%,Gln在125~1 250 μmol/L浓度范围内正确度良好。50、125、250、500、1 250 μmol/L Glu 的偏倚分别为37.45%、7.67%、2.90%、1.50%、0.09%,Glu在125~1 250 μmol/L浓度范围内正确度良好。
2.4 精密度 见表1。Gln精密度良好。

表1 Gln和Glu测定的重复性和期间不精密度
2.5 复溶样品的稳定性 用Mann-WhitneyU检验分析255例样品复溶前、后Gln、Glu检测结果,P值分别为0.148、0.000,表明可用复溶样品检测Gln。
2.6 临床初步应用 检测612例复溶样品的Gln和Glu,测定值呈偏态分布,鉴于在OTCD和CPSD患儿中,Gln均表现为增高,因此偏态分布数据单侧参考区间取P95参考限,Gln参考区间为<106.63 μmol/L,Glu参考区间为<188.24 μmol/L。
表2中,样品1~3是将低温保存的阳性静脉血样品复溶,颠倒混匀后直接滴于空白滤纸片,制备成干血斑后检测,Gln 明显增高,Glu 在参考区间内;样品4~6均为-20 ℃保存的陈旧性、阳性干血斑样品,检测结果中Gln 未见明显增高,但Glu 均明显增高。

表2 OTCD阳性样品Gln和Glu检测结果
3 讨论
目前国内暂未发布针对尿素循环障碍的专家共识。根据国外2002年尿素循环障碍的指南[8]以及2012年[3]、2019 年[9]专家共识,Gln 筛查OTCD和CPSD的特异性、敏感性高于Cit。但国内一些针对OTCD、CPSD 的案例报道中,描述为Glu 增高。因此,本研究除了检测Gln,还同步检测干血斑中Glu。
根据OTCD 阳性新鲜干血斑样品与陈旧干血斑样品对比结果,新鲜样品中Gln 升高,Glu 正常,与国外指南描述一致;而陈旧性样品中Glu 升高,Gln正常。结合文献分析,Gln稳定性比Glu弱,Gln的分解又称谷氨酰胺异化或谷氨酰胺降解,是通过一系列的生化反应过程,将Gln降解为Glu、天门冬氨酸、二氧化碳、丙酮酸、乳酸、丙氨酸、柠檬酸等产物。因此,陈旧样品中大量的Gln降解为Glu,导致了Glu异常增高;提示在实际应用中,应同时检测Gln、Glu,避免因干血斑样品保存不当而导致Gln表现为假阴性,同步检测Glu可防止漏检。
采用完成常规质谱检测后的干血斑样品进行复溶,在复溶样品中检测Gln 与Glu 还存在以下优势:(1)节约干血斑样品量和缩短检测时间。所有新筛样品均必须进行常规串联质谱检测,用一次实验的成本已经同步将Gln 和Glu 成功从干血斑中萃取出来,后续只需要用微量且极低成本的萃取液复溶后即可进样检测。采用剩余溶液复溶后立即检测Gln,可以在不增加干血斑样本量和试剂成本的前提下迅速完成Cit 的二级筛查;(2)降低假阳性率、提高阳性预测值。常规临床筛查工作中,以Cit低于6.0 或Cit/Phe 低于0.1 为界限统计,初次筛查阳性率接近1/100,实际工作中OTCD与CPSD的发病率远低于该界限,过高的阳性率会加重新生儿家属的心理负担并增加实验室的检测成本,因此通过原始样品检测残留物进行二级筛查,可以降低假阳性率、提高阳性预测值和降低检测成本。
本研究中虽然已经初步建立Gln 和Glu 的参考区间,鉴于当前阳性样本例数过少,后续工作中仍需积累阳性样本,进一步评估该方法的性能。

