植物外源多酚氧化酶酶促合成茶黄素的研究进展
李 东,李洁媛,雷 雨,童 凯,姜 斌,李亚兰,唐 璇
四川轻化工大学 生物工程学院,四川 宜宾 644000
1957年,Roberts E.A.H[1]首次在红茶中发现一类由茶多酚类物质氧化缩合形成的橙黄色物质,并将这类物质命名为茶黄素(theaflavins,TFs),这是一类易溶于乙酸乙酯的、含有多个羟基或酚羟基的苯骈卓酚酮结构的物质。至今,研究者们已在自然界中发现了12种天然的茶黄素组分[2],其中最主要的组分是茶黄素(theaflavin,TF)、茶黄素-3-没食子酸酯(theaflavin-3-gallate,TF-3-G)、茶黄素-3'-没食子酸酯(theaflavin-3'-gallate,TF-3'-G)和茶黄素-3,3'-双没食子酸酯(theaflavin-3, 3-digallate,TFDG)。虽然,茶黄素类物质在红茶中的含量仅在1%左右,但却是影响红茶色泽和滋味品质的关键性因素[3]。据现有研究[4]表明,茶黄素可有效降低血糖血脂且抗突变、防癌抗癌,可广泛应用于保健品和医药领域。
随着对茶黄素结构和性质的不断认识,研究者们制备茶黄素的方法也从茶汤中直接提取转变成体外模拟氧化系统制备茶黄素[5]。而根据催化剂的种类,研究者们将体外模拟氧化系统分为化学氧化系统和酶促氧化系统[6]。其中,化学氧化系统所利用的催化剂是无机氧化剂,由于催化剂不具备底物专一性,导致产品纯度低,含有较多副产品,且会对环境造成损害,在推广运用中受到一定限制[7]。目前,酶促氧化合成茶黄素所利用的催化剂绝大多数是来自植物源的多酚氧化酶(polyphenol oxidase,PPO),因其酶底物专一,生成产品纯度较高,能较大程度地提高茶黄素浓度,降低生产成本且天然无害,故广受关注和运用[8]。
1 酶促合成茶黄素PPO的酶源筛选
1983年,Robertson A[9]等人首次在植物体外模拟酶促氧化系统,结果显示在半纯化的PPO作用下,高纯度的儿茶素可在体外制备得到茶黄素。但是,研究中所利用的PPO大多来自茶叶,由于茶鲜叶受季节局限,且鲜叶中PPO虽然量大,但存在多种同工酶导致成品茶中茶黄素含量并不高[10]。
研究者们近年来积极寻找新的PPO酶源以求代替茶叶PPO催化茶黄素的生成[11],通过对比不同来源的PPO酶促合成茶黄素能力(表1),证实苹果、梨、山药、甘薯和桑叶等果蔬中均含有较高活性的PPO且能较好地酶促合成茶黄素,均可作为较合适的酶促合成茶黄素的天然酶源[12-20]。李适[12]和梁燕[13]等人还通过对比来自不同的植物和微生物中PPO酶促合成茶黄素能力的高低,结果表明植物PPO酶促合成茶黄素的能力均高于微生物PPO,其原因可能是微生物生成的PPO底物专一性太强,不能高效地将儿茶素催化合成茶黄素,也可能是各试验菌种所需培养条件较为挑剔,培养条件的改变极易导致PPO酶活和酶催化能力的改变,研究表明植物PPO相较于微生物PPO更适合作为酶促合成茶黄素的催化剂。
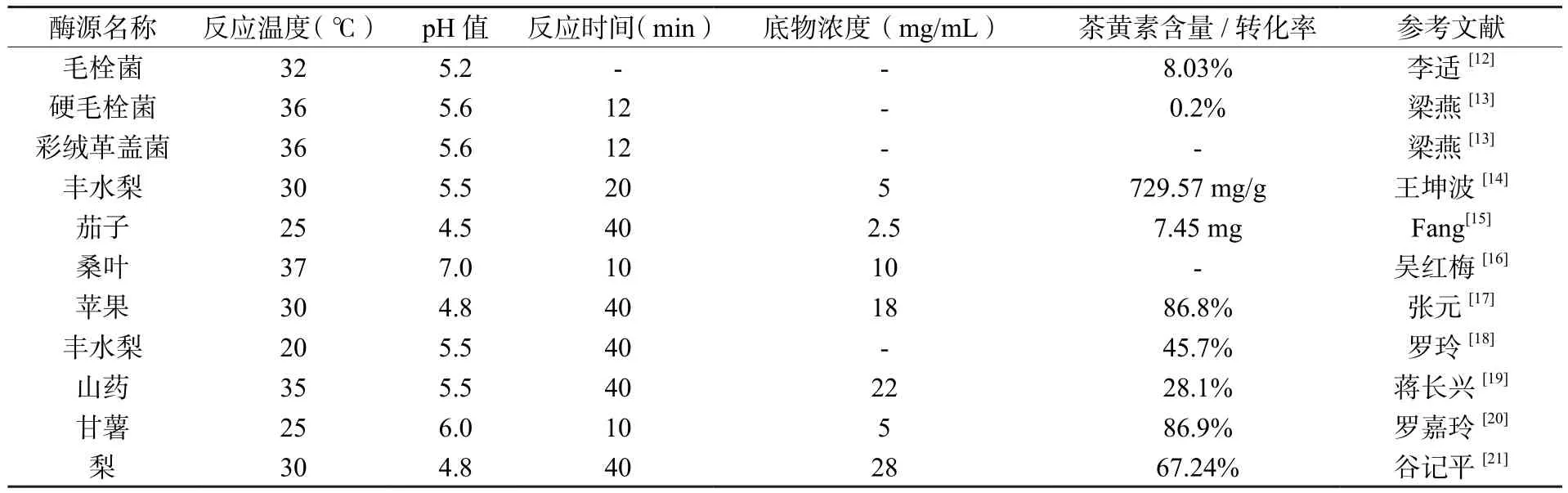
表1 不同来源的PPO酶促合成茶黄素能力对比Table 1 Comparison of enzymatic synthesis of theaflavins by PPO from different sources
2 影响酶促合成茶黄素的因素
2.1 酶的种类与浓度
研究表明[21],在氧气的作用下,儿茶素可以利用PPO和过氧化物酶(Peroxidase,POD)在植物体外酶促合成茶黄素。其中,PPO仅能将底物儿茶素酶促合成简单二聚体和TFs,但POD在此基础上还会将简单二聚体和TFs继续酶促合成复杂二聚体和茶红素(Thearubigins,TRs),其反应途径[22]如图1。江用文等[23]利用PPO和POD对不同茶树品种悬浮发酵产生茶黄素能力进行对比研究发现,PPO活性/POD活性比值越大,其形成茶黄素的能力越强。梁燕[13]通过对比PPO和POD分别与儿茶素反应的酶动力学米氏常数,结果表明PPO对儿茶素的亲和力要明显远高于POD。夏涛[24]在体外模拟酶促氧化系统中添加不同比例的煮沸青叶,发现随着蒸青叶比例的增加,发酵体系中的酶浓度随之降低,但煮沸青叶的比例在发酵后期对TFs生成含量并无明显影响,故指出发酵体系中的酶浓度对形成茶黄素含量并无太大影响。由于PPO酶浓度对于酶促生成茶黄素影响的研究报道较少,酶浓度对于茶黄素生成的影响仍需更多试验证实。
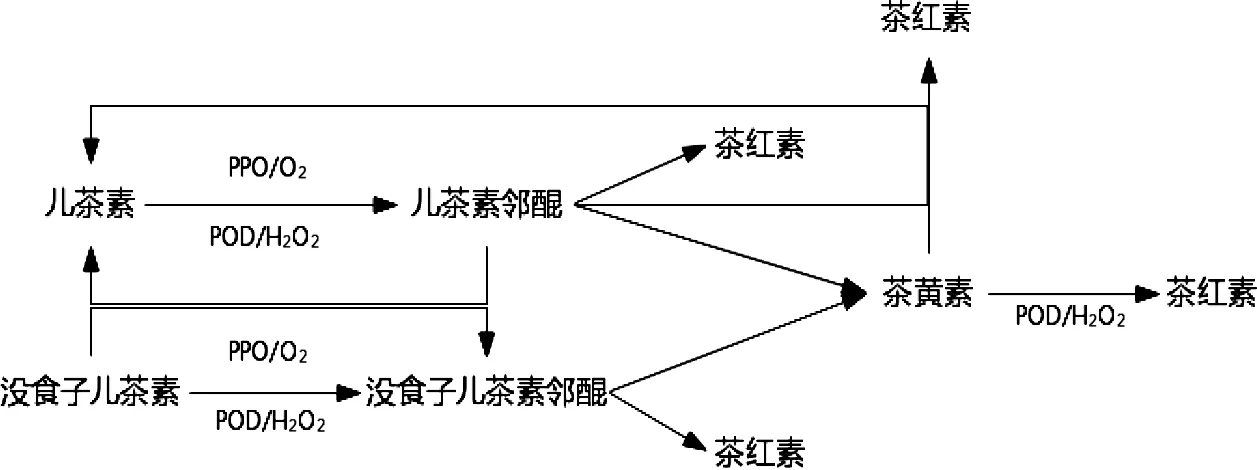
图1 PPO和POD酶促合成茶黄素、茶红素的反应途径Figure 1 Reaction Pathway of Enzymatic Synthesis of Theaflavin and thearubigins by PPO and POD
2.2 底物种类与浓度
国外研究者们[25]认为在有氧条件下,儿茶素类物质儿茶素(catechin,C)、表儿茶素(Epicatechin,EC)、EGC和EGCG等可通过PPO酶促合成TFs。Robertson A[26]往体外氧化系统中添加不同浓度和比例的儿茶素类物质,发现当体外氧化系统的反应底物是酯型儿茶素(EGCG和ECG)的单一或混合体系时,且其浓度过高就会抑制PPO活性,最终影响TFs合成量;但反应底物是由EC、EGC、EGCG和ECG共同组成混合体系时,即使处于较高浓度也不会再抑制PPO活性和TFs合成量。Hilton[27]研究指出,当植物鲜叶中有足够含量的酯型儿茶素(EGCG和ECG)时,非酯型儿茶素(EGC)含量与TFs形成量呈现高度相关。由此可见,可通过适当增加EC和EGC儿茶素含量,使TFs形成量增加。
2.3 pH值
儿茶素和茶黄素均为不稳定物,极易受到环境光照、pH值以及温度的影响,可见,pH值是影响茶黄素合成量的关键性因素之一。研究者探究了pH值对儿茶素反应动力学的影响[28]:通过改变反应系统的pH值发现,儿茶素类的氧化还原电位随着pH值的改变而改变,降低没食子儿茶素的氧化速率,从而影响TFs酶促合成。有研究表明[29],当反应体系pH值>6.0时,可促进EC氧化形成茶黄素类物质;而当pH值<5.0时,对形成茶黄素类物质有抑制作用。表明体外氧化系统的pH值为5.0~6.0时,最适合酶促合成TFs。
2.4 温度
PPO作为蛋白质也极易受到温度的影响,因此反应体系温度必然对TFs的生成具有一定影响。Robertson A[30]发现,虽然温度升高可使酶活相对提高,但会增加PPO对氧气的需求,情况严重时还会造成供氧不足,最终影响TFs的酶促合成。而反应体系温度稍低于室内正常温度,酶促反应中PPO活性较高且供养充足,这时反应体系温度将有利于积累TFs。相关研究结果[31]可大致归纳为:虽然温度是对TFs生成有较复杂影响,但总体来说TFs在较温和的条件下才能生成,其适宜条件大致在15℃~40℃。
2.5 反应时间
植物体外酶促合成TFs主要包括形成过程和降解过程[32],反应时间将极大程度影响茶黄素生成与积累。研究表明[33],随着反应时间的延长,TFs含量逐渐增加至最大后开始下降,同反应时间呈二次曲线。但值得注意的是,TF和TF-3'-G的生成速率较快,可在较短的发酵时间内生成;而TF-3-G和TFDG的生成速率较慢,可以适当延长发酵时间以获得更大含量。
3 酶工程技术在制备茶黄素上的运用
3.1 PPO固定化制备茶黄素
研究表明[34]植物外源PPO虽然能较好转化合成茶黄素,但是PPO的稳定性和酶活力保持能力较弱。研究者[35]便通过利用固定化酶类的方法以此来提升PPO的热稳定性和使用效率。常用的固定化载体材料主要分为无机载体、有机载体、复合载体和纳米载体[36],其中,无机载体[37]来源方便、廉价、无毒,但固定化酶活性较低, 载量小,而有机载体不易溶于水、含有较多反应官能团等,但酶活稳定性较差, 易分解。而复合载体[38]是将无机和有机载体组合,成为现阶段最为常用的固定化材料。纳米载体[39]作为新型载体,具有良好的生物相容性,但由于纳米载体的设计相对困难且成本较高,现阶段仍处于开发阶段。
屠幼英团队[40]探索了固定化PPO催化茶多酚形成茶黄素的能力,其结果显示固定化PPO能实现儿茶素向茶黄素转化。有研究者[41]利用海藻酸钠固定化PPO催化儿茶素形成茶黄素,所得茶黄素最高得率可达到30%以上。Sharma[42]利用活化纤维素固定化PPO,并用其酶促合成TFs,TFs合成效率提升至之前的14倍。不仅如此,Lei[43]也曾利用纳米粒子固定化制备PPO,其能将产率提升42.23%。可见,固定化PPO不仅能够有效地提高酶促合成茶黄素的能力,且能重复利用制备TFs,有望推广到生产中。
3.2 PPO工程菌制备茶黄素
随着分子生物学的不断发展,PPO作为体外酶促合成TFs的关键因素,PPO的克隆表达和工程菌的建立受到研究者们的广泛关注,不仅克隆出PPO的基因,而且利用基因表达技术制备得到高酶活、高纯度的PPO,从而更好地利用其酶促合成TF,极大程度上提高蛋白的表达效率。
有研究者[44]在大肠杆菌中对番茄、苹果和鸭梨的PPO基因编码区序列进行克隆和表达,但其表达产物仅具有较低酶活。其原因其一可能是[45]大肠杆菌存在着自身保护机制,把外源蛋白PPO看成外来异物进行分解沉淀;其二是由于PPO三维结构存在着两个活性中心而具有高酶活性,但大肠杆菌仅作为原核表达系统,翻译表达的蛋白不能折叠形成具有活性的三维结构。
吴贻良[46]用成熟PPO基因构建表达载体,分别把成熟PPO基因分别克隆入非分泌型载体和分泌型载体中,并在毕赤酵母GS115表达,酶活分别为29.12 U/mg和26.92 U/mg。陈东升[47]将重组原核表达载体转化至表达菌株DE3感受态细胞,经IPTG诱导表达得到目的蛋白,通过原核诱导表达而成的PPO活性为50 U/(mL·min),经其酶促氧化的茶黄素大多为酯型茶黄素。
4 植物源PPO结构特点及氧化茶黄素机理研究
现阶段,工业生产如果想要对PPO进行结构改造以提高合成茶黄素的能力,研究者们就需要进一步对PPO的结构特点以及其氧化合成茶黄素的作用机理进行探讨。
大多数植物源的PPO均含有一种相对分子质量约为60 ~ 80 KDa的前体肽,它是由N端延伸区、催化功能结构域和C端延伸区共同组成[48]。其中,保守性较低的N端和C端延伸区是形成酶的基本构象和维持其高级结构的中心,而催化功能结构域内的一对铜原子将通过配位键结合CuA区和CuB区的His残基,从而形成一个具有特定结构的活性部位[49]。
当邻苯二酚作为反应底物时,PPO的多肽链会和反应底物的空间构象发生柔性改变,同时反应底物也会通过作用位点进入PPO的活性中心,与PPO多肽链上的氨基酸残基连接,形成不稳定的复合体结构。这种结构极易发生多肽链的扭曲和氢键的断裂,使得PPO催化产物和活性中心分离形成邻苯醌,邻苯醌再次发生次级氧化作用,形成多结构的氧化聚合产物[50]。
由于植物种类、组织结构和发育阶段等差异,各植物来源PPO的酶活性和底物特异性存在着较大差异。例如,同为成熟时期的番茄含有7个PPO基因、马铃薯含有至少6个PPO基因、苹果含有至少4个PPO基因、小麦含有3个PPO基因编码等[52]。但是,通过对不同植物来源的PPO进行氨基酸序列分析,结果表明[53],茶树PPO的氨基酸序列同其他植物来源(梨、桃子、胡萝卜、甘薯、葡萄、苹果等)PPO的氨基酸序列具有高度同源性(>45%)。
目前蛋白质结构数据库已公布植物的PPO晶体结构,可初步解析晶体结构和特定功能之间的关系,但由于PPO表达的复杂性,其PPO催化茶黄素生成的机理、途径以及结构关系仍然尚不明晰[53]。
周仲华[54]曾利用同源建模的方法将已知基因序列的163个PPO建立出一个蛋白质立体结构,并通过将其与反应底物(EGCG)进行分子对接,来探究其催化茶黄素生成机理。结果证实,梨、甘薯和苹果等10种植物源PPO均能够催化茶黄素生成,而PPO与底物之间的作用取决于活性中心附近的氨基酸,而与一级结构及三级结构没有明显的关系。
5 展望
目前,有关外源PPO酶促催化合成茶黄素的研究,主要围绕的是外源PPO的筛选和合成茶黄素条件的优化,可以这些研究为基础进一步建立自动化氧化发酵茶黄素体系。但是,现有植物体外酶促合成TFs体系所用的大多是PPO粗提液,其酶活力尚可但其体系具体成分和酶促氧化机制尚不明确。因此寻找简便高效的PPO分离纯化方法,并研究各植物源PPO的酶促氧化能力及酶促氧化机理将是此后研究的重点。
近年来,酶工程蓬勃发展,若能在PPO氧化机理成熟的基础上,通过基因异源表达和基因工程菌的构建等现代化技术创造出有较高酶活的、可反复利用的、高效酶促合成TFs的PPO,既可为茶黄素的工业化生产提供可靠的理论依据,又能为指导茶黄素的工业合成奠定基础。

