491例颈项透明层2.5~3.4 mm胎儿的染色体分析
马莹 陈奕 吴青青
自20世纪90年代,Nicolaides等[1]首次报道超声测量颈项透明层(nuchal translucency,NT)厚度用于孕早期胎儿染色体异常的筛查,并分析NT厚度用于识别胎儿染色体非整倍体异常的灵敏度和特异度[2]。此后,NT测量在世界范围内逐渐被广泛采用,国际妇产超声学会对如何测量NT和控制质量有标准规范,还建议有条件的医疗机构在孕11+0~13+6周进行孕周确定和孕早期超声结构筛查[3]。NT≥3.5 mm的胎儿发生非整倍体异常的风险增加[4],NT≥3.5 mm的胎儿中检测到16.8%~30.2%存在非整倍体异常[5-6]。此外在科技进步的带动下产前遗传实践取得了非凡进展,已知致病性拷贝数变异(copy number variations,CNV)在辨别胎儿染色体亚显微结构异常方面具有重要作用。很多文献将NT≥3.5 mm作为胎儿进行染色体CNV检测的纳入指标[5-8],荟萃分析显示NT≥3.5 mm且核型正常的病例经基因组微阵列技术检测有5.0%的胎儿存在CNV[7]。但是相对于NT≥3.5 mm,NT厚度在2.5~3.4 mm的胎儿染色体情况尤其是CNV的报道很少,因此有必要对此类胎儿的染色体情况进行探讨。本院作为区域性产前诊断中心,2013年以来对NT厚度位于2.5~3.4 mm的胎儿采用单独核型分析或核型分析联合分子遗传学技术检测胎儿染色体情况,本文对上述两种技术检测出的胎儿染色体核型和致病性CNV的情况进行分析,以供临床参考。
对象与方法
1. 研究对象:选取2013年1月至2018年6月在首都医科大学附属北京妇产医院孕11+0~13+6周超声检查,标准切面测量胎儿顶臀长(CRL)在45~84 mm,NT为 2.5~3.4 mm并同意行介入性产前诊断的孕妇入组,记录孕妇的年龄、胎儿NT厚度、胎儿超声结果以及穿刺方法和染色体检查结果。
2. 超声方法:NT测量基于胎儿医学基金会(The Fetal Medicine Foundation,FMF)推荐的方案[9]。所有病例的NT超声测量均由经过培训的超声科医师完成,并对入组病例中继续妊娠者进行中孕期胎儿超声结构筛查。
3. 产前诊断方法:根据孕周知情同意后选择如下方法(1)孕11~14周经腹绒毛活检;(2)孕18~24周行羊膜腔穿刺;(3)超过孕24周选择脐静脉穿刺。所有孕妇均签署介入性操作知情同意书。
4. 染色体检测方法:孕妇知情了解后选择下面两种检测方法,单独或联合检测,每种方法均签署知情同意书。(1)染色体核型分析。显带水平为320条带。根据人类细胞遗传学国际命名体制(ISCN1995、ISCN2009)至少计数20个细胞,记录任何观察到的染色体数目或结构异常。对疑有染色体嵌合的样本,至少计数50个细胞。(2) 低覆盖度全基因组测序(Low Pass Whole Genome Sequencing,Low Pass WGS) 结合短串联重复序列(Short Tandem Repeats,STR)检测,由北京贝瑞和康生物技术有限公司进行,检测的分辨率为100 Kb。实验操作主要分为三步①样本基因组DNA提取;②文库构建;③上机测序。
5. CNV的分类:通过以下网址分析分析CNV的情况:http://omim.org/;http://genome.ucsc.edu/;http://ncbi.nlm.nih.gov/pubmed; http://dgv.tcag.ca/dgv/app/home;https://decipher.sanger.ac.uk/。根据美国医学遗传学实验室和美国医学遗传学与基因组学学会(American college of medical genetics and genomics,ACMG )制定和解释的标准[10-11],检测结果将CNV分类为:致病性、可疑致病性、意义不明确性、可疑良性和良性。本研究将致病性和可疑致病性定义为致病性,将可疑良性和良性定义为良性。
6. 统计分析方法:使用PASW Statistics 22.0软件,不符合正态分布的计量资料以中位数M(P25,P75)来表示。组间的各因素的样本率、构成比用χ2检验或Fisher′s精确概率(双尾)检验,以P<0.05为差异有统计学意义。分别按胎儿是否存在结构异常、NT厚度为2.5~2.9 mm、3.0~3.4 mm和孕妇是否高龄进行分组,分层比较不同组发生染色体异常的差异。
结果
1. 一般情况:因NT ≥2.5mm指征行介入性产前诊断的孕妇共977例,其中NT厚度为2.5~3.4 mm的孕妇488例(48.2%)入组。孕妇年龄19岁~47岁,年龄中位数30(28,33)岁,NT中位数3.0(2.8,3.2)mm。单胎475例,双胎13例,其中10例一胎NT厚度<2.5 mm,另一胎NT为2.5~3.4 mm,仅对NT厚度为2.5~3.4 mm的胎儿行产前诊断,3例双胎的两胎儿NT厚度均为2.5~3.4 mm,分别对两胎儿分别行产前诊断,共入组491例胎儿。
2. 检测结果:核型分析381例,Low Pass WGS检测239例,其中两者联合129例,单纯行核型分析252例,单纯行Low Pass WGS检测110例。
(1)检测结果概况。所有病例中,检测出非整倍体异常48例,占9.8%(48/491),包括21三体34例,18三体10例,13三体3例,15三体1例。另外还发现嵌合体2例和染色体多态性变异(均9号染色体臂间倒位)2例。
Low Pass WGS检测239例中,检测出CNV 35例,包括良性18例,意义不明确性12例,致病性CNV 5例(见表1),致病性CNV的检出率为2.1%(5/239)。除外意义不明确性及良性CNV,491例胎儿中染色体异常总的检出率为11.6%(57/491)。
(2)合并结构异常的检测结果。26例胎儿超声提示有结构异常表现,21例行Low Pass WGS检测(其中8例同时进行核型分析),5例仅行核型分析,12例(46.2%)胎儿染色体异常,包括非整倍体异常10例(38.5%),21三体7例,18三体2例,13三体1例;致病性CNV 2例,占9.5%(2/21)。见表2。

表2 NT 2.5~3.5mm合并结构异常的病例
(3)无结构异常的检测结果。单纯NT厚度为2.5~3.4 mm的胎儿465例,45例(9.7%)胎儿染色体异常,包括非整倍体异常38例(8.2%),染色体多态性变异2例,1例为46XN,inv(9)(p12q13),另1例为46XN,inv(9)(p12q21)mat,均无异常临床表型。嵌合体2例,1例为48,XN,+3,+7[35%]/46,XN[65%],另1例为47XYY[17%]/46XY[83%]。218例胎儿行Low Pass WGS检测,3例(1.4%)检测出致病性CNV。
(4)有无合并结构异常的检测结果比较。合并结构异常的胎儿染色体异常和非整倍体异常的检出率均显著地高于不合并结构异常的胎儿(P均<0.001);两者在致病性CNV的检出率方面,差异无统计学意义。见表3。
3. NT厚度与胎儿染色体异常的关系:按NT 2.5~2.9 mm、3.0~3.4 mm分两组进行比较,结果见表3。NT 2.5~2.9 mm组有195例胎儿,其中15例(7.7%)染色体异常;NT3.0~3.4 mm 有296例,其中42例(14.2%)染色体异常,两组胎儿合并结构异常的差异无统计学意义,NT 3.0~3.4 mm组比NT 2.5~2.9 mm组的胎儿总染色体异常率和非整倍体异常率均高(P均<0.05)。全部5例致病性CNV病例都发生在NT 3.0~3.4 mm组,但两组致病性CNV的检出率比较无统计学差异。
4. 高龄与胎儿染色体异常的关系:按孕妇预产期年龄<35岁及≥35岁分两组进行比较,结果见表3。每组例数及胎儿染色体异常例数分别为孕妇年龄<35岁有410例胎儿,其中38例(9.3%)染色体异常;孕妇≥35岁组有81例,其中19例(23.5%)染色体异常,孕妇≥35岁组总的染色体异常率和非整倍体异常率均明显增高(P均<0.001),并且高龄孕妇的胎儿出现结构异常更多见(P=0.025),全部5例致病性CNV病例都发生在年龄<35岁组,但两组致病性CNV的检出率比较无统计学差异。
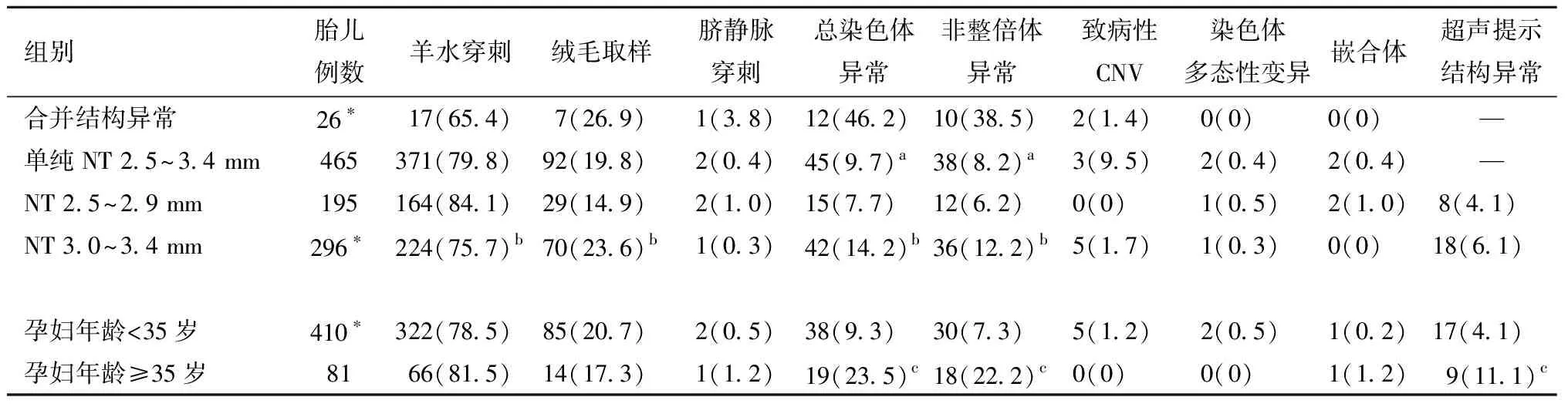
表3 不同组别检测结果比较[例数(%)]
讨论
随着超声仪器分辨率的不断提高及超声工作者的不断探索,孕早期超声检查越来越普及,可对早期胎儿结构进行评估,已知NT增厚是预测胎儿染色体异常和多种胎儿畸形的超声软标记[12]。研究提示随NT增加胎儿染色体异常的发生率逐渐升高[13-14]。2016年ACOG发布了163号指南[15]指出随NT值增厚胎儿非整倍体异常风险增加,NT≥3.0mm或大于相应胎儿头臀长的99%百分位数视为NT增厚,建议无创产前检测(noninvasive prenatal testing,NIPT)或绒毛活检。
本资料证实合并结构异常的胎儿染色体异常和非整倍体异常的检出率均明显高于不合并结构异常的胎儿(P<0.05)。文献也报道合并结构异常的胎儿核型分析异常率较单纯NT≥2.5 mm组明显升高[14]。荟萃分析发现核型正常的单纯NT≥3.5 mm的胎儿经染色体微阵列(chromosomal microarray analysis,CMA)检测后染色体异常检出率为4.0%,当合并其他结构畸形时,染色体异常的检出率增加到7.0%[7]。Leung等报道[8]在NT≥3.5 mm合并结构异常的病例致病性CNV的检出率为20.0%,而不合并结构异常的病例中仅为5.3%。NT≥3mm且核型正常的胎儿中9.1%存在CNV,超声提示结构异常的胎儿存在CNV的情况显著高于无结构异常的胎儿[16]。本资料结果合并结构异常的胎儿中9.5%存在致病性CNV,而在单纯NT 2.5~3.4 mm病例中仅有1.4%的胎儿存在致病性CNV,与文献报道基本一致[7-8,16]。说明当NT 2.5mm以上合并结构异常时应考虑胎儿存在非整倍体异常和致病性CNV的可能,建议行分子遗传学检测。
文献报道NT≥3.5 mm的胎儿中2.7%~8.3%存在致病性CNV,1.8%~2.5%通过核型分析检测不出来[5-6,8]。单纯NT≤2.9mm、NT3.0~3.4mm及NT≥3.5mm的三组胎儿,CMA检出的染色体异常率分别为1.7%、 6.5%和13.8%,检出核型不能发现的致病性CNV分别为0.9%、1.8%和2.2%[13]。在NT≥3.0 mm且核型正常的胎儿中,发现1.2%~4.3%存在致病性CNV[14,17]。本资料NT 2.5~3.4 mm的胎儿中2.1%检测出致病性CNV,但是本资料致病性CNV都发生在NT 3.0~3.4 mm胎儿中,NT 2.5~2.9 mm病例中未发现致病性CNV,也有同样报道在NT 2.5~2.9 mm核型正常的胎儿中未能检出致病性CNV[14],分析原因为该NT范围核型正常的胎儿中致病性CNV发生率很低,不易检测到,进行分子遗传学检测前应权衡利弊。
本研究统计高龄孕妇组胎儿染色体异常率达23.5%,染色体异常和非整倍体异常的发生率均较非高龄孕妇组增高(P<0.05),文献也报道高龄孕妇且NT2.5~2.9 mm胎儿合并染色体核型异常的风险增高[14]。虽然由于NIPT的广泛开展和较高的筛查准确率,不少NT2.5~2.9 mm的高龄患者倾向于选择NIPT,但是基于本研究,当孕妇高龄且NT2.5~2.9 mm时建议侵入性产前诊断为宜。另外本研究高龄孕妇组中未检测到致病性CNV,文献也报道高龄孕妇且NT2.5~2.9 mm胎儿未能检出致病性CNV[14],考虑孕妇是否高龄可能并不增加胎儿致病性CNV的发生率。
本资料中,致病性CNV中3例CNV片段<10 Mb,核型结果正常。还有2例致病性CNV结果是染色体部分缺失和染色体部分重复,胎儿为缺失-重复患者,核型结果也是正常(见表1,病例1和病例4),分析原因考虑染色体缺失或重复片段虽然>10 Mb,但是重复的片段易位到了缺失的染色体上,片段大小接近且条带类似,因此核型分析难以辨别,容易漏诊此类患儿。
另外,Low Pass WGS无法检测出染色体平衡性重排,本资料核型分析检测出2例胎儿9号染色体臂间倒位,考虑为染色体多态性变异,1例inv(9)(p12q21)mat同时行Low Pass WGS检测未提示异常CNV。核型分析和Low Pass WGS两者联合检测可以较全面评估染色体结构变异的情况,如果有条件产前诊断时建议采用两种检测方法。有报道NT增厚胎儿中检测出9号染色体臂间倒位和9号与11号染色体片段平衡易位各1例[14],结合本资料结果考虑与9号染色体臂间倒位在人群中的发生率相对较高有关。另外,虽然胎儿检测结果为染色体多态性变异,无异常临床表型,但其后代容易发生染色体部分片段缺失和重复,导致生殖异常,遗传咨询时要注意。
总之,NT 2.5~3.4 mm的胎儿中有2.1%存在致病性CNV,合并结构异常组、NT 3.0~3.4 mm组和高龄孕妇组胎儿出现染色体非整倍体异常的概率更高。

