妊娠合并嗜铬细胞瘤误诊1例及相关文献复习
孙建华 王夙斐 易村犍
病例简介
患者,女,25岁,初产妇,因妊娠25+2周出现间断性抽搐并伴有头晕、视力模糊来院就诊。患者平素月经规律,孕4月余时自觉胎动。追问病史患者妊娠2+月于外院就诊产前检查发现血压146/92 mmHg,无明显不适,未接受药物治疗。一直未行规律性的产检,于1周前有眼睑水肿,伴有头晕、头痛,随后出现视力模糊,就诊眼科行相关检查。于次日晚出现恶心呕吐,并伴有意识和视力丧失,间断性抽搐,急诊来院,测血压246/163 mmHg,检查:T:37 ℃,P:156次/分,R:25次/分,BP:191/129 mmHg。患者烦躁不安,检查欠配合,意识模糊,心脏听诊心率增快,肺部未及明显异常,肝脾肋下未及,全腹无压痛及反跳痛,双下肢水肿(+);产检:腹隆,经腹壁可扪及明显宫缩,宫底脐上一指,胎心180次/分。入院诊断:1.孕1产0孕25+2周待产 2.慢性高血压合并子痫 3.视觉障碍:视网膜脱落?4.宫内胎儿窘迫?完善相关检查:查甲状腺功能未见明显异常,免疫检查:高敏肌钙蛋白:127.6 pg/I BNP:146 pg/mL。生化检查:PA:127.6 mg/L,TP:87.4 g/L,GLB:43.3 g/L,AST:43 U/L,ALP 131 U/L,LDH:428 U/L,TC:8.75 mmol/L,TG:3.46 mmol/L,UA:627.2 μmol/L,尿蛋白(++)。急诊产科彩超示:胎儿双顶径(BPD):65 mm,股骨长(FL):46 mm,脐动脉收缩期/舒张期速度比(S/D):4.0,胎心:186次/min,宫内妊娠,如孕24+周,单活胎。入院后按照子痫处理,立即给予安定、杜冷丁50 mg肌注,同时给予硫酸镁解痉、降压、20%甘露醇降低颅内压等对症支持处理。急请心内科、眼科、神经内科以及新生儿科医师会诊,并给予相应的对症处理。由于病情危急,建议适时终止妊娠并做好新生儿抢救工作准备。待抽搐控制后立即行剖宫产术,娩出一活女婴,胎儿娩出后重度窒息,经清理呼吸道、断脐后交于台下新生儿科医师,立即再次给予清理呼吸道、保暖、面罩加压给氧等,出生后1分钟和5分钟,Apgar评分为3分和4分,家属要求放弃抢救。术后病人转入ICU进一步治疗,血压波动在135~191/70~129 mmHg。彩超提示左侧肾上腺高回声团,为了进一步明确诊断,于术后10 d转诊泌尿外科,查 24小时尿VMA:25.41 mg/24 h,皮质醇(8AM)16.81μg/dl,醛固酮卧立位实验(+)。MRI示:左侧肾上腺富血供占位性病变大小约为43.2×38.0×37.1 mm(如图1示)。术前使用哌唑嗪和硝苯地平控制血压,产后11天在全麻下行腹腔镜下左肾上腺肿瘤切除术,切除大小约5×4 cm的一肿物(如图2示)。组织病理结果提示左侧肾上腺PHEO,免疫组化显示阳性(如图2示)。术后10天患者恢复良好出院,随访半年,未有不适。

图1 患者的嗜铬细胞瘤的CT和MRI图像。图A:嗜铬细胞瘤患者的CT:左侧肾上腺可见大小约43.2×38×37.1 mm团块(箭头所示为嗜铬细胞瘤); 图B:嗜铬细胞瘤动脉显影期MRI(箭头所示);图C:本例患者嗜铬细胞瘤静脉显影期MRI(箭头所示)
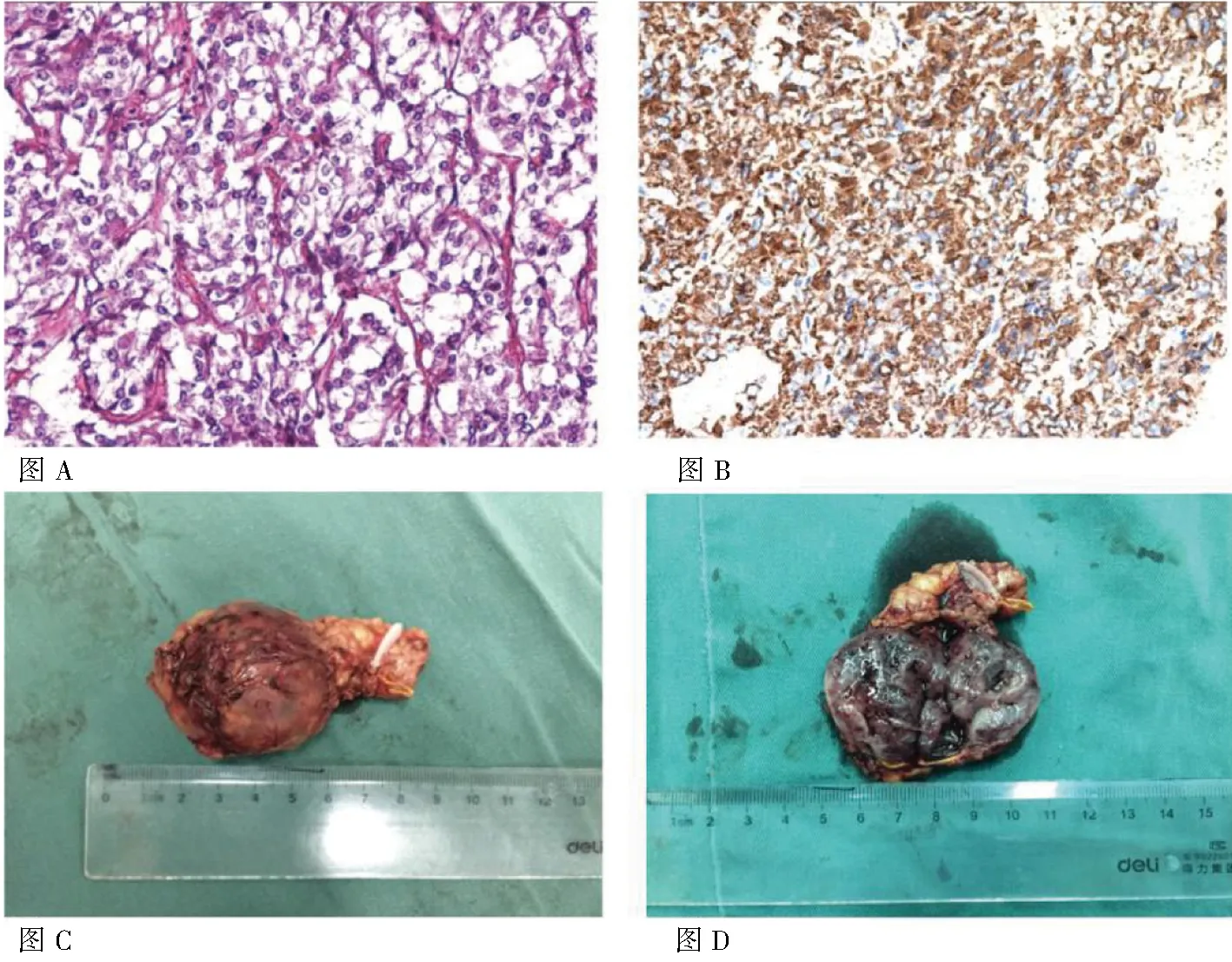
图2 患者嗜铬细胞瘤离体组织及组织的病理和免疫组化图: 图A:嗜铬细胞瘤的病理图:细胞呈椭圆形或圆形,形态呈团状,索状,排列整齐,胞浆丰富,核增大,深染,可见核仁,核分裂像:间质可见裂缝样小血管(HE染色×200); 图B:嗜铬细胞瘤组织免疫组化图:胞浆颗粒状,呈棕褐色(CgA染色×200); 图C:嗜铬细胞瘤离体组织正面观(约5cm×4cm); 图D: 嗜铬细胞瘤离体组织矢状切面观(约5cm×4cm)。
讨论
1. PHEO特征及相关鉴别诊断。嗜铬细胞瘤(pheochromocytoma,PHEO)是源于肾上腺髓质嗜铬组织分泌儿茶酚胺的肿瘤,该病发病年龄在20~50岁之间,具体发病原因未明确,家族性的则与遗传有关。PHEO占高血压疾病的0.2~0.4%,可导致严重或致命性的高血压危象[1]。PIP比较罕见,妊娠期患病率约为0.0002%[2],典型的临床表现为阵发性或持续性高血压伴有头痛、出汗和心动过速三联征[3]。临床上多数病例症状不典型,缺乏特异性,易于HDP相混淆。子痫前期是妊娠期高血压疾病(hypertensive disorder complicating pregnancy,HDP)常见的类型,所以妊娠期出现高血压疾病最初通常被诊断为子痫前期[4]。妊娠合并嗜铬细胞瘤(pheochromocytoma in pregnancy,PIP)对母体及胎儿存在潜在危害,PIP与子痫前期和子痫的鉴别诊断,见表1。通过PubMed搜索确定2010年—2019年国外PIP患者最初诊断为子痫前期的相关病例,总结见表2。

表1 PIP与子痫前期以及子痫的鉴别诊断

表2 2010—2019年国外被误诊子痫前期的病例汇总
2. 临床辅助诊断。PHEO的诊断可分为定性和定位诊断。定性诊断可通过检测血浆和(或)尿24 h肾上腺素和/或去甲肾上腺素类物质的水平。一旦怀疑PHEO,首先应该检测血和24 h尿肾上腺素和去甲肾上腺素水平[14]。本例患者24 h尿肾上腺素增高,皮质醇(8AM)正常。MRI和超声检查是PIP患者肿瘤定位中的首选影像学检查[15]。产科医生一般使用腹部超声进行检查,但是由于超声检查对较小肿瘤缺乏敏感性,而且在孕晚期易受增大子宫的影响,故MRI检查被认为是孕产妇肿瘤定位首选,其灵敏度和特异性分别达90~100%和70~80%[16-17]。研究者[3]曾在报道中称,含有钆增强的MRI可作为孕妇影像检查的首选。然而钆在妊娠期使用的安全性目前还无法确定,所以建议妊娠期最好避免使用含有钆增强的MRI检查[18]。由于CT成像对胎儿有辐射作用,所以不被用作妊娠期影像学检查[19]。对于高度怀疑有遗传突变或遗传综合征的情况,应该考虑进行基因检测[16]。
3. 术前药物治疗。目前国内外对于该疾病的治疗管理主要基于专家意见以及相关的文献报道。术前使用肾上腺素能阻滞剂可以降低围手术期和术后并发症的风险[19]。术前用药主要包括α肾上腺受体阻滞剂和β肾上腺受体阻滞剂[19]。目前临床上应用的较多的长效α受体阻滞剂,主要包括苯氧卞胺和多沙唑嗪。苯氧卞胺属于非竞争性α-1和α-2受体阻滞剂,多沙唑嗪属于竞争性的α-1受体阻滞剂。苯氧苄胺通常开始剂量为10 mg/次,每天2次,后期剂量为每天1 mg/kg;多沙唑嗪开始剂量为每天2 mg,然后增加到每天16 mg~32 mg[19]。因苯氧卞胺为长效的α受体阻滞剂,所以容易引起反射性的心跳加速和术后长期的低血压风险[19]。β受体阻滞剂常用的药物为心得安和美托洛尔,其目的是治疗心律失常和α-肾上腺受体阻滞剂可能引起的相关的反射性的心动过速[20]。β受体阻滞剂不能够单独使用,通常在使用α受体阻滞剂数天后,开始使用β受体阻滞剂,可达到更好的临床效果[21]。另外,钙离子拮抗剂可以作为降压药的第二选择[22],在患者无法忍受单独使用肾上腺受体阻滞的副作用时,可以联合肾上腺受体阻滞剂一起使用替代降压[23]。本例患者术前使用哌唑嗪和硝苯地平联合降压,手术顺利。硫酸镁在PHEO和子痫前期治疗中起到积极的作用,在子痫前期,硫酸镁可以降压,又起到预防子痫的作用;在PHEO治疗中,硫酸镁可以抑制儿茶酚胺受体释放儿茶酚胺,并可以舒张血管[21]。
4. 肿瘤的切除方式及时间。手术是PIP的最终治疗方法[24],腹腔镜下肾上腺肿瘤切除术是妊娠中期首选[25]。上述总结的12例病例中,有5例接受了腹腔镜手术,手术效果良好。手术时机的选择主要取决于胎龄、肿瘤的位置和母婴对药物治疗的反应[24]。在一项系统回顾中显示,56例患者中18例在产前切除肿瘤,所有的母亲和胎儿均存活[26]。肿瘤在妊娠<24周确诊的,在药物治疗控制血压和心率后,手术可以在24周前的妊娠中期进行,因为妊娠前三个月进行手术容易造成流产[19]。在≥24周确诊的,由于解剖条件不利于手术的进行,在用药控制有效的情况下,建议推迟手术时间到胎儿成熟娩出时或娩出后[27]。如果出现血流动力学不稳定以致危及母胎生命时可随时终止妊娠。目前国内外的报道对于肿瘤大小决定手术时机暂无相关定论,肾上腺肿瘤的恶性风险随着肿瘤的大小而增加[16]。有研究者认为肾上腺肿瘤>7 cm时,应尽量避免使用腹腔镜手术[28],因为当肿瘤大小≥5 cm时,可能是引发恶性肿瘤高危因素之一[29]。搜索的病例中有4例肿瘤大小>7 cm,其中2例开腹手术,1例腹腔镜手术,均未发现恶性情况。本例患者肿瘤大小<7cm,产后在腹腔镜下切除肿瘤,术中血压控制良好,术后无并发症。
5. 胎儿分娩方式。PIP的胎儿最佳分娩方式目前未达成共识。剖宫产相对阴道分娩是一种可控性的分娩方式[19]。然而,最近也有报道几例阴道分娩成功的病例[30],但是多数情况下剖宫产仍是安全分娩的首选方式[19]。根据分析总结的12例误诊的病例中有1例阴道分娩,母婴结局良好。但是在妊娠24周前诊断出肿瘤并同时被切除,则阴道分娩和剖宫产术皆可[3]。手术和麻醉也会刺激儿茶酚胺的增高,从而导致一系列的危及生命的并发症,所以麻醉管理在胎儿分娩过程中相当重要。本病患者选择的是剖宫产术,产后腹腔镜下肿瘤切除术。
6.对母体和胎儿的影响。PHEO对母体和胎儿有潜在性的危害,可能导致母亲和胎儿严重甚至致命性的心血管并发症。在母体主要表现在PHEO分泌的大量的儿茶酚胺作用于心血管系统和神经系统,可以诱发心肌病,表现为肌型心力衰竭、心源性休克或者急性冠状动脉综合征[31],高血压危象、晕厥、休克等,神经系统主要表现在脑梗等。PHEO对胎儿影响主要表现在儿茶酚胺可以引起母体子宫动脉循环血管收缩,因为子宫胎盘没有自我调节能力,直接受产妇血压的影响[32],可引起自然流产、胎儿生长受限、胎儿宫内缺氧和胎死宫内等情况[3];另外阵发性高血压可以导致胎盘早剥,反跳性的低血压又可以导致胎儿宫内缺氧和不良的胎儿结局[21]。研究报道[4]的病例其中1例出现胎盘早剥,导致胎儿宫内死亡。本例患者也出现胎儿宫内窘迫。
结论
PIP比较罕见,大多数病例症状和体征缺乏特异性,所以临床上易与HDP相混淆。产前及时确诊,可以大大降低母婴死亡率[26]。但是产前出现漏诊误诊时,母婴死亡率上升到48%和54%[33]。使用PubMed搜索回顾了2010年—2019年国外部分PIP入院初诊断为子痫前期的病例12例,产前确诊的6例[4,8,10-13],其中5例母婴结局良好,研究者曾报道[4]1例因PHEO分泌的儿茶酚胺过高出现胎盘早剥导致胎儿宫内死亡。分析产前确诊的病例发现,大多数病例以高血压为最初的症状,多数临床表现不典型,入院诊断为先兆子痫,给予降压对症治疗,血压仍不稳定,进一步多学科合作,检查发现原发病灶,及时制定个体化治疗方案,从而提高了母婴生存率;而产后确诊的病例胎儿的死亡率高达50%,6例中有3例在妊娠中晚期以重度高血压入院(血压波动在180~230/120~170 mmHg),伴有心率过快、视网膜病变,治疗过程中血压不稳定,由顽固性高血压演变为高血压急症,分析其原因为产科医生未能及时将PHEO纳入鉴别诊断,导致情况进一步加重,立即终止妊娠,新生儿结局不良。针对原发灶切除手术的切除方式以及最佳时间,目前没有统一定论。对于PIP的首选治疗方式是腹腔镜下肿瘤切除术[25],上述病例中5例接受了腹腔镜手术,手术效果良好。不良结局的有3例,新生儿胎龄≤33周,母体在使用降压药物后,血流动力学仍不稳定,甚至出现胎儿宫内窘迫[12],最终急诊剖宫产,导致新生儿死亡。
本例患者是妊娠期合并PHEO并发子痫的病例,从目前报道过的文献中比较罕见,病人症状特殊,在妊娠25+2周出现抽搐伴有视网膜脱落,临床上很容易漏诊误诊。从这些病例中得到的教训,孕早期规律产检、及时的确诊、多学科之间的合作以及个体化的治疗能有效提高母儿生存率。术前的血流动力学和围手术期麻醉管理可以改善母婴结局。而广泛的鉴别诊断和对诊断线索(病史)的重视是正确诊断和成功病例管理的关键。

