黄河三角洲滨海湿地微生物多样性及其驱动因子
李金业,陈庆锋,2,*,李 青,赵长盛,冯 优,李 磊
1 齐鲁工业大学(山东省科学院)山东省分析测试中心, 济南 250014 2 山东师范大学地理与环境学院, 济南 250014
滨海湿地是陆地和海洋生态系统之间的过渡带,具有生物多样性高、生态敏感性强等特点[1]。微生物是湿地环境和有机物分解的重要组成部分,它可以改变湿地土壤的理化特性,在土壤有机质动态、能量传递和元素生化循环等方面起着重要作用[2]。同时,湿地微生物多样性高对于土壤生态系统的稳定和服务功能的提高具有不容忽视的作用,将有助于提高微生物种群的遗传多样性[3],并对提高物质的营养循环和重要生态系统过程的效率有积极的影响[4]。近年来,湿地土壤微生物群落结构和功能的重要性越来越受到关注[5]。
黄河三角洲滨海湿地不仅是我国暖温带地区最年轻、最完整、面积最大的湿地之一[6],也是世界上陆地-海洋相互作用最活跃的区域之一,在湿地生物多样性保护和水质净化中发挥着重要作用[7]。由于围垦、海岸侵蚀和石油污染等人为干扰,滨海湿地正经历着持续而严重的退化,面积不断减小[8]。微生物对环境变化非常敏感,这些破坏效应会影响湿地土壤微生物的群落组成。反过来,湿地土壤微生物的变化又会导致湿地生态系统的整体结构和功能发生变化[9]。湿地植物与土壤环境因子相互作用,对土壤微生物群落及功能多样性产生影响[10]。滨海湿地土壤养分含量低、透气性差,植物、土壤微生物多样性均不高,尤其是原生盐碱土壤中的微生物群落多样性更低[11]。目前已有研究揭示了黄河三角洲湿地的植被格局分布,以及不同类型植被恢复对土壤性质和植被多样性的影响[12-13]。湿地植物可以通过提供凋落物中的营养物质直接影响土壤微生物的功能[14],根际分泌物会改变氧化还原电位、pH值等根际环境,间接决定根际微生物种类和数量[15],植物根际铁锰氧化膜与细菌群落结构也存在某种关联。有关黄河三角洲滨海湿地微生物群落多样性与植被关系的研究直到20世纪90年代才逐步开展[16-17],植物群落和环境因子对湿地土壤微生物影响的研究越来越得到关注。
本研究以黄河三角洲滨海湿地表层土壤和植物根际为研究对象,通过高通量测序技术对土壤和植物根际中的微生物进行了初步研究,旨在揭示植被根际微生物与土壤微生物的结构和丰度特征,分析微生物群落与土壤环境因子之间的内在关系,将为认识黄河三角洲滨海湿地的生物地球化学循环提供微生物生态学视角。
1 材料与方法
1.1 研究区概况
本研究以黄河三角洲滨海湿地为研究对象,研究地点位于黄河三角洲的中心区域(117°31′—119°18′E,36°55′—38°16′N)。该地区位于渤海湾南岸和莱州湾西岸,属于温带半湿润大陆性季风气候。研究区内主要为盐渍型土壤,受潮汐海水入侵影响,土壤盐渍化严重(高达70%),主要湿地植物为芦苇、碱蓬和柽柳。
1.2 样品采集
通过野外实地调研,2018年5月选取区域内代表性的翅碱蓬群落、芦苇与柽柳灌木混合植被群落、滩涂裸地、油田等13个采样点为调查对象进行采样(图1)。土壤样品采样时,首先去除土壤表层有机物和细根等杂质,然后按照5点取样法用铁锹采集20 cm × 20 cm 样方中表层(约0—25 cm)土样,每个采样点重复3次,共39个样品。为了研究植物对土壤微生物种群的影响,选择了4个优势种,即芦苇、柽柳、碱蓬和蒿,用铁锨挖出植物,收集根际土壤,共采集9个根际土壤样品(表1)。所有样品储存在采样袋后,放在液氮中冷却,然后送到实验室。每个样品分成两部分:一部分样品风干研磨后,分别过不同孔径的筛子用于土壤理化性质测定;另一部分在-80℃的环境中冷冻保存,送到北京博奥晶典生物技术有限公司测序。

表1 土壤采样点及生态系统状况

图1 黄河三角洲湿地监测点
1.3 土壤理化性质测定

1.4 土壤总DNA提取、PCR扩增及测序
选用 Fast DNA SPIN Kit for Soil 试剂盒提取土壤微生物基因总DNA,将提取得到的土壤DNA溶解于70 μL无菌TE缓冲液中,具体提取过程按照试剂盒说明书进行操作。电泳检测后,对16S rRNA V3+V4(细菌)区域进行扩增,细菌引物[18]序列为:338F 5′-ACTCCTACGGGAGGCAGCA-3′及806R 5′-GGACTACHVGGG TWTCTAAT-3′,使用Illumina Hiseq测序平台,利用双末端测序(Paired-End)的方法,构建小片段文库进行16S rRNA测序。
1.5 数据分析
通过对Reads拼接过滤,OTUs(Operational Taxonomic Units)聚类(97%),并进行物种注释及丰度分析,揭示样品的物种组成。通过α多样性的五个指数,包括Coverage,Simpson,Chao1,ACE和Shannon指数分析样本内的物种多样性,进一步对β多样性分析(Beta Diversity)和显著物种差异进行分析,挖掘样品之间的差异。本研究选择UPGMA(Unweighted Pair-group Method with Arithmetic Mean)分析物种组成相似度。
使用Microsoft Excel和Adobe Illustrator 16.0(Adobe Systems Inc., San Jose, USA)进行数据统计和绘制图形。通过Alpha多样性分析,统计了各样品的覆盖度、Ace指数、Chao1指数和shannon指数。使用QIIME软件进行β多样性分析来评估样品在物种复杂性方面的差异。利用SPSS19.0(International Business Machines Corporation, Armonk, USA)软件,采用主成分分析(PCA)和相关分析(CA)分析土壤理化性质间的关系,显著性差异定义为P<0.05。采用Canoco 5.0(Microcomputer Power, New York, USA)软件分析土壤理化性质与土壤细菌群落多样性之间的关系,识别影响湿地群落结构的主导因子。
2 结果与分析
2.1 土壤和根际微生物样品测序结果
通过双末端测序(Paired-End)并优化后,13个土样共获得853672条有效序列(Effective Tags),Effective Tags平均长度集中在411—421 bp之间,占PE Reads序列的86.28%,质量值≥30的碱基约占总碱基数的95.5%—96.08%。序列的长度和数量是将序列匹配到数据库从而产生基因注释的关键,保证了微生物物种多样性分析的科学性、真实性。13个土样中的微生物归属于27门、54纲、143目、282科、627属和705种,微生物多样性指数和覆盖率见表2。从表2可以看出,芦苇柽柳区(HW4-2)的OTU数最多,高于其他地区。微生物丰富度指数(Chao 1指数和ACE指数)表明芦苇柽柳生长区的微生物丰度高于滩涂裸地(HW1-1、YWS2和YWS6)、碱蓬区(HW6-1、YWS3)和棉田区(HW5-1),海漫滩(YWS2)中微生物丰度明显高于河漫滩(YWS6)和泥滩(HW1-1)。
香农指数(Shannon index)是反映样本微生物多样性的另一种表现形式,从图2和表2可以看出土壤样品中细菌的香农指数大约在4—5.5之间,而根际细菌香农指数范围约为0—4,说明土壤细菌群落结构和多样性均明显大于植物根际细菌。根际中OTU丰富度的下降归因于根际过程的均质化作用,从而减少了生态位。

图2 样品香农指数曲线

表2 微生物的多样性指数及覆盖率
2.2 微生物群落结构组成分析
在所有湿地土壤样本中,土壤微生物表现出较高的多样性(图3)。样本的门水平分类中丰度前十的物种组成基本一致,主要包括变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria)、蓝藻菌门(Cyanobacteri)、疣微菌门(Verrucomicrobia)、绿弯菌门(Chloroflexi)、浮霉菌门(Planctomycetes)、酸杆菌门(Acidobacteria)、软壁菌门(Tenericutes),其中,细菌分布以厚壁菌门、变形菌门、拟杆菌门和放线菌门为主,这四种细菌门在各样本中合计占比高于90%,这可能表明了它们在湿地中的稳定性,这与之前变形杆菌门在黄河口数量最多的研究结果[19-20]不同。与土壤微生物相比,根际微生物的优势菌群发生了变化(图3),以蓝藻门细菌为主,丰度较高的菌群还有变形菌门、放线菌门和厚壁菌门,和占比约为总菌群的90%,特有的细菌为Patescibacteria。

图3 样品中细菌群落门水平上的相对丰度
图4为基于Beta多样性分析得到的UPGMA聚类树与属水平上细菌丰度的结合图。在聚类树中,样品越靠近,枝长越短,表示两个样品的物种组成越相似。在土壤细菌群落结构中,YWS3和HW5-1与其他采样点细菌结构差异性最大,YWS3中的细菌丰度排名前10的物种较少,HW5-1以Coffea_arabica_coffee为主。HW1-1与YWS2物种组成相似,但与YWS6物种组成相似性较远。油井附近采样点微生物结构也不同,YWS1细菌分布均匀,而Uncultured_bacterium_f_muribaculaceae在YWS5中丰度较高。丰度检测前10的属包括Lactobacillus(乳酸菌属)、Uncultured_bacterium_f_muribaculaceae、Rhodococcus(红球菌属)、Bifidobacterium(双歧杆菌属)、Coffea_arabica(咖啡属)、Thauera(索氏菌属)、Ruminococcus(瘤胃球菌属)、Ochrobactrum(苍白杆菌属)、Flavobacterium(黄杆菌属)、Escherichia_Shigella(埃希氏杆菌属),主要是属于厚壁菌门和酸杆菌门。植物根际细菌中,HW3-15P1与HW2-15P1的种群结构相似,以Lolium_perenne为主,而其他根际细菌结构以Coffea_arabica_coffee为主。丰度检测前10的属主要包括Coffea_arabica_coffee、Lolium_perenne、Pseudoalteromonas(假交替单胞菌属)、Oryza_meyeriana、Vibrio(弧菌属)、Streptomyces(链霉菌属)、Photobacterium(发光杆菌属)、Pseudomonas(假单胞菌属)、Marinomonas(海单胞菌属),主要是属于蓝藻门、变形菌门和放线菌门。

图4 属水平上UPGMA聚类树与柱状图组合图
黄河三角洲湿地微生物丰度和结构的差异性主要表现在同一生境类型不同采样点间微生物物种差异、不同生境类型下微生物物种差异及同一采样点植物根系与土壤中微生物的差异。HW1-1、YWS2、YWS6为漫滩地,有少数植被覆盖,细菌门水平上的丰度大小顺序依次为厚壁菌门、变形菌门、拟杆菌门、放线菌门、蓝藻门,YWS5为油田附近滩涂,其细菌丰度依次为拟杆菌门、变形菌门、放线菌门、厚壁菌门和蓝藻门。柽柳区(HW4-1、YWS4)与植被混合区(HW2-1、HW3-1、HW4-2)菌门丰度相近,依次为厚壁菌门、变形菌门、放线菌门、拟杆菌门和蓝藻门;翅碱蓬覆盖区的优势菌群丰度差异较大,翅碱蓬(YWS3)中变形菌门和拟杆菌门的丰度高于HW6-1,厚壁菌门、放线菌门和蓝藻门的丰度则低于HW6-1;棉田(HW5-1)以蓝藻菌门的产氧光细菌纲为主,次优势类群为厚壁菌门、变形菌门和放线菌门,这一现象与植物根系的菌群结构极其相似。
2.3 土壤环境因子与土壤微生物群落结构的相关性分析
2.3.1土壤环境影响因子及其相关性分析


表3 不同土壤的主要环境参数
2.3.2土壤环境因子与微生物群落多样性的相关性分析


表4 土壤环境因素的相关系数矩阵
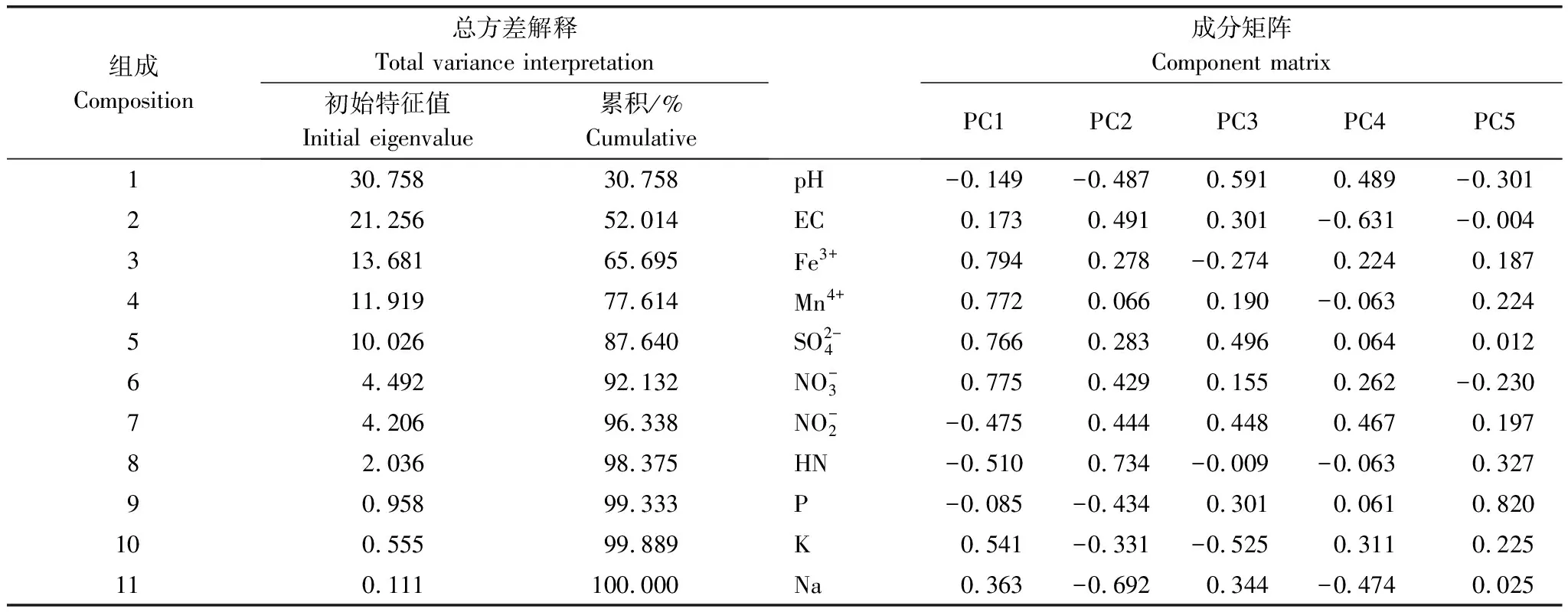
表5 土样的主成分分析和因子载荷


图5 门和属水平细菌群落结构与环境变量的RDA排序图
3 讨论
3.1 土壤和根际微生物群落结构特征
湿地土壤具有较厚的有机质层,其温度和氧含量比其他类型的土壤更稳定,使得湿地细菌群落具有相对稳定的组成以保证其生态功能,这就解释了不同类型的湿地土壤中菌群结构的相似性[23]。在门和属水平上,微生物群落存在差异,土壤中细菌以变形菌门、厚壁菌门、拟杆菌门为主,但在不同类群中仍存在明显的类群丰度差异,如HW5-1中蓝藻菌门的丰度较高,YWS3中变形菌门的丰度较高,YWS5中拟杆菌门的丰度较高。同时,细菌的丰度和结构还受到植被的影响,植物多样性可以用来预测土壤微生物群落的多样性。黄河三角洲典型的芦苇区、柽柳区、碱蓬区及漫滩裸地中菌群丰度表现出明显的差异。根际中丰度较高的细菌包括蓝藻门、变形菌门和放线菌门,其中蓝藻门的平均丰度达到50%以上。

3.2 微生物群落与环境因子的相关性


4 结论
本研究利用高通量测序技术研究了我国黄河三角洲滨海湿地土壤和植物根际细菌群落的丰度和结构,揭示了环境因子与湿地土壤中微生物群落结构组成的内在联系,主要结论如下:
(1)湿地土壤和植物根际中优势菌群结构存在差异。土壤细菌分布以厚壁菌门、变形菌门、拟杆菌门和放线菌门为主,在各样本中合计占比高于90%;根际细菌丰度较高的为蓝藻门、变形菌门、放线菌门和厚壁菌门,土壤微生物的丰度和多样性显著大于根际细菌,在属水平上土壤和植物菌群结构的差异更明显。
(2)裸地、芦苇、柽柳和碱蓬等不同生境类型条件下细菌的物种组成存在差异。微生物丰富度指数表明芦苇柽柳生长区的微生物丰度高于滩涂裸地、碱蓬区和棉田区,海漫滩中微生物丰度明显高于河漫滩和泥滩。

本研究有助于了解黄河三角洲滨海湿地土壤和植物根际的细菌分布特征,研究微生物不同功能之间存在的内在联系,维护三角洲湿地生态系统稳定性、生物多样性和遗传多样性。

