不同水盐环境下荒漠植物群落抗逆性化学性状的种间、种内变异
叶丽克·吐斯甫江,张雪妮,*,贡 璐
1 新疆大学资源与环境科学学院, 乌鲁木齐 830046 2 绿洲生态教育部重点实验室, 乌鲁木齐 830046
植物功能性状直接影响植物个体生长全过程[1-2],它是植物在世代更新进程中,利用特定生态策略适应外界环境的结果[3]。随着外界环境的改变,植物功能性状会产生不同程度的变异[4- 6],根据功能性状变异解释植物的适应性机制,能够更充分地反映植物对环境变化和资源竞争的响应对策。
不同环境下植物群落功能性状的变异由种间变异、种内变异及二者的相互作用引起。物种组成变化导致群落产生种间变异,种间变异越高表示物种更新越多,表明植物群落对环境的抵抗力越低;而种内变异来源于遗传多样性和表型可塑性,种内变异对群落性状的贡献率越高意味着植物种的适应性越强[6]。过去许多基于性状的研究,仅用少数个体的性状均值代表物种的性状[7],忽略了种内变异对群落功能性状变异的影响。然而,近年来越来越多的研究认为,不同环境影响下的群落性状变异中,种内变异的相对贡献高于种间变异[8-9],特别是在稀疏群落,种内变异更应受到重视[10]。因此,在研究群落功能性状对环境的响应时应同时考虑种间与种内变异。
叶片作为植物与外界接触面积最大、对环境变化较为敏感的器官[11],是进行光合作用和物质生产的主要场所[12],植物通过改变叶片的化学、生理、形态特征适应环境变化[13-14]。K、Ca、Mg作为植物体必须元素中的大量元素,对其生长、发育发挥重要作用,如K在细胞渗透压调节与缓解Na盐毒害中不可或缺[15];Ca在提高植物耐盐性、抗旱性和抗逆性方面均有一定作用[16];Mg是叶绿素的成分之一,在光合作用过程中必不可缺。Na虽并非植物必须但在植物对逆境的适应中具有重要作用,如盐生植物种通常利用Na+调节渗透势,促进细胞吸水等[17]。因此,植物体内的K、Ca、Mg、Na水平与植物对干旱、盐胁迫等的抗逆性紧密相关,甚至有研究认为Ca、Na、Mg在沙生植物体内含量比N、P高[18]。植物叶片K、Ca、Mg、Na含量与土壤环境息息相关[19],特别是在土壤水分与盐分变化可能形成的逆境中。例如,受到干旱胁迫的小麦叶片细胞质和细胞膜中的Ca2+浓度增高[20];盐胁迫环境中,植物外部水势降低,水分吸收受到影响,从而导致胞浆中Na+增多;此外,盐胁迫促使K+进入细胞浆,降低Na+/K+的比值[21]。尽管叶片功能性状与土壤环境的关系已被广泛关注,但对与植物抗逆性密切相关的K、Ca、Na、Mg等性状的研究鲜有报道,特别是在逆境普遍存在的干旱区荒漠生态系统开展植物抗逆性功能性状种间、种内变异及其对土壤环境变化响应的研究更为少见[22]。
艾比湖湿地国家级自然保护区位于我国西北干旱区的新疆准噶尔盆地西南缘,该区分布有典型的荒漠植物群落。前期研究表明该区植物分布对土壤水盐环境有显著响应,且各植物种营养含量也有较大差异[23],但对荒漠植物群落抗逆性功能性状的种间、种内变异及其与土壤环境间的关系尚不明确。因此本文拟在明确艾比湖荒漠植物叶片的群落水平K、Ca、Na、Mg性状的种间、种内变异格局基础上,分析其与土壤水盐及矿质元素的关系,试图回答:(1)不同水盐环境下植物群落水平K,Na,Ca,Mg的种间、种内变异如何变化?(2)群落性状的种间、种内变异与土壤环境因子之间的关系是否随着水盐环境变化而改变?进而探讨荒漠植物对环境的适应策略,以期为科学管理和保护荒漠植被提供理论依据。
1 研究区域和方法
1.1 研究区概况
艾比湖湿地国家级自然保护区位于新疆准噶尔盆地西南缘(44°30′—45°09′N,82°36′—83°50′E),是盆地的水盐汇集中心[24-25]。研究区所在区域降水稀少(<106 mm/a),蒸发率高(>1300 mm/a),属于典型的大陆性干旱气候。区内土壤类型主要为灰漠土、灰棕漠土和风沙土[26]。研究区内的阿奇克苏河位于湖区东侧,是艾比湖的水源之一。河岸土壤水分和盐分含量较高,并随着离河距离增加逐渐降低,距河不同距离表现一定差异。区内植物组成随离河远近改变,靠近河道主要植物种类为灌木铃铛刺(Halimodendronhalodendron),草本植物小叶碱蓬(Suaedamicrophylla)、甘草(Glycyrrhizauralensis)、平卧碱蓬(Suaedaprostrata),远离河道则主要分布灌木艾比湖沙拐枣(Calligonumebinuricum)、木碱蓬(Suaedadendroides)、盐节木(Halocnemumstrobilaceum),草本植物刺沙蓬(Salsolaruthenica)、沙蓬(Agriophyllumsquarrosum)、对节刺(Horaninowiaulicina)、猪毛菜(Salsolacollina)[27];两种环境的共有种为乔木胡杨(Populuseuphratica)、柽柳(Tamarixramosissima)与梭梭(Haloxylonammodendron),灌木骆驼刺(Alhagisparsifolia)、罗布麻(Apocynumvenetum)、白刺(Nitrariasibirica)、琵琶柴(Reaumuriasoongorica)、盐穗木(Halostachyscapsica)、盐爪爪(Kalidiumfoliatum),草本植物花花柴(Kareliniacapsica)及芦苇(Phragmitesaustralis)。
1.2 野外采样
于植物生长季在艾比湖湿地国家级自然保护区内进行野外调查。垂直于阿其克苏河建立三条间隔5 km的样带,各样带土壤水盐含量随离河由近到远逐渐降低。每隔500m在样带上设置一个10 m×10 m的样方,共32个样方。在调查样方过程中,记录每个样方中心点的地理坐标,以及样方内出现的物种种数与各物种个体数。采集样方中主要植物种(频度>3%)的叶片样品,选取无病虫害的完整成熟冠层叶片,带回实验室,用于测定叶片K、Ca、Na、Mg含量。样方调查前,在样方裸地任意五点取0—15 cm的土壤样品,混合均匀,利用TDR(Spectrum Technologies Inc., Plain field, IL)在取土点周围测定土壤容积含水量(SVWC)。土壤样品采集后放入自封袋中,带回实验室。
1.3 实验室分析
植物叶片样品于75℃烘干、粉碎。土壤样品自然风干后全部过孔径0.15 mm的土壤筛,装入自封袋中供测试使用。各土壤样品测定三次后取其平均值作为本次分析的数据。K、Ca、Na、Mg含量测定利用原子吸收光谱法(HITACHI Z—2000)[28]。土壤pH值利用酸度计法(PHS- 3C,上海仪电科学仪器股份有限公司,上海,中国)测定,土壤电导率(EC)采用电导率仪(DDS- 307,上海仪电科学仪器股份有限公司, 上海, 中国)测定,土水比均为1∶5[29]。
1.4 数据分析
1.4.1土壤高、低水盐环境划分
基于野外和室内测得的土壤水分与电导率值,运用R语言stats包聚类分析方法(k-means)将32个样方划分成低水盐环境(n=21; SVWC=2.47%; EC=2.39 mS/cm)和高水盐环境(n=11),高水盐环境中1个样方数据不完整被剔除(n=10; SVWC=16.14%; EC=15.00 mS/cm),不同土壤水盐环境间差异极显著(P<0.01)。
1.4.2群落功能性状及其种间、种内变异
群落水平叶片K、Ca、Na及Mg由群落加权性状(CWM)计算。CWM利用物种相对多度及其性状值计算,计算公式为[23]:
其中,Pi为物种i的相对多度,ti为物种i的性状,S为样方中的物种个数。
根据Lepš提出的方法,上述各指标的CWM是由性状的种间变异及种内变异共同决定的。其中种间变异是由各水盐环境中物种在所有样方内平均性状值与其相对多度计算的CWMF,CWMF表示仅由种间变异影响时的群落加权性状。种内变异则由各样方的CWM与CWMF之间的差值表示,记为CWMI,CWMI代表仅由种内变异影响的群落性状[4]。
性状种间、种内变异在不同水盐环境间的差异性分析由独立样本T检验分析。由于种内变异存在负值,因此通过离差标准化方法进行数据标准化,利用转化后的不同水盐环境群落种间、种内变异量,首先用去趋势对应分析(Detrended Correspondence Analysis, DCA)确定排序轴的梯度长度(LGA),分析得出不同水盐环境群落性状种间、种内的LGA均小于3,因此选择冗余分析(Redundancy analysis, RDA)方法获得两种水盐环境下种间、种内变异与土壤环境因子排序图。利用Pearson相关性分析求得性状种间、种内变异与土壤因子间的相关系数。以上分析均由SPSS 17及R语言软件“vegan”包完成;图形由Origin 2018制作。
2 结果与分析
2.1 土壤水盐环境与群落抗逆性化学性状差异分析
离河由近至远的两种环境土壤K略有上升(P=0.071),而土壤pH(P<0.01)、Ca(P<0.05)、Na(P<0.05)及Mg含量(P=0.089)均呈现不同程度的降低。
对于群落水平的抗逆性化学性状,叶片K、Na、Mg含量均随着土壤水盐下降而显著升高(P<0.01),相较高水盐环境分别增加92.91%,1174.47%,134.48%,Ca含量则表现出相反趋势,呈不显著下降(P>0.05)。
2.2 群落抗逆性功能性状的种间、种内变异及其在不同水盐环境间的差异
植物群落水平K、Ca、Na、Mg性状的种间、种内变异在两种水盐环境间的差异不同。叶片K、Na、Mg种间变异水平均随着水盐减少而显著升高(P<0.01),Ca则显著降低;对于种内变异,除叶片K显著升高外,其他性状的种内变异在两种水盐环境间均无显著差异(表1)。此外,各性状的种间变异大小在高、低两种水盐环境排列均为:Na>Ca>K>Mg,而种内变异排序在高水盐环境为:Na>K>Mg>Ca,在低水盐环境为:Na>K>Ca>Mg。

表1 不同水盐环境群落抗逆性性状种间、种内变异的变化规律(平均值±标准偏差)
2.3 群落化学性状种间、种内变异与土壤水盐的关系
RDA分析结果如图2和表2所示,前两个排序轴共解释了高水盐环境下89.02%以及低水盐环境下24.38%的叶片化学性状变异与土壤因子间关系。高水盐环境与第一排序轴相关性最高的主要为土壤EC、K,与第二轴相关性最高的是土壤Ca、Na,低水盐环境与第一排序轴相关性最高的为土壤Mg、Na,与第二轴相关性最高的是土壤K、EC。说明两种环境第一轴主要反映性状种间、种内变异在土壤EC、Mg等土壤因子上的变化,而第二轴主要反映的是土壤Ca、K等因子上的变化。综合前两轴,高、低两种水盐环境土壤EC、Na、K均为影响群落抗逆性化学性状的土壤因子,此外,低水盐环境中土壤SVWC也具有不可忽视的作用。
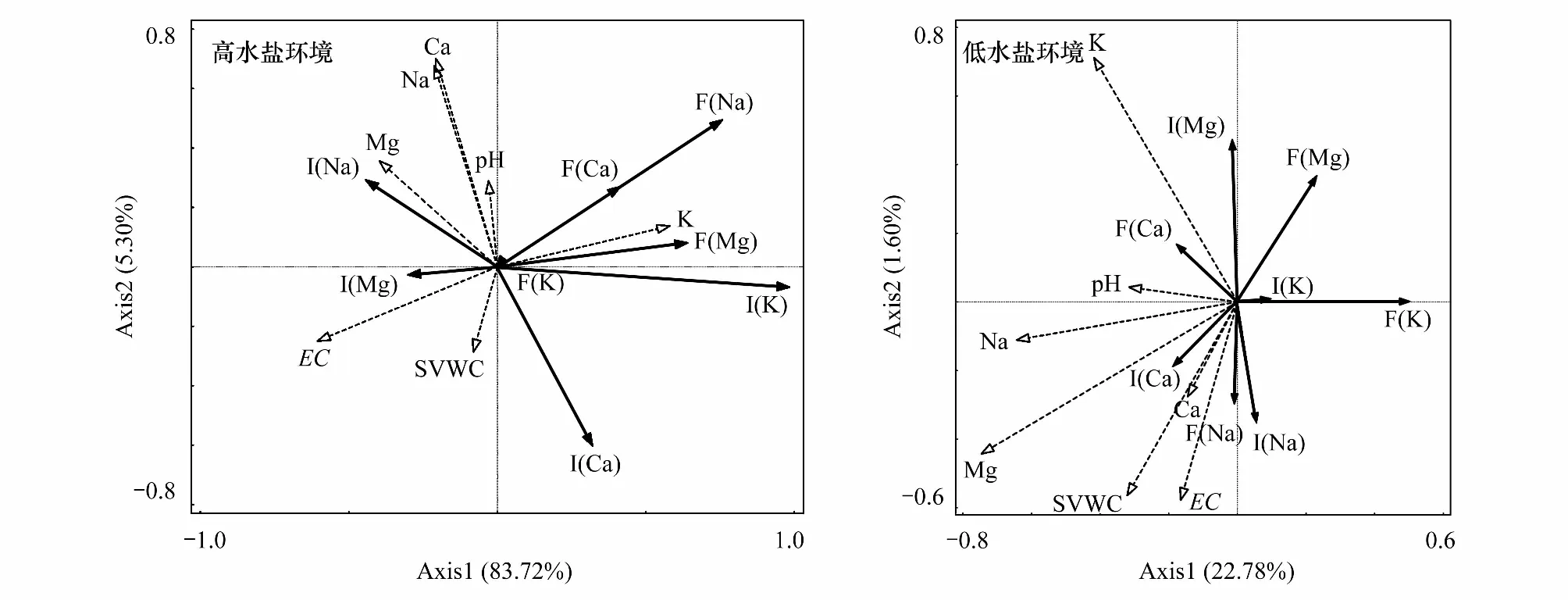
图2 不同水盐环境群落种间、种内变异与土壤理化因子的RDA分析Fig.2 A biplot for redundancy analysis showing the relationships between inter- and intraspecific trait variations and soil factors in different soil moisture and salinity植物功能性状变异和土壤环境之间的相关性:夹角角度为0°—90°之间时,两个变量之间呈正相关关系; 当夹角角度为90°—180°之间时,二者之间呈负相关关系; 当夹角角度为90°时,表示二者没有显著的相关关系;虚线箭头表示土壤理化因子,实线箭头表示性状种间、种内变异,其中F()表示种间变异;I()表示种内变异

表2 两种水盐环境群落性状变异与土壤因子冗余分析(RDA)中的环境变量解释率
通过结合RDA分析和相关性分析发现高水盐环境下,群落水平Ca、Mg的种间变异与土壤环境因子间普遍存在较高的(|r|>0.3)负相关关系;对于种内变异,土壤环境因子与叶片Ca的负相关及与Na的正相关关系较强(|r|>0.3),与其他各性状关系也以负相关为主。
低水盐环境下,群落功能性状种间、种内变异与土壤环境因子间的相关程度总体较高水盐环境降低;群落水平Na的种内变异与土壤EC、SVWC和Ca含量显著正相关,相关性逐渐降低(r分别为:0.64, 0.51, 0.44),叶片Mg的种间变异与土壤Mg、EC、SVWC、Na均为负相关,相关性依次降低(r介于0.3—0.5间)。其他群落水平化学性状的种间、种内变异与土壤环境因子间的相关性总体较低(|r|<0.3)。

图3 高、低水盐环境下种间、种内变异与土壤因子之间的相关性Fig.3 Correlation analysis between inter- and intraspecific trait variations and soil factors in two soil water and salt content environments
3 讨论
3.1 群落功能性状及种间、种内变异对土壤水盐的响应
化学、形态和生理性状的变异是植物生存策略变化的体现。当土壤水分与盐分发生改变,环境将通过筛选作用影响植物的生长和繁殖,植物利用表型可塑性调节功能性状,调整水分、养分吸收以及抗逆等策略,以适应不同环境。
荒漠植物群落水平K、Na及Mg含量随着土壤水分、盐分减少而显著升高(图1),表明植物群落为适应不同水盐生境条件而调整了生存策略。无机离子的积累是植物渗透调节的重要途径[30]。研究认为,加强对K+的吸收、积累能力,是植物抵抗干旱逆境的生存策略之一[31]。光合作用对水分胁迫较为敏感[32],随着胁迫程度加剧,为避免引起叶绿体的氧化损伤,植物需积累更多K+以维持光合作用,因此,叶片对K的高积累可以有效的抵御干旱胁迫[33]。此外,高水盐环境土壤中较高的Na+将影响植物对K+的吸收,从而降低植物叶片K含量,这可能导致低水盐环境叶片K含量显著高于高水盐环境(图2)。生长于高水盐环境的耐盐植物限制Na+进入体内,而低水盐环境中的耐旱植物通过提高Na含量增加其渗透势,从而保持较高的叶片含水量抵御干旱胁迫,因此低水盐环境叶片Na含量显著高于高水盐环境[18, 34]。植物吸收Mg的数量较K、Ca、Na少,这可能与植物对Mg的需求量较少、吸收能力弱有关[35]。Mg在植物光合作用中具有重要地位。低水盐环境群落水平Mg含量的升高可能预示着植物光合作用增强,碳水化合物合成增加,这可能是植物适应干旱胁迫加剧的生存策略之一。Ca2+是植物体内最普遍的胁迫信使,植物叶片Ca含量的变化主要与土壤条件有关[36],研究区低水盐区域土壤钙含量(18.7 g/kg)显著低于高水盐区域(27.8 g/kg),这与高水盐环境下群落水平Ca含量较高相符。此外,Chen等对胡杨研究发现,盐胁迫可促进Ca2+的吸收,这可能也是高水盐环境植物Ca含量较高的原因之一[37]。
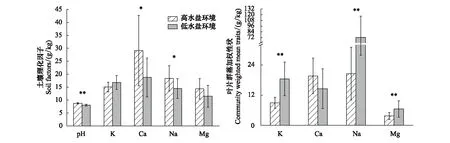
图1 两种水盐环境土壤理化因子及群落加权性状(*:P<0.05;**:P<0.01)Fig.1 Soil factors and community weighted mean traits in two soil moisture and salt content environments
已有研究表明,性状的高变异性通常与植物资源获取能力有关[38]。植物功能性状变异体现了植物对环境变化的适应能力差异。一方面,生境过滤作用选出一组与环境条件相适应的具有相似功能性状的物种,增强群落内物种性状的趋同性;另一方面,群落内同种植物个体间由于资源短缺造成种内竞争加剧,从而导致群落内共存物种发生相适应的种内变异[8]。不同物种对环境适应能力不同,致使群落内物种组成随环境变化而改变,造成功能性状种间变异。本研究中,随着土壤环境水分、盐分的降低,四种叶抗逆性化学性状的种间变异大多显著增加,这可能与不同水盐环境间物种组成的变化直接相关(高水盐环境植物种数:15种,低水盐环境植物种数:18种,两种环境共有种:11种)。土壤水分是荒漠植物生长、生存的重要因素[38],K、Na均与植物抗旱性有关,其种间变异在低水盐区域下增加可能与该环境旱胁迫加剧,部分抗旱能力较弱的植物如甘草(Glycyrrhizauralensis)等被淘汰而引起的物种组成变化有关[39]。Ca是一种重要的细胞膜保护物质,在提高植物耐盐性方面具有重要意义[16]。本研究中,两种水盐环境群落水平Ca含量均存在种间变异,但高水盐环境种间变异显著高于低水盐环境。高水盐区域群落通过选择盐穗木(Halostachyscaspica)等耐盐物种适应盐胁迫从而导致物种组成发生改变;而低水盐环境下干旱成为影响植物生存的主要胁迫[29],耐盐物种被耐干旱物种对节刺(Horaninowiaulicina)、猪毛菜(Salsolaarbuscula)等取代,从而导致群落物种组成做出适应性调整[24]。
种内变异是植物应对环境变化的重要响应机制[40],表征了植物对不同环境的最大适应能力,从根本上决定了植物的生态位宽度[41]。叶片K、Ca、Na的种内变异随水盐降低而升高,说明随着土壤水分的减少,群落为抵抗干旱胁迫,提高对恶劣环境的抵抗力[42],增加了物种K、Ca、Na含量的生态幅宽度。以上指标均与植物耐旱等能力有关,说明这些群落化学性状的改变可能是荒漠植物适应干旱胁迫加剧的一种重要机制。
3.2 土壤环境对群落功能性状种间、种内变异的影响
土壤因子是直接影响植物功能性状变异的关键因子[38,43-44],明析高、低两种水盐环境下植物功能性状变异和土壤因子关系的变化规律,可为预测环境变化情形下植物的适应策略提供理论依据和参考。
高水盐环境中,土壤盐分对种间、种内变异的影响达到显著水平(P<0.1),此外,其解释率反映了盐胁迫对物种及其耐盐性可能具有普遍的选择作用。研究发现,与土壤环境具有较高相关性(|r|>0.3)的种内变异少于种间变异。Siefert等对全球数据进行meta分析后发现,种内变异的高低取决于性状分类的组织尺度(例如个体水平与器官水平性状,生理与形态性状),而不是生活型和环境,这可能是研究区植物群落抗逆性性状种内变异与土壤环境间相关性较低的原因之一[10]。低水盐环境中,环境因子只解释了约24.38%的性状种间、种内变异,表明低水盐环境下研究区植物功能性状变异可能并非由环境因子单独决定,生物遗传、个体间相互作用、个体发育等因素的作用可能更大[45]。
分析表明,高、低两种水盐环境影响植物生长发育的主要限制因素分别为盐胁迫和干旱胁迫。高水盐环境中,土壤K与群落水平K种间变异呈负相关,与种内变异则呈正相关;低水盐区域,土壤SVWC与叶片K种间变异呈负相关,与种内变异则呈正相关。这均与胁迫诱导群落内表型变异假说一致,即恶劣的环境将导致群落种内变异增加,种间变异则减少[22]。这可能是由于恶劣环境的物种组成较为稳定,因此通过提高种内变异增加群落在高盐和干旱环境中的稳定性,降低物种灭绝风险[46]。
Ca是表征植物耐盐性、抗逆性的性状之一。高水盐环境下,高盐对物种组成的限制可能是群落水平Ca种间变异与土壤EC间呈负相关的内在原因。此外,高水盐环境中,群落Ca的种间变异与土壤pH关系较密切,这与Behera等人“盐胁迫下叶片Ca2+变化往往与环境pH有关”结论相符[47]。低水盐叶片Ca种间变异与土壤Ca呈负相关,这可能是由于低水盐环境土壤Ca显著降低且干旱胁迫下缺钙植株的含水量迅速下降导致[48]。
耐盐植物在高盐环境会减少对Na的吸收,而在干旱环境中增加体内Na含量。高水盐环境群落水平Na种间变异与土壤EC呈负相关,低水盐环境则呈正相关;两种环境EC与叶片Na种内变异均正相关。有研究发现在耐盐能力方面,灌木>乔木>草本[43]。高水盐环境,盐分胁迫抑制植物生存,因此群落主要由灌木等耐盐力较强的物种组成,而随着水盐含量降低,群落物种中更能适应干旱环境的草本逐渐占领优势,这与本研究高水盐环境以灌木为主,低水盐则以草本植物占优势的特点相符。此外,低水盐环境,叶片Na种内变异与土壤SVWC呈正相关,说明提高叶片Na种内变异是荒漠植物对干旱胁迫的可塑性反应,也是其适应性结果。
高水盐环境,群落水平Mg种间变异与土壤Mg、EC等均为负相关,且相关性较高。一方面,这可能是与植物体内Mg主要来自土壤,而此环境土壤Mg含量较高有关;另一方面,Mg是叶绿体正常结构所必需的[49],而盐胁迫对大多数植物叶绿素影响较大,可破坏叶绿体导致光合能力减弱。但有学者认为适度盐胁迫可促进骆驼刺(Alhagisparsifolia)光合作用[50],这可能是骆驼刺能够在高水盐环境生存的原因之一。
综上所述,高水盐环境,四种叶片抗逆性化学性状的种间变异主要受到土壤EC的影响,种内变异主要与土壤Na密切相关,体现植物群落可通过改变物种组成及可塑性变化适应盐分胁迫;低水盐环境,土壤因子与性状变异的相关性虽降低,但土壤EC、SVWC对种间、种内变异仍具有较大的影响,体现了植物随着变化环境(土壤盐分含量减少、干旱胁迫的加剧)而进行的适应性策略选择。
4 结论
本文研究了群落水平上荒漠植物叶片K、Ca、Na、Mg抗逆性化学指标在不同水盐环境下的变异,及土壤理化因子与不同性状变异的关系。研究发现低水盐环境植物保持较高的种间、种内变异是适应和抵御干旱胁迫环境的重要适应策略。旱胁迫加剧时,荒漠植物抗逆性化学性状的种间、种内变异可能更多受到遗传、种间关系等的影响,但尚待进一步证实。此外,四种抗逆性状对两种水盐环境的响应策略间接反映了荒漠植物对土壤水盐环境变化的响应策略,即植物群落可能通过筛选富含K+的植物种以及提高植物K性状的种内变异来适应旱胁迫,而通过提高Na性状的种内变异来适应盐胁迫。本研究为理解干旱区荒漠植物对胁迫环境的适应机制提供了科学解释。

