RNA干扰CD151基因对子宫颈癌细胞增殖和迁移的影响
曹锦涛,陈刘成,李 然,闵 锐,唐明洋,范星宇,李 楠
子宫颈癌是女性常见的恶性肿瘤之一,全球每年有53万新发病例和31万死亡病例,绝大多数子宫颈癌是由于人乳头瘤病毒(human papilloma virus, HPV)感染引起[1-2]。近年来,随着子宫颈细胞学筛查(巴式涂片)和接种HPV疫苗等预防措施的开展,其发病率已显著降低[3]。但对于晚期转移性或复发性患者,临床上尚缺乏有效的治疗方法[4]。CD151(cluster of differentiation 151)是四跨膜蛋白家族(transmember four super family, TMASF)的重要成员,影响细胞的黏附、迁移与增殖,可在肿瘤血管形成中发挥重要作用,与多种恶性肿瘤的发生、发展呈正相关[5-6]。王丽等[7]的实验结果显示CD151蛋白表达与肿瘤细胞的增殖反应有较强的相关性,下调细胞中CD151蛋白表达,可抑制肿瘤细胞的增殖,但CD151基因在子宫颈癌组织中作用的相关机制目前尚不清楚。本实验采用免疫组化EnVision法检测了CD151蛋白在子宫颈鳞状细胞癌及慢性子宫颈炎组织中的表达情况,并采用RNA干扰(RNAi)技术沉默子宫颈癌细胞中CD151基因表达,通过检测其增殖、迁移、侵袭能力的改变进一步探究CD151基因在子宫颈癌中的作用,为CD151基因作为治疗子宫颈癌潜在靶点提供理论依据。
1 材料与方法
1.1 细胞系和试剂将子宫颈腺癌细胞株Hela(中国科学院上海细胞库)用含10%胎牛血清和1%青霉素-链霉素的RPMI-1640培养基(美国Hyclone公司),培养于37 ℃ 5%CO2的细胞培养箱中。CCK-8试剂盒、Annexin V-FITC细胞凋亡检测试剂盒、细胞周期与细胞凋亡检测试剂盒、Transwell小室、4%多聚甲醛、瑞氏-吉姆萨染料(上海碧云天公司),Matrigel基质胶(美国BD公司)。
1.2 方法
1.2.1免疫组化 收集2016~2019年蚌埠医学院第一附属医院病理科存档的子宫颈癌标本58例,慢性子宫颈炎标本34例。采用免疫组化EnVision法检测CD151蛋白表达。组织切片常规脱蜡脱水,使用3%H2O2甲醇灭活内源性过氧化物酶活性,依次滴加一抗、二抗和三抗,DAB显色,苏木精复染,中性树胶封固,镜下观察。阳性结果判定以细胞膜或细胞质中出现明显的棕黄色颗粒为阳性细胞。
1.2.2细胞转染和分组 从Genebank中检索人CD151全长cDNA序列,设计siRNA-CD151序列,用以上确认的siRNA-CD151干扰序列为基础,合成shRNA-CD151。用脂质体Lipofectamine介导重组质粒和对照质粒转染处于对数生长期的子宫颈癌细胞株。实验分3组,即Psciencer2.0-shRNA-CD151质粒转染组(转染Psciencer2.0-shRNA-CD151的子宫颈癌细胞,简称CD151 siRNA组)、空载体组(转染Psciencer2.0-shRNA空载体的子宫颈癌细胞)及空白对照组(未转染任何质粒的子宫颈癌细胞)。
1.2.3Western blot法检测CD151的表达 取上述3组细胞2×105个/孔细胞接种在6孔板中,待生长至密度达到80%后,将细胞用冷PBS洗涤2次,加入100 μL的RIPA细胞裂解液,用细胞刮刮下。采用BCA法定量蛋白,将含有蛋白的细胞裂解液按4 ∶1比例与5XSDS上样缓冲液混合,100 ℃煮沸10 min,然后进行电泳,转膜,封闭,一抗孵育过夜。将膜用TBST洗涤3次,每次10 min,在室温下与合适的HRP标记的二抗孵育1 h。通过增强的化学发光检测系统检测蛋白条带。
1.2.4细胞增殖实验 取上述3组细胞,将细胞以每孔5×103个均匀接种于96孔板中,并设置调零组(只含有细胞培养基不含有细胞),培养于37 ℃ 5%CO2的培养箱中培养24 h后,每孔加入10 μL的CCK-8,再孵育2 h后用酶标仪测量450 nm处的吸光度。细胞活力计算公式:细胞活力=(实验组-调零组)/(空白对照组-调零对照组)×100%,实验重复3次,取平均值。
1.2.5流式细胞仪检测细胞凋亡 用不含有EDTA的胰酶消化细胞,1 500 r/min离心5 min,收集2×105个细胞,PBS洗2次,加入5 μL Annexin V-FITC和10 μL碘化丙啶染料室温避光孵育30 min,用100 μL Annexin V-FITC结合液轻轻重悬细胞,转移至流式管流式细胞仪检测。实验重复3次,取平均值。
1.2.6流式细胞仪检测细胞周期 每组离心收集2×105个细胞,PBS洗2次,将细胞加入提前预冷的75%乙醇,4 ℃固定24 h。1 000g离心5 min收集细胞,用PBS洗细胞1次,每组加入配置好的碘化丙啶染液0.535 mL(含有0.5 mL染色缓冲液、25 μL的20×PI染色液、10 μL的50×RNase A),于37 ℃避光孵育30 min,转移至流式管流式细胞仪检测。实验重复3次,取平均值。
1.2.7细胞迁移、侵袭实验 先使用无血清培养基将细胞饥饿化处理24 h后再行后续实验。使用胰酶消化细胞后,用不含有胎牛血清的RPMI-1640培养基调整细胞浓度为每毫升1×105个,每组取200 μL细胞悬液加入Transwell小室Matrigel基质胶表面,24孔板下室每孔内加入含0.1%BSA的RPMI-1640培养基600 μL。在37 ℃ 5%CO2的细胞培养箱内培养24 h后,使用棉试纸擦去滤膜表面的细胞,再用4%多聚甲醛固定20 min,并用吉姆萨染色5 min。于400倍镜下计数穿过滤膜的细胞数,每膜随机计数上、下、左、右、中5个不同视野,每组设3个平行滤膜。迁移实验不需要铺Matrigel基底胶。实验重复3次,取平均值。

2 结果
2.1 子宫颈癌和子宫颈慢性炎组织中CD151蛋白的表达子宫颈癌组织中CD151蛋白阳性,定位于细胞膜和细胞质,呈棕黄色颗粒样;子宫颈慢性炎组织中CD151蛋白阴性(图1)。

图1 A.子宫颈鳞状细胞癌HE染色,癌细胞呈浸润性生长;B.子宫颈鳞状细胞癌中CD151阳性,EnVision法;C.子宫颈慢性炎上皮组织HE染色,鳞状上皮层次清晰,结构完整;D.子宫颈慢性炎上皮组织中CD151阴性,EnVision法
2.2 Western blot法检测各组中CD151蛋白表达实验结果显示,CD151 siRNA组的CD151蛋白表达水平显著低于空载体组及空白对照组,差异有统计学意义(P<0.05)。空载体组及空白对照组的CD151表达量约为CD151 siRNA组的9倍(图2)。上述结果表明,CD151 siRNA组的CD151表达水平显著下降。

图2 Western blot法检测各组中CD151蛋白表达水平:A.电泳图;B.直方图;与空载体组及空白对照组相比,*P<0.05
2.3 沉默CD151基因表达对子宫颈癌细胞增殖能力的影响CCK-8细胞增殖实验检测CD151在体外对子宫颈癌细胞增殖的作用,结果表明,CD151 siRNA组细胞在450 nm处的OD值明显低于空载体组及空白对照组,差异有统计学意义(P<0.05,图3)。此外CD151 siRNA组的细胞活力明显低于空载体组及空白对照组(图4),由此确定通过RNAi介导的CD151基因沉默可显著抑制子宫颈癌细胞系的增殖与活力。

图3 CCK-8法检测CD151对细胞增殖能力的影响与空载体组及空白对照组相比,*P<0.05

图4 CD151对细胞活力的影响与空载体组及空白对照组相比,*P<0.05
2.4 流式细胞术检测CD151对细胞凋亡与周期的影响细胞凋亡流式图显示,在细胞周期早期,CD151 siRNA组细胞凋亡数量明显高于空载体组及空白对照组(图5),表明CD151低表达可促进细胞早期凋亡;流式细胞分析结果显示,CD151 siRNA组G1期细胞数量高于空载体组及空白对照组,CD151 siRNA组的S期细胞数量则明显低于空载体组及空白对照组(图6),提示CD151表达水平降低可使细胞发生G1/S抑制;柱状图显示CD151 siRNA组G1期细胞数量明显高于空载体组及空白对照组,差异有统计学意义(P<0.05,图7),进一步证实CD151低表达可将细胞周期阻滞在G1期。

图5 流式细胞仪检测细胞凋亡
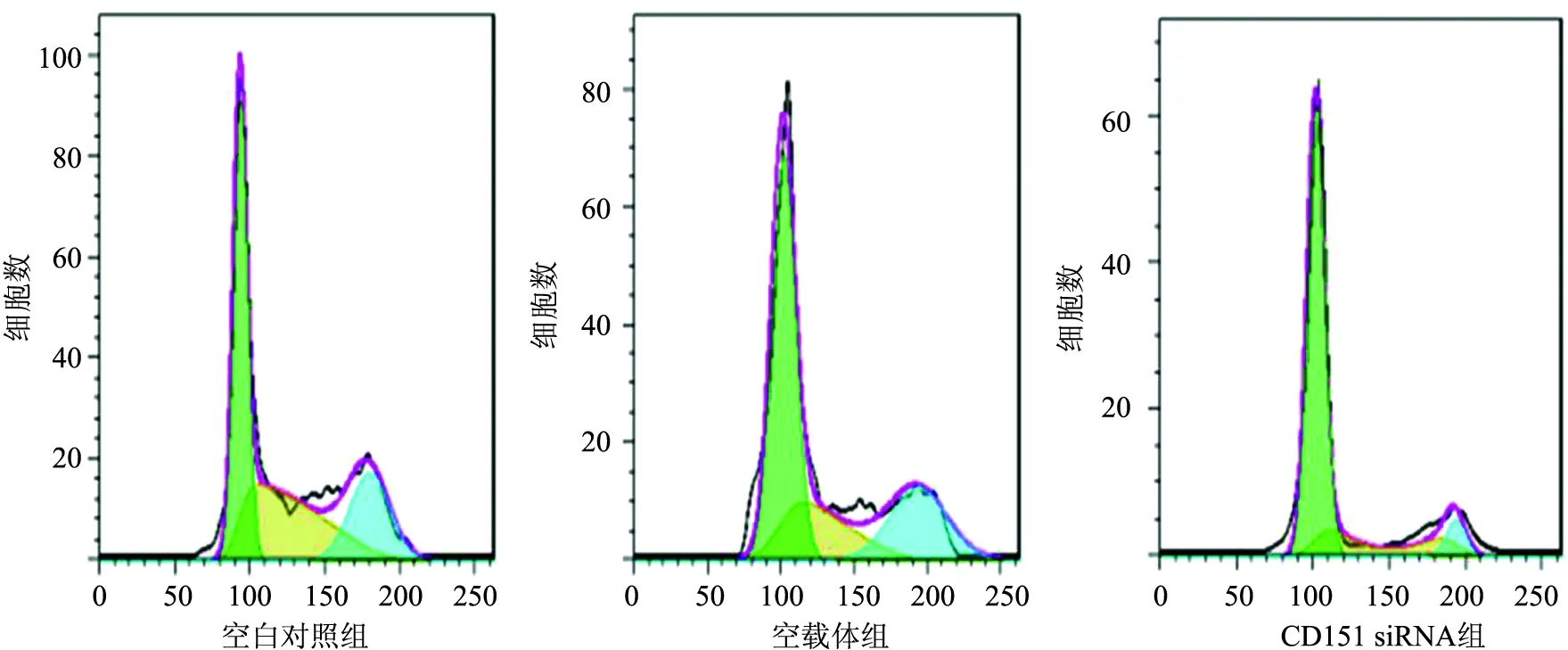
图6 流式细胞仪检测细胞周期

图7 CD151表达对细胞周期的影响与空载体组及空白对照组相比,*P<0.05
2.5 沉默CD151基因表达对子宫颈癌细胞迁移和侵袭能力的影响Transwell法检测不同分组中癌细胞的迁移和侵袭能力,结果显示,CD151 siRNA组细胞穿过滤膜的细胞数明显低于空载体组和空白对照组,差异有统计学意义(P<0.05,图8、9),空载体组和空白对照组之间穿膜细胞数差异无显著性。表明CD151表达缺失可显著降低癌细胞的迁移及侵袭能力。

图8 Transwell实验检测各组细胞的迁移能力与空载体组和空白对照组相比,*P<0.05
3 讨论
子宫颈癌位居全球女性癌症发病率和病死率的第4位,基因治疗作为治疗子宫颈癌的新方法而倍受关注[8]。鉴于CD151在子宫颈鳞状细胞癌组织中高表达,在慢性子宫颈炎组织中呈阴性,推断CD151基因的激活可能是子宫颈癌癌变过程中的重要因素,而CD151过表达可能会促进子宫颈细胞的增殖及恶性转化。
CD151是最早发现的与肿瘤转移呈正相关的四跨膜蛋白,是整合素依赖性细胞运动信号转导中必不可少的分子连接物,整合素定位的变化被认为是癌症侵袭和转移的决定因素[9-10]。整合素受体(即α6β1、α3β1和α6β4)与CD151结合可形成牢固且极其稳定的CD151-整合素复合体,后者可能通过调节FAK、ERK、Akt、Wnt等信号分子的活性,促进肿瘤细胞的侵袭与转移,破坏该复合体的形成可有效减弱肿瘤的恶性生物学作用[11-13]。FAK是一种非受体酪氨酸激酶,其磷酸化后,可将上游信号整合并传递,参与调控细胞骨架重组、收缩、黏着斑解聚与形成,进而调节细胞运动,是肿瘤细胞侵袭的关键[14]。杨秀婷等[15]在肺腺癌的研究中亦证实了该结果,认为CD151可促使FAK-P130Cas信号通路磷酸化表达增加,而破坏CD151-整合素复合体,则会减少该信号通路的激活,提示CD151可能通过激活FAK-P130Cas通路参与癌细胞的迁移。此外,CD151还可通过激活ERK信号通路促进人脐静脉内皮细胞在体外基质胶上的管型结构形成,促进体外血管的生成[16]。另有研究证明,在肝细胞癌中CD151可通过激活PI3K/Akt/GSK-3β/Snail信号通路,调节基质金属蛋白酶9(matrix metalloproteinase-9, MMP-9)对肝癌的促进作用[17-18]。研究证实,Wnt信号通路与肿瘤转移以及肿瘤内部微血管的形成密切相关,而CD151与整合素α3β1结合可通过Wnt通路以及上皮-间质转化作用调节卵巢癌的生长[19]。由此可见,CD151参与了细胞黏附、细胞外基质黏附并促进内皮细胞的移行及微血管形成,推动了肿瘤细胞的侵袭与转移。因此CD151被认为是潜在的药物靶点,用于开发免疫疗法、生物制剂等[20-21]。如CD151肽作为肿瘤疫苗在小鼠乳腺癌和肝癌模型中激活CD8+IFN-γ+淋巴细胞抑制肿瘤增殖,提示CD151肽引发的抗肿瘤活性免疫可能成为抑制肿瘤进展的有效方法[22]。有研究证实CD151基因在皮肤鳞状细胞癌组织中高表达,激活转录因子STAT3以支持角质形成细胞的存活和增殖;沉默CD151基因表达可导致皮肤鳞状细胞癌细胞生长抑制,裸鼠实验亦证实了CD151基因沉默可有效减缓肿瘤的生长,其机制可能与促进细胞凋亡有关[23]。值得注意的是,有些研究发现CD151、CD9和CD63四跨膜蛋白的表达降低可与肿瘤更恶性的表型有关,另一些研究发现结直肠癌中CD151表达与肿瘤转移进展之间呈反比关系[24-26]。

图9 Transwell实验检测各组细胞的侵袭能力与空载体组和空白对照组相比,*P<0.05
本实验采用免疫组化法检测子宫颈鳞状细胞癌组织中CD151蛋白的表达,并通过RNAi介导CD151基因沉默,观察其对子宫颈癌细胞生长、迁移和侵袭的影响。结果显示,CD151在子宫颈癌组织中阳性;CD151低表达可抑制子宫颈癌细胞的增殖;CD151 siRNA组中的癌细胞比空载体组和空白对照组更多地进入了早期凋亡并且多数细胞周期停滞于G1期,这提示CD151表达缺失可显著促进癌细胞凋亡且能阻滞癌细胞周期的进展。CD151 siRNA组癌细胞较空载体组和空白对照组细胞的迁移和侵袭能力显著降低,提示沉默CD151基因表达可抑制子宫颈癌细胞的迁移、侵袭,但其相关分子机制尚不明确。本实验结果可为临床治疗子宫颈癌提供新思路,如针对CD151的特性,利用RNA干扰、免疫治疗等技术结合新的药物递送系统靶向杀伤易侵袭转移的肿瘤细胞。CD151既参与调节细胞的正常生理过程,如细胞黏附、运动、活化和增殖,又参与促进肿瘤病理过程的发生、发展。由于侵袭和转移是造成恶性肿瘤患者死亡的主要原因,因此,本实验下一步着重探讨CD151参与肿瘤侵袭转移的机制,探寻子宫颈癌细胞转移过程所处微环境中复杂的信号通路,再通过激活或沉默相关信号分子,抑制肿瘤进展,为临床诊治提供更多有效的方法。
综上所述,CD151蛋白在子宫颈癌组织中高表达,将其基因沉默后可以使子宫颈癌的细胞增殖和迁移能力受抑制,CD151检测有望成为子宫颈癌预后评价的一种新分子生物学指标。

