金针菇菇头对草鱼生长、消化酶活性、肠道组织结构、肌肉品质及血清生化指标的影响
杨琳霖 胡 毅* 朱 波 钟 蕾 魏泽宏 唐 涛 张俊智**
(1.湖南农业大学动物科学技术学院,湖南省特色水产资源利用工程技术研究中心,长沙 410128;2.省部共建淡水鱼类发育生物学国家重点实验室,湖南师范大学生命科学学院,长沙 410081)
金针菇(Flammulinavelutipes)学名毛柄金钱菌,具有较高的食用和药用价值。随着国内外消费市场的扩大和工业化生产的规模化,我国金针菇栽培量也不断增加。金针菇菇头(Flammulinavelutipesstembase),又被称作金针菇菇脚,是金针菇除去可食用部分后剩余的根部,占金针菇的20%~30%。有报道表明,2017年我国金针菇年产量为247.92万t,其中金针菇菇头年产量可达50万~70万t[1],但其大多被焚烧、掩埋、随意丢弃,不仅浪费了优质的生物资源,同时造成了严峻的环境问题。合理开发利用金针菇菇头,不仅能避免上述问题,还能实现对废弃物的再利用,并带来一定的社会经济效益。金针菇多糖是金针菇特有的活性物质,是由葡萄糖、半乳糖、甘露糖等多种单糖通过糖苷键连接而成的大分子化合物,其中金针菇菇头中金针菇多糖含量占1.5%[2]。有研究报道,金针菇多糖具有抗菌、抗氧化、降低血糖血脂、调节机体免疫力等多种功效[3]。目前,金针菇菇头及其活性物质金针菇多糖在饲料中的研究主要集中在畜禽方面,如提高肉鸡成活率和生产性能[4],增强淋巴细胞免疫功能[5],改善肠道菌群结构[6],减少机体脂肪沉积[7]。金针菇多糖在水产行业的研究则鲜有报道。金针菇多糖可提高七彩鲑幼鱼的生长性能、抗氧化能力和肠道免疫能力[8]。
草鱼属硬骨鱼纲(Osteichthyes),鲤形目(Cypriniformes),鲤科(Cyprinidae),雅罗鱼亚科(Leuciscinae),草鱼属(Ctenopharyngodon),是典型的草食性鱼类。据统计,2019年草鱼产量已超过550万t,在淡水鱼类养殖中稳居第一[9],具有巨大的经济价值。因此,本试验以草鱼为研究对象,研究饲料中添加金针菇菇头对草鱼生长、消化酶活性、肠道组织结构、肌肉品质及血清生化指标的影响,研究成果对合理开发和利用金针菇菇头、实现废弃资源的再利用、降低环境污染具有重要意义。
1 材料与方法
1.1 试验材料
金针菇菇头由广州某生物科技有限公司提供。金针菇的培育符合工厂生产相关标准,金针菇采摘后,切割菇头并进行统一晾晒风干,置于烘箱内60 ℃烘干至恒重后粉碎。取金针菇菇头粉,分别采用冷冻干燥机干燥法、酸碱洗涤法、索氏抽提法、灼烧法、凯氏定氮法、氧弹热量计法、高效液相色谱分析法、气相色谱法测定其水分、粗纤维、粗脂肪、粗灰分、粗蛋白质、总能及氨基酸含量,金针菇菇头主要成分(由广州金域医学检测中心有限公司检测)见表1。

表1 金针菇菇头主要成分(风干基础)
1.2 试验设计和试验饲料
挑选360尾初始体重为(20.00±0.25)g的草鱼,随机分成3组,每组3个重复,每个重复40尾。试验期8周。
在草鱼基础饲料中分别添加0(对照组)、0.5%(Ⅰ组)和1.0%(Ⅱ组)金针菇菇头,等量替代基础饲料中的面粉,配制3种等氮等脂的试验饲料。饲料制备前,将原料粉碎后过60目筛,准确称取饲料原料按配比从小到大逐级均匀混合,然后再将鱼油与干物质混匀,用江西正昌320型制粒机(湖南农大追求饲料科技有限公司)制成1.5 mm粒径的颗粒饲料,在阴凉处自然风干至水分含量少于10%,置于-20 ℃保存备用。试验饲料组成及营养水平见表2。

表2 试验饲料组成及营养水平(风干基础)
1.3 饲养管理
养殖试验在湖南省娄底市新化县车田江水库试验基地进行。试验鱼苗购自湘潭苗种场,正式养殖试验开始前将鱼苗置于网箱(5.0 m×4.0 m×3.0 m)中,用基础饲料暂养2周。禁食24 h后挑选360尾健康、规格统一的草鱼幼鱼,初始均重为(20.00±0.25)g,消毒后将其随机分为3个组,每个组3个网箱(1.5 m×1.5 m×1.5 m),每个网箱放40尾草鱼。
养殖试验共持续8周。每天投喂3次(07:00、12:00、17:00)。投饲率为体重的3%~5%,并根据草鱼的摄食情况每周相应调整。记录试验期间饲料投喂量、草鱼死亡尾数等相关情况。养殖试验期间水温25.0~31.0 ℃,水体溶氧含量(6.6±0.5)mg/L,氨氮含量≤0.22 mg/L。
1.4 样品采集和指标测定
1.4.1 生长指标
养殖试验结束后,草鱼禁食24 h,统计每个网箱草鱼的尾数和重量,记录养殖过程中饲料投喂量,计算存活率(survival rate,SR)、增重率(weight gain rate,WGR)、饲料系数(feed conversion rate,FCR)和摄食率(feed intake,FI):
存活率(%)=100×试验结束草鱼尾数(尾)/试验初始草鱼尾数(尾);增重率(%)=100×[终末质量(g)-初始质量(g)]/初始质量;饲料系数=饲料采食量(g)/[终末质量(g)-初始质量(g)];摄食率(%/d)=100×总投喂量/{[初始质量(g)+终末质量(g)]×养殖天数/2}。
1.4.2 形体指标
每网箱随机取3尾草鱼,称量体重和体长。解剖分离肝脏和肠道,记录肝脏和肠道重量及肠道长度,去除内脏后称草鱼空壳重,计算肥满度(condition factor,CF)、肝胰腺指数(hepatopancreas index,HPI)、脏体指数(viscero somatic index,VSI)、肠体比(relative intestine weight,RIW)和肠长比(intestine somatic index,ISI):
肝胰腺指数(%)=100×草鱼肝脏重(g)/草鱼体重(g);脏体指数(%)=100×[草鱼体重(g)-草鱼空壳重(g)]/草鱼体重(g);肠体比(%)=100×草鱼肠道重量(g)/草鱼体重(g);肠长比(%)=100×草鱼肠长(cm)/草鱼体长(cm);肥满度(g/cm3)=100×草鱼体重(g)/草鱼体长(cm)3。
1.4.3 体成分指标
从每个网箱取3尾鱼,称重后置于-20 ℃冷冻保存,用于常规体成分含量的测定。试验饲料和草鱼的水分、粗脂肪、粗蛋白质和粗灰分含量测定分别采用105 ℃恒温干燥法(GB/T 5009.3—2003)、索氏抽提法(GB/T 5009.6—2003)、凯氏定氮法(GB/T 5009.5—2003)和550 ℃马福炉灰化法(GB/T 5009.4—2003)。
1.4.4 肌肉质构指标
取1 cm3背部肌肉,使用质构分析仪(TMS-Pro,美国FTC公司)进行全质构分析,肌肉质构指标包括硬度(hardness)、黏附性(adhesiveness)、内聚性(cohesiveness)、弹性(springiness)、胶黏性(gumminess)、咀嚼性(chewiness)。采用25 mm×25 mm的柱形探头,接触感应力为5 gf,测试速度1 mm/s,目标模式为形变,形变量为30%,时间为2 s。每个样品测定2次,取平均值。
1.4.5 肠道消化酶活性和肠道组织结构
从每个网箱中选取3尾鱼,解剖后取其中肠组织,置于无酶管中,保存在-80 ℃冰箱内。待测组织样品从-80 ℃冰箱取出,置于4 ℃条件下复温,准确称取样品重量。以生理盐水1∶9体积比进行稀释,获得肠道组织匀浆,2 500 r/min离心10 min,取上清液测定淀粉酶和脂肪酶活性。另称取肠道组织样品,以胰蛋白酶匀浆液1∶9体积比稀释,获取肠道组织匀浆,2 500 r/min离心10 min,取上清液测定胰蛋白酶活性。试剂盒均购自南京建成生物工程研究所。
使用光学显微镜观察草鱼中肠组织结构,切片于100倍下测定绒毛高度、肌层厚度,切片于400倍下计算杯状细胞数目。
1.4.6 血清生化指标
从每个网箱中选取3尾鱼,使用40 mg/L丁香油麻醉。用1 mL无菌注射器取血于尾静脉采血,于4 ℃冰箱内静置2 h,在3 500 r/min离心10 min后分离血清,于-80 ℃冷冻保存,用于后续血清生化指标的测定。血清谷草转氨酶(GOT)、谷丙转氨酶(GPT)活性及葡萄糖(GLU)、尿素氮(UN)、总胆固醇(TCHO)、甘油三酯(TG)、总胆汁酸(TBA)含量均采用南京建成生物工程研究所生产的试剂盒测定。
1.5 数据处理
试验数据用Excel 2019进行整理后采用SPSS 24.0软件进行单因素方差分析(one-way ANOVA),并采用Duncan氏法检验组间差异,结果均以平均值±标准误(mean±SE)表示,P<0.05表示差异显著。
2 结 果
2.1 饲料中添加金针菇菇头对草鱼生长、形体和体成分指标的影响
由表3可见,与对照组相比,Ⅰ组和Ⅱ组的增重率显著增加(P<0.05),但Ⅰ组和Ⅱ之间差异不显著(P>0.05)。各组之间饲料系数、摄食率和存活率无显著差异(P>0.05)。与对照组相比,Ⅰ组的肠体比显著降低(P<0.05),Ⅱ组的肝胰腺指数显著升高(P<0.05)。各组之间肥满度、脏体指数和肠长比无显著差异(P>0.05)。

表3 饲料中添加金针菇菇头对草鱼生长和形体指标的影响
由表4可见,各组之间鱼体粗脂肪、粗灰分、粗蛋白质和水分含量无显著差异(P>0.05)。

表4 饲料中添加金针菇菇头对草鱼体成分指标的影响
2.2 饲料中添加金针菇菇头对草鱼肠道消化酶活性的影响
由表5可见,各组之间肠道胰蛋白酶活性无显著差异(P>0.05)。与对照组相比,Ⅱ组的肠道脂肪酶活性显著升高(P<0.05),Ⅰ组和Ⅱ组的肠道淀粉酶活性显著降低(P<0.05)。

表5 饲料中添加金针菇菇头对草鱼肠道消化酶活性的影响
2.3 饲料中添加金针菇菇头对草鱼中肠组织结构的影响
由图1可见,与对照组相比,Ⅱ组草鱼的肠道绒毛生长整齐,结构完整。

A:对照组 control group;B:Ⅰ组 group Ⅰ;C:Ⅱ组 groupⅡ;VH:绒毛高度 villus height;MT:肌层厚度 muscular layer thickness;GC:杯状细胞 goblet cell。
由表6可见,与对照组相比,Ⅰ组和Ⅱ组的中肠肌层厚度和杯状细胞数量显著增加(P<0.05),但Ⅰ组和Ⅱ组之间差异不显著(P>0.05)。各组之间中肠绒毛高度无显著差异(P>0.05)。

表6 饲料中添加金针菇菇头对草鱼中肠组织结构的影响
2.4 饲料中添加金针菇菇头对草鱼肌肉质构特性的影响
由表7可见,与对照组相比,Ⅰ组的肌肉硬度、胶黏性和咀嚼性显著升高(P<0.05),Ⅰ组和Ⅱ组之间差异不显著(P>0.05)。各组之间肌肉黏附性、内聚性和弹性无显著差异(P>0.05)。

表7 饲料中添加金针菇菇头对草鱼肌肉质构特性的影响
2.5 饲料中添加金针菇菇头对草鱼血清生化指标的影响
由表8可见,与对照组相比,Ⅰ组和Ⅱ组的血清葡萄糖含量、谷草转氨酶活性显著升高(P<0.05),Ⅰ组和Ⅱ组的血清尿素氮、甘油三酯含量和谷丙转氨酶活性显著下降(P<0.05),Ⅱ组的血清总胆固醇含量显著下降(P<0.05),Ⅰ组和Ⅱ组的血清总胆汁酸含量没有显著差异(P>0.05)。
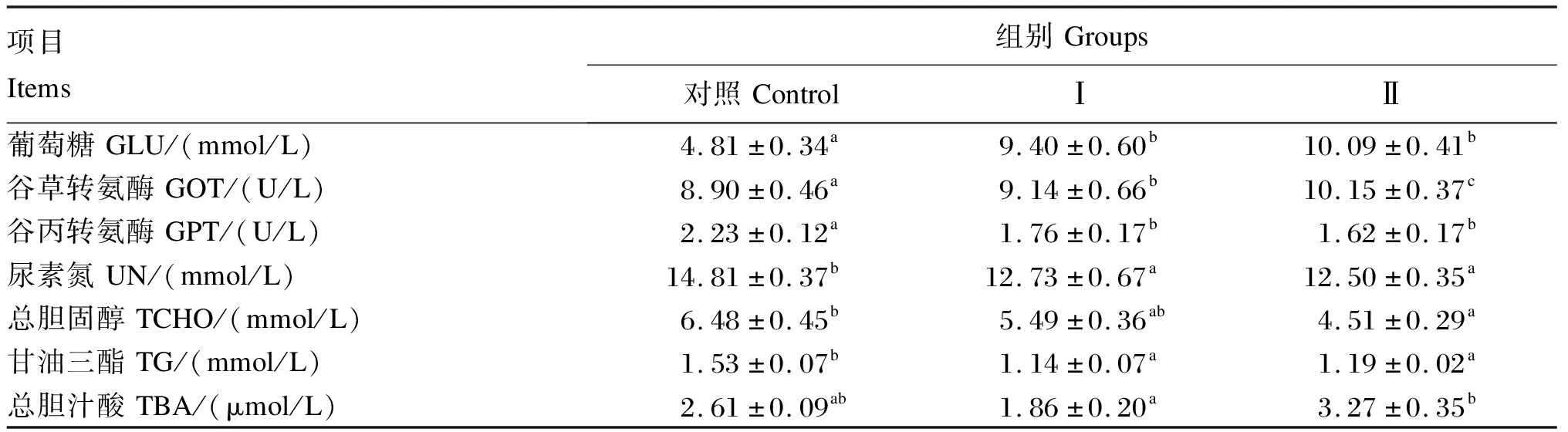
表8 饲料中添加金针菇菇头对草鱼血清生化指标的影响
3 讨 论
3.1 金针菇菇头对草鱼生长、消化酶活性及肠道组织结构的影响
目前,关于金针菇菇头对水产动物生长性能的研究很少。本试验结果表明,饲料中添加金针菇菇头显著提高了草鱼增重率,可能是金针菇菇头影响了草鱼消化酶活性和肠道组织结构,从而促进其生长。消化酶活性决定了机体对营养物质的消化吸收能力。本试验结果表明,饲料中添加金针菇菇头提高了草鱼肠道脂肪酶和胰蛋白酶活性,其中添加量为1.0%时活性最高,与草鱼生长的变化一致。与本试验研究结果相似,在乌鳢[10]、斜带石斑鱼[11]、肉仔鸡[12]饲料中添加黄芪多糖、海带多糖和艾蒿多糖可显著提高蛋白酶、淀粉酶活性,并对生长性能有促进作用。机体肠道菌群组成的改变会影响消化酶活性,饲料中添加枯草芽孢杆菌[13]、乳酸菌[14]、酵母菌[15]可显著提高肠道消化酶活性。另外,有研究表明金针菇多糖经过肠道微生物发酵后能产生多种短链脂肪酸,使肠道环境呈酸性,有利于肠道益生菌的生长繁殖,并在一定程度上抑制病原菌的生长,提高肠道菌群的多样性[16-17]。饲料中添加金针菇菇头可能通过金针菇多糖影响了肠道菌群组成,增强了消化酶的活性,有助于草鱼对营养物质的消化、吸收和利用,从而促进其生长。机体的生长发育与肠道的组织形态也密不可分。肌肉层与鱼体肠道节律性蠕动相关,肌层厚度增加有利于肠道机械消化[18];杯状细胞可合成分泌黏蛋白、三叶肽等物质保护鱼体肠道[19]。本试验结果表明,饲料中添加金针菇菇头能显著增加草鱼的中肠肌层厚度和杯状细胞数量,当添加量为1.0%时肠道绒毛生长最整齐、结构最完整。原因可能是金针菇菇头中的多糖和纤维素等成分有利于草鱼肠道的节律性收缩,维持了草鱼肠道屏障结构的完整性,降低了诱发肠道炎症的可能性。与本研究结果相似,茯苓多糖增加了大鼠的肠道绒毛高度,修复了肠道屏障,并缓解了大鼠的肠道炎症[20];荷花粉多糖缓解了小鼠杯状细胞丢失的现象,增强了肠道定向蠕动,减轻了肠道黏膜损伤[21]。
3.2 金针菇菇头对草鱼肌肉品质的影响
肌肉质构特性是评价商品鱼肌肉品质的重要指标之一,颇受消费者的关注。在诸多因素中,饲料成分是影响肌肉品质的重要因素。饲粮中添加5%的金针菇菌渣可改善猪的肌肉品质[22],饲粮中添加2%的金针菇菌渣不影响肉鸡整体肉品质[23]。但关于金针菇菇头对肉品质的影响鲜有报道。本试验采用操作简便、偶然误差小的质地剖面分析(TPA)法对草鱼肌肉质构指标进行量化,从而客观地评价草鱼的肌肉品质。本试验结果显示,饲料中添加0.5%的金针菇菇头能显著增加草鱼肌肉的硬度、咀嚼性和胶黏性。有研究表明,金针菇菇脚能显著降低肌肉中甘油三酯含量,促进肉鸡的脂肪分解[7]。饲粮中添加5%金针菇菇脚使猪背膘厚度显著降低,并在一定程度上减少了皮下脂肪的积累,有利于改善猪肉的胴体性状[24]。饲料中添加金针菇菇头可能通过影响草鱼肌肉的脂肪代谢,增加了肌束间的摩擦力,进而影响草鱼的肌肉质构特性。肉质口感与咀嚼性和硬度呈正相关[25],因此,饲料中添加适量金针菇菇头有利于改善草鱼的肌肉品质,但其作用机理还有待进一步探究。
3.3 金针菇菇头对草鱼血清生化指标的影响
血清葡萄糖含量的变化与机体的新陈代谢及健康状况密切相关。草鱼的血清葡萄糖正常含量为2.78~12.72 mmol/L[26]。本试验结果显示,Ⅰ组和Ⅱ组的草鱼血清葡萄糖含量显著高于对照组,但未超过正常含量范围,与在奥尼罗非鱼[27]上的研究结果一致。可能原因是Ⅰ组和Ⅱ组的饲料中金针菇多糖的含量超过了草鱼可耐受的多糖含量阈值,导致草鱼对此出现不耐受性,干扰了机体胰岛素的分泌作用,导致血清葡萄糖含量升高[28]。血清谷丙转氨酶活性反映肝功能状态。本试验结果显示,Ⅰ组和Ⅱ组的草鱼血清谷丙转氨酶活性显著降低,说明饲料中添加金针菇菇头对草鱼肝脏细胞没有不良影响。由于草鱼对糖类的不耐受性,需要依赖三羧酸循环快速代谢血液中的糖类,因此本试验中谷草转氨酶活性升高可能是用于提供三羧酸循环所需的草酰乙酸,这与郭志欣[8]、朱波等[29]的研究结果基本一致。尿素氮作为嘌呤代谢的最终产物,与机体蛋白质代谢和氨基酸平衡密切相关[30],血清尿素氮含量越低,说明对蛋白质的利用率越高。本试验结果显示,Ⅰ组和Ⅱ组的草鱼血清尿素氮含量显著低于对照组,说明饲料中添加金针菇菇头有利于草鱼平衡氨基酸,合成蛋白质,提高氮的利用率。这与金针菇多糖[31]、黄精多糖[32]、红平菇菌丝体多糖[33]降低血清尿素氮含量结果一致。总胆固醇和甘油三酯是机体重要的脂类物质,血清总胆固醇和甘油三酯含量的变化反映了机体对脂类吸收状况和肝脏脂肪代谢状况[34]。本试验结果显示,Ⅰ组和Ⅱ组的草鱼血清甘油三酯含量显著低于对照组,Ⅱ组的血清总胆固醇含量显著低于对照组,与金针菇多糖可降低血脂的研究结果[35]一致,原因可能是饲料中添加适量金针菇菇头促进了多肽激素的分泌,加速了脂肪分解,减少了脂肪沉积[36]。
4 结 论
综上所述,饲料中添加适量金针菇菇头可促进草鱼生长,提高消化酶活性,改善肠道组织结构,改善草鱼肌肉品质。

