三线放松功锻炼对防治老年前列腺手术术后早期认知损害的研究
赵非一 徐燕 张雯静 许红 马恰怡 陈思翰 韩茨 付强强


摘 要:探索术前采用三线放松功进行锻炼是否能有效降低老年经尿道前列腺汽化电切术(TURP)患者术后认知功能障碍(POCD)的发病率和减轻认知损害。方法:60例被试随机分入治疗组(n=30)和对照组(n=30)。对照组仅接受围手术期常规护理,治疗组在此基础上于术前15 d开始每天练习三线放松功。所有被试于术前15 d(基线)、术后24 h及72 h,分别予以简易精神状态评价量表(MMSE)进行认知测试,并观察血清炎症因子IL-1β,TNF-α及S100-β蛋白表达水平的变化。术前15 d及术后72 h,被试同时接受3项神经心理学测试:Stroop色-词关联测验(SCWAT)、數字符号替代测试(DSST)及交替流畅性测验(ACAFFT)。考虑术前焦虑与POCD的潜在联系,被试还于术前15 d及术前1 d接受汉密尔顿焦虑量表(HAMA)测评。结果:1)练习三线放松功15 d后,治疗组HAMA总分显著下降(p<0.05),对照组HAMA总分则随手术日期的临近升高(p<0.05)。2)和基线相比,术后24~72 h,2组被试的MMSE总分均持续下降(p<0.05)。术后72 h,对照组MMSE总分下降比治疗组更显著(p<0.05)。3)和基线相比,术后72 h,2组患者的SCWAT测试耗时数均明显增加,且对照组患者在卡片C阶段耗时显著多于治疗组(p<0.05);2组患者在DSST测试中的正确率在术后均显著下降(p<0.05),且对照组正确率更低(p<0.05);在ACAFFT测试中,2组患者手术前后的正确率差异均不显著(p>0.05)。4)和基线相比,术后24 h,2组患者的IL-1β、TNF-α和S100-β指标均大幅上升(p<0.05)。无论术后24 h还是72 h,对照组IL-1β和TNF-α表达水平的涨幅均高于治疗组(p<0.05),尽管2组别间S100-β蛋白的表达差异不显著(p>0.05)。5)无论术后24 h还是72 h,2组被试的POCD发生率差异均不显著(p>0.05)。结论:术前连续15 d的三线放松功锻炼可减轻老年患者前列腺汽化电切术术后24 h及72 h的认知损害。术前焦虑情绪也可通过练习三线放松功得到缓解。但是,尚未有足够证据显示该锻炼可以有效降低术后24 h及72 h认知功能障碍的发生率。
关键词:三线放松功;术后认知功能障碍;经尿道前列腺汽化电切术
中图分类号:G 804.5 学科代码:0403012 文献标识码:A
Abstract:To investigate if preoperative Triarchic Body-Pathway Relaxation Exercise(TBPRE) can mitigate cognitive impairments and reduce the incidence of postoperative cognitive dysfunction(POCD) following Trans-Urethral Resection Prostate(TURP) among elderly. Methods: 60 eligible participants were enrolled and randomized into either a treatment group (n=30) or a control group (n=30). The control group was intervened by routine perioperative care whereas the treatment group was required to practice TBPRE for consecutive 15 days before the surgery in addition to being intervened by the routine perioperative care. The Mini-Mental State Examination (MMSE), and expression levels of serum inflammatory cytokines including interleukin 1β (IL-1β) and tumor necrosis factor-α(TNF-α), and S100-β protein were assessed at 15 days prior to the surgery (baseline), and postoperative 24 and 72 hours, respectively. Participants also underwent three neuropsychological tests:Stroop Color-Word Association Test, (SCWAT),Digit-Symbol Substitution Test (DSST), and Animal-City Alternating Form Fluency Test (ACAFFT), at baseline and postoperative 24 and 72 hours, respectively. Considering the potential correlation between preoperative anxiety and POCD, all patients were tested by Hamilton Anxiety Scale (HAMA) on preoperative 15 days and 1 day as well. Results: 1) After 15-day practice of TBPRE, the HAMA global score of the treatment group decreased significantly (p<0.05), while that of the control group increased significantly with the approach of surgery (p<0.05). 2) Compared with baseline, the MMSE global scores of both groups continuously decreased from postoperative 24 to 72 hours (p<0.05). It should be noted that the MMSE global scores of the control group decreased more significantly than that of the treatment group at postoperative 72 hours (p<0.05). 3) Compared with baseline, the time spent on SCWAT in both groups increased significantly at postoperative 72 hours, and the control group spent more time in the card C phase than that of the treatment group (p<0.05); in DSST, the correct rate of both groups significantly decreased after the surgery (p<0.05), and the correct rate of the control group was much lower (p<0.05); in ACAFFT, there was no significant difference of correct rate in both groups at pre- and post- surgery (p>0.05). 4) Compared with baseline, IL-1β, TNF-α and S100-β levels increased significantly in both groups at postoperative 24 hours (p<0.05). The increase of IL-1β and TNF-α levels in the control group were higher than those in the treatment group at postoperative 24 hours (p<0.05) and at postoperative 72 hours (p<0.05), while the difference in expression of S100-β protein between the two groups was not significant (p>0.05). 5) There was no significant difference in the incidence of POCD between the two groups either at postoperative 24 hours (p>0.05) or at postoperative 72 hours (p>0.05). Conclusion: Preoperative and consecutive TBPRE can mitigate preoperative anxiety as well as the cognitive impairments in elderly undergoing TURP at postoperative 24 hours and 72 hours. However, there is insufficient evidence to support that TBPRE pretreatment reducing the incidence of POCD within postoperative 72 hours.
Keywords: Triarchic Body-Pathway Relaxation Exercise; postoperative cognitive dysfunction; trans-urethral resection prostate
术后认知功能障碍(postoperative cognitive dysfunction, POCD)是手术后中枢神经系统(central nervous system, CNS)常见并发症,以记忆减退、注意力不集中、信息加工处理能力差,甚至性格改变、精神错乱等为主要特征[1-3]。相比过去,尽管手术技术、麻醉及围手术期护理水平显著提高,但仍有大量老年患者(年龄≥65)于术后发生POCD[1,3]。POCD早期(术后2周)发生率为26%~80%,长期(术后1年以上)发生率高达37%[4]。
年龄是POCD最有力的预测因素,其他潜在因素还包括患者自身的受教育程度、认知水平、手术时间、麻醉剂量、感染风险及遗传因素等[3-5]。POCD的发生不仅与术后死亡率呈正相关[3],还会增加整个医疗保障系统的负担[4-7]。截至目前,仍没有针对POCD的特效防治手段[1,3-4]。
POCD可发生于任何类型的手术后[8],经尿道前列腺汽化电切术(Trans-Urethral Resection Prostate, TURP)也不例外[9]。一项针对120例行TURP患者术后24 h的监测报告显示:根据麻醉方式不同,硬膜外组POCD发生率为28.33%,全麻组为35%[10]。另一项回顾性队列研究报告显示:16例既往无神经系统疾病史的老年患者(69~87岁)于TURP术后6~72 h出现显著认知损害,涉及记忆力、定向力及语言障碍等[11]。周饮酒量、既往手术史、术前焦虑、术后低氧血症、术后感染等也被证实是TURP术后并发POCD的高危因素[12]。TURP是针对良性前列腺增生的国际标准术式,在老年男性群体中广泛采用[9],因此,寻找一种安全有效、防治TURP术后并发POCD的围手术期管理策略迫在眉睫。
正念练习在国外非常流行,被广泛用于缓解高血压、焦虑、认知减退及失眠等多种身心疾病[13-14]。其效益被证实主要是通过激活自主神经系统及内分泌系统从而改变相应的生理体征实现的[15-17]。三线放松功与瑜伽、太极拳、八段锦等同样专注于身心调节的体育锻炼项目比较,其更加不受时间及练习环境所限,例如卒中后遗症、偏瘫者或围手术期病患因行动受限可以在床上完成三線放松功锻炼。
通过中英文常用数据库检索发现,相比太极拳、八段锦等其他传统功法,三线放松功相关的高质量研究有限。根据现有研究分析,认为该功法对改善认知功能具有潜在功效:有助于改善神经系统疾病(尤其是老年轻度认知功能损害)患者的脑功能[18];可缓解焦虑、改善记忆力、优化注意网络功能,且这些积极功效与大脑部分区域的相对θ功率显著增加、脑左半球α活动减少等电生理变化有关[19]。有研究发现该功法调节情绪与认知的通路不同,前者通过激活前额皮层的脑功能活动实现,后者通过调整自主神经系统功能活动、增强交感与副交感神经的协调性实现[20]。尽管病理机制尚不清晰,但系统和海马炎症[21-22]、氧化应激相关的细胞损伤[23]都被认为是诱发POCD的可能机制,对于后者,既往研究已证实,三线放松功对提升机体超氧化物歧化酶含量、抗氧化应激损伤方面的效益显著优于太极拳 [24]。
三线放松功是否可有效防治POCD,目前尚无相关临床研究,但其他围手术期短期锻炼方式已被报道可有效降低POCD发生率[25]。因此,本研究设计开展的临床实验,以行TURP的老年患者为研究对象,旨在评价三线放松功对POCD的实际效果并探索其潜在的作用机制,为临床干预提供新的思路。简易精神状态评价量表(mini-mental state examination, MMSE)是筛查认知障碍(包括POCD)及评价认知功能最常用的检测工具[26],因此,被作为本研究的主要结局指标,辅以3项神经心理学测试,使认知功能的评估更为全面;考虑术前焦虑是诱发POCD的潜在因素之一[27],本研究选择汉密尔顿焦虑量表(hamilton anxiety scale, HAMA)作为评价工具。除主观指标,3项血清生物学标志物(包括IL-1β、TNF-α炎症因子以及S100-β蛋白)也被纳入,主要是考虑这三者可清晰反映系统炎症水平的变化,而炎症反应是目前POCD研究中被探索得最广泛、最深入的病理学机制[22,28-30]。
1 研究对象
来自上海及嘉兴两所医院泌尿外科住院的60名拟行TURP手术且符合本研究纳入标准的患者自愿参与本项研究(伦理批号:No.2017XA-SS-07)。由SPSS 26.0产生随机数字后,根据“信封法”将被试按1∶1的比例随机分入治疗组和对照组(研究对象基线资料及统计处理见表1)。
纳入标准:①拟行TURP 手术的男性患者。②年龄在60~75岁之间。③ ASA分级Ⅰ-Ⅱ级[ASA分级系美国麻醉师协会于临床麻醉前根据病人体质状况及对手术危险性进行的分级标准,共6级[31]。Ⅰ级为“体格健康,发育营养良好,各器官功能正常,围手术期死亡率0.06%~0.08%”;Ⅱ级为“除外科疾病外,有轻度并存病,功能代偿健全,围手术期死亡率0.27%-0.40%”]。④术前患者无认知障碍(MMSE ≥ 27分)。⑤术前无严重呼吸循环系统疾病病史。⑥预计手术时间≤2 h及术中出血量≤100 ml者。⑦试验开始前4周内未服用任何精神类药物。⑧签署知情同意,自愿加入试验并愿意配合随访。
排除标准:①患者有癌症、严重肝肾功能不全、造血系统和内分泌系统原发病等。②患者既往有可能损害认知功能的神经退行性疾病,例如:帕金森综合征、阿尔茨海默症、血管性痴呆、脑卒中、精神障碍等。③试验前1个月内参与过其他临床研究。④失明、失聪或存在其他交流障碍。
2 研究方法
2.1 干预方法
TURP采用标准术式。麻醉剂使用情况:建立上肢静脉通路后,依次予以舒芬太尼0.3~0.4 μg/kg、依托咪酯0.2~0.3 mg/kg及顺式阿曲库铵0.15 mg/kg,置入喉罩行机械通气,麻醉维持采用丙泊酚、复合瑞芬太尼静脉恒速泵注,手术中,间断追加顺式阿曲库铵维持肌松效果。
2.1.1 对照组
仅接受围手术期常规护理,不接受其他额外干预。
2.1.2 治疗组
在围手术期常规护理基础上,患者于术前15 d开始练习三线放松功至术前1 d。三线放松功由一名研究组成员面授练习方法及动作要领,同时发放教学视频供被试反复观看。练习时,患者被允许采用站立式、坐式或卧式。首先,保持舌抵上颚、两目垂帘、调匀呼吸。然后,一边在口中念出“松”字,一边有意识地将身体分成3条“线”(即身体通路)。在3条通路上,先使肌肉紧张,并集中注意力关注这种紧张感,保持这种紧张感1~2 s,然后放松10~15 s。最后,体验放松时生理和心理的双重感觉。3条身体通路分别是:第一条通路由颈部两侧起,沿肩、上臂、肘、前臂、腕、两手至十指,意守中冲穴。第二条通路由面部起,循颈、胸、腹,经两大腿、膝、两小腿、两脚至十趾,意守大敦穴。第三条通路由后脑部即后颈起,过背、腰、两大腿后侧、两腘窝、两小腿、两脚至两脚底,意守涌泉穴。每次练习3~5个循环。每天于醒后及睡前30 min各练习1次。
2.2 结局指标
MMSE及血清指标分别于术前15 d、术后24 h及术后72 h各采集一次。考虑到患者的年龄、实际身体状况及手术带来的巨大负担,为确保患者术后正常的休息及恢复,同时基于伦理学考虑,术后24 h不宜进行神经心理学测试。因此,本研究仅在术前15 d及术后72 h采集神经心理学测试结果,并对术前15 d及术前1 d最后一次练功后进行术前焦虑情绪的测评。
2.2.1 主要结局指标
MMSE是一款临床常用的、用于筛查认知障碍和评价精神功能状态的检测工具[26]。MMSE包括7个测评维度:时间定向力、地点定向力、即可回忆,注意与计算力,回忆,语言,重复及复杂命令。每个维度含至少1个问题,每个问题记1分,共30个问题。根据测评总分:27~30分提示受访者没有认知功能障碍;21~26分提示受访者存在轻度认知功能障碍;10~20分提示受访者存在中度认知功能障碍;0~9分提示受访者有严重的认知功能障碍。如果术后MMSE评分比术前下降至少2分,则可以诊断为POCD[32]。
2.2.2 次要结局指标
2.2.2.1 术前焦虑测评
汉密尔顿焦虑量表(HAMA)是精神科临床常用的焦虑评价量表[33]。HAMA包括14个项目,采用0~4分的5级评分法:总分≥29分,为严重焦虑;总分≥21分,有明显中度焦虑;总分≥14分,肯定有焦虑;总分>7分,存在焦虑状态;总分<7分,没有焦虑症状。
2.2.2.2 血清指标
以血清IL-1β、TNF-α和S100-β为客观结局指标,通过酶联免疫吸附法进行测定。既往大量的病理学实验提示了炎症与POCD之间的高度相关性[28]。动物研究证实:POCD与术后IL-1β、IL-6和TNF-α等炎症因子表达水平升高呈正相关[34]。广泛存在于CNS的S100-β蛋白具有显著生物学活性,在细胞增生、分化、基因表达、细胞凋亡中具有重要作用,是脑损伤的特異性生化标记物[35],也被证实是评价POCD的敏感生物学标志物[28]。
2.2.2.3 神经心理学测试
1)Stroop色-词关联测验(stroop color-word association test, SCWAT)[36]:测试分3个步骤,第一步由医师向患者呈现卡片A,卡片A由红、黄、蓝、绿4个字组成,共30个字,要求患者快速而准确地读出每个字;第二步向患者呈现卡片B,卡片B由红、黄、蓝、绿4种颜色的方块无序排列,共30个,要求患者快速而准确地读出每个方块的颜色;第三步向患者呈现卡片C,将上述4个字用4种不同的颜色印刷(字义与颜色不一致),要求患者快速而准确地读出文字颜色而不是字。对患者完成每个步骤的具体时间进行记录。
2)数字符号替代测试(digit-symbol substitution test, DSST)[37]:提供9个符号,1个符号对应1个数字,要求患者在2 min内尽可能快而准确地写出150个符号下面相对应数字,由医师记录其所填数字正确的个数。
3)交替流畅性测验(animal-city alternating form fluency test, ACAFFT)[38],要求患者于1 min内交替按照动物名及城市名列举出尽可能多的例子(例如,羊-上海-猴-西安-马-北京),并记录正确个数。当患者重复说同一类型的词语时(例如,羊-马……)则由医师提示患者错误,请患者重说,当患者更正并说出下一个正确答案时继续计分。
2.2.2.4 术中一般情况及围手术期指标的比较
观察并记录患者术中一般情况、围手术期相应指标及术后在外科重症监护病房的住院情况(几人、几天),以及术后平均住院天数。
2.3 统计学方法
采用SPSS 26.0进行统计分析,计量资料若服从正态分布,采用“均数±标准差”表示,数据前后比较及组间比较采用两独立样本t检验;不服从正态分布,采用Wilcoxon秩和检验。计数资料采用x2检验。等级资料采用非参数检验。重复测量资料采用两因素多水平的重复测量方差分析。显著性差异水平设定在0.05。
3 研究结果
3.1 受试者基线资料统计结果
如表1所示,除“婚姻状态”外,两组被试人口学及临床特征均无显著差异(p >0.05),提示两组患者在病情上具有可比性。现有研究未发现“婚姻状态”与POCD发生率之间的相关性,因此该差异对结局指标的影响可以忽略不计。
3.2 受试者术前焦虑水平的波动
如表2所示,与术前15 d相比,经15 d三线放松功锻炼后,治疗组HAMA总分显著下降(p<0.05);相反,对照组HAMA总分显著上升(p<0.05),提示未经干预的对照组患者随着手术的临近,术前焦虑越明显。经干预,两组别间HAMA总分比较有显著差异(p<0.001)。
3.3 受试者术前、术后24 h及72 h认知指标的变化
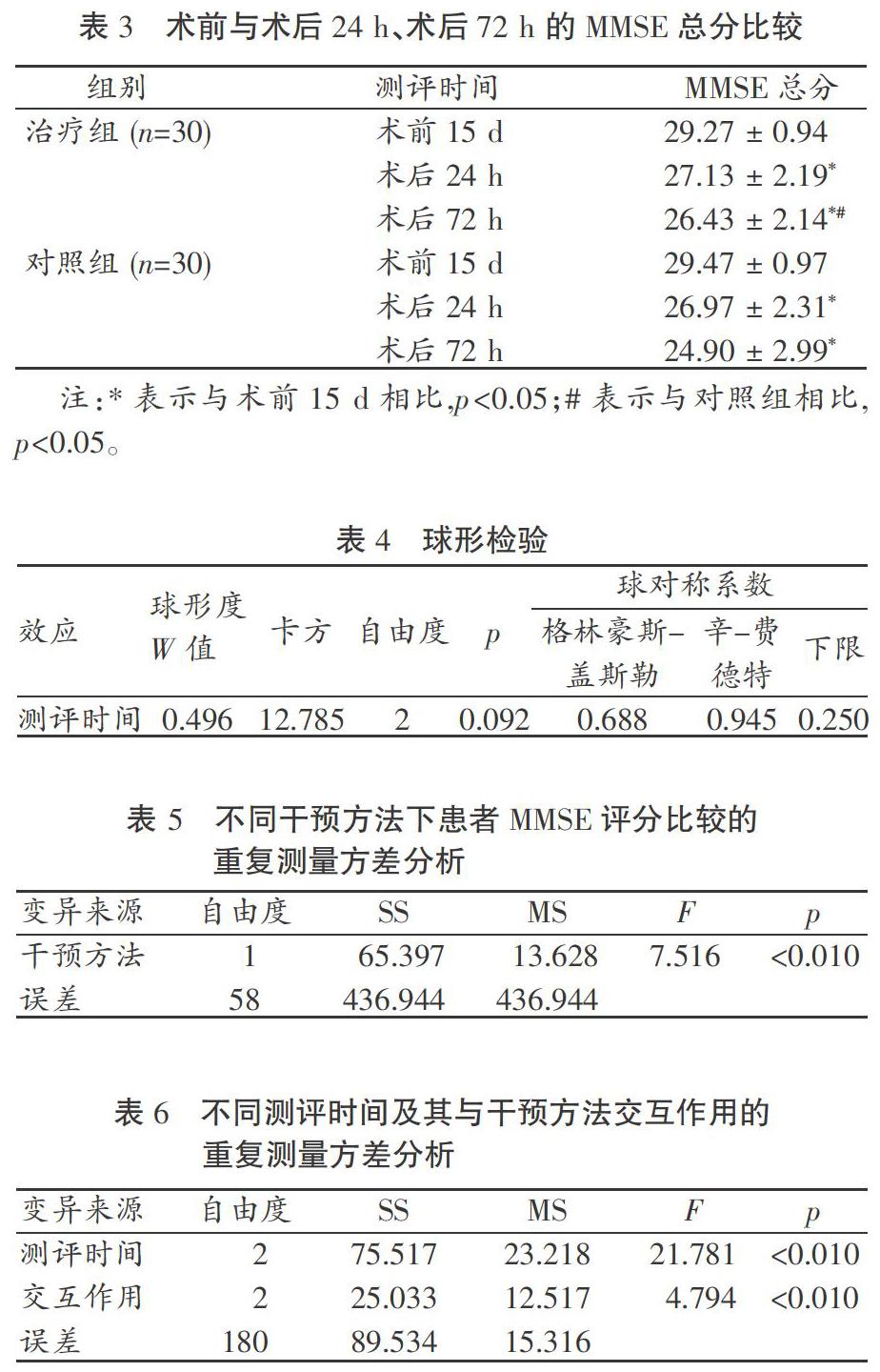
表3-表7显示了患者在术后24 h及72 h的MMSE总分、3项神经心理学测试评分的变化,并直接反映了手术前后患者认知功能的改变。
3.3.1 MMSE总分的变化
如表3所示,与术前相比,术后24 h,两组患者的MMSE总分均显著下降(p<0.05),并且这种下降直到术后72 h仍在继续(p<0.05)。尽管在术后24 h两组患者的MMSE总分无显著差异(p>0.05),但是在术后72 h,对照组患者的MMSE总分下降更为明显(p<0.05)。3.3.2 MMSE总分的两因素三水平重复测量方差分析
如表4所示,对3个测评时间点的MMSE总分经Mauchlys test可知,满足球对称条件(p>0.05)。结果显示,经干预,两组MMSE总分变化有统计学意义(F=7.516,p<0.01),说明两种干预方法对MMSE评分的影响不同(见表5);两组内测评时间之间的差异有统计学意义(F=21.781,p<0.01),说明不同测评时间患者的MMSE总分存在差异;干预方法和测评时间的交互作用也具有统计学意义(F=4.794,p<0.01),说明各测评时间测得的MMSE总分随干预方法的不同而改变(见表6)。
3.3.3 3项神经心理学测试评分的变化
如表7所示,与术前15 d相比,术后72 h,两组患者的SCWAT测试耗时数均明显增加。其中,对照组患者在卡片B阶段耗时数增幅显著(p<0.05),治疗组患者虽然耗时也有所增加,但与术前15 d相比差异不显著(p>0.05)。两组患者在卡片C阶段耗时数增幅均非常显著(p<0.05),而且对照组患者增幅较治疗组患者更为显著(p<0.05)。
在DSST测试中,与术前15 d相比,两组患者的正确率在术后均显著下降(p<0.05),且对照组患者的正确率较治疗组患者更低(p<0.05)。
在ACAFFT测试中,两组患者手术前后的测试正确率差异不显著,两组别间比较差异也不显著(p>0.05)。3.4 受试者术前、术后24 h及72 h认知客观指标(血清标志物)的变化
如表8所示,与术前相比,术后24 h,两组患者的IL-1β、TNF-α和S100-β指标均大幅上升(p<0.05),并且IL-1β和TNF-α两项炎症因子指标升高直到术后72 h仍在继续(p<0.05),而S100-β蛋白的表达在术后72 h已经有所下降,但与术前基线值相比仍然偏高(p<0.05)。
组间比较显示:无论在术后24 h还是72 h,对照组患者IL-1β和TNF-α炎症因子水平的涨幅均高于治疗组患者(p<0.05),尽管两组别间S100-β蛋白的表达差异尚不显著(p>0.05)。
3.5 受试者术后24 h及72 h POCD发生率的变化
在术后24 h,19名患者被诊断为POCD,发生率达31.67%,这与此前的一项研究结果基本一致[9]。其中,治疗组POCD发生率为30.00%,对照组为33.33%(p>0.05)。在术后72 h,24名患者被诊断为POCD,发生率达40.00%。其中,治疗组POCD发生率为33.33%,对照组为46.67%(p>0.05)。由此可知,随着术后时间的推移,POCD发生率似乎也逐步升高。
尽管在术后24 h及72 h两组POCD的发生率均无统计学差异(p>0.05),但治疗组患者POCD的发生率低于对照组患者,尤其是在术后72 h这一差异更为显著。
3.6 术中一般情况及围手术期指标的比较
如表9所示,两组被试在术中一般情况无显著差异(p>0.05),且两组患者中均无人在术后入住SICU (p>0.05),但是,治疗组患者的术后住院天数明显短于对照组患者(p<0.05)。
3.7 安全性评估
研究过程中未发生严重不良事件。无受试者中途退出这项实验。
4 讨论
随着手术技术改进,越来越多的人因疾病选择外科手术治疗,其中很大一部分是老年人。术后高发的POCD无法回避,且流行病学资料也证实老年患者POCD的发生率远高于年轻患者[39]。术后24 h至术后若干年内都可能发生POCD[4,7],且只有极少数POCD是可逆的[1,3]。大多数患者在POCD后都会产生不同程度的不可弥补的认知功能衰退[1,3],例如:记忆储存、信息处理和执行功能的降低,注意力、定向力的减退[40-42]。
尽管POCD自首次被报道后就一直受到急危重症医学领域的關注,但直到目前,仍没能寻找到最佳的治疗方案,业界也认为,最好的治疗方法似乎就是预防[43]。
在现行的预防策略中,订制适合患者的个性化麻醉及手术方式、围手术期的营养支持、术前短期内禁食、增加患者围手术期的社交频次(例如住院期间及术后家人和朋友频繁的来访互动)、缩短住院时间等都被证实可在一定程度上减少术后认知能力的减退[43]。此外,术前的补充医学预干预,例如针灸[4]、中药[44]及运动锻炼[45]也被认为可能有助于预防POCD,但相关的高质量研究极少。本研究临床试验基于“三线放松功是POCD的潜在防治策略吗?”这一问题展开,尽管方法学上尚不完善,但还是得到了一些初步结果。
4.1 三线放松功减轻认知损害的潜在效益与机制
根据本研究结果显示,与术前相比,两组患者术后MMSE总分均有所下降,并且这种下降直到术后72 h仍在继续,神经心理学测试得分/正确率也有所下降,提示患者的认知功能因手术受到损害。其中,MMSE提示认知损害的总体情况,3项神经心理学测试则分别从3个方面更深入地评价了被试的认知能力:SCWAT用以测试被试的选择性注意,用以评价反应力、判断力及执行力[36];DSST用以测试被试的认知处理速度/精神运动速度,以反映注意及工作记忆功能[37];ACAFFT属于词语流畅性测验(verbal fluency test, VFT)的范畴(VFT由Thurstone等于1962年首次提出,并应用于检测大脑优势半球额叶及颞叶的功能,主要评价被试的语言能力、语义记忆和执行功能等)。而ACAFFT是复旦大学附属华山医院在VFT基础上的改良,用以反映被试的语义记忆、知识储备及言语功能,也可用以评价被试的定势转移能力(包括分类、注意转移、灵活性及工作记忆等)[38]。由此可以认为,经历TURP后,两组患者在注意、执行及记忆等多个不同的认知维度上均受到不同程度的影响。两组患者的ACAFFT得分尽管也有所下降,但是与术前15 d相比并不显著,提示该手术对两组患者的语言功能(主要是语言流畅性及语义记忆)影响不显著。上述结果与既往研究的结论基本一致[10-12]。
除年龄外,手术引发的系统及海马炎症被国际术后认知功能障碍研究组(International study of postoperative cognitive dysfunction, ISPOCD)认为是导致术后认知能力下降的最重要原因[21-22,46-47]。手术可以激活特定的稳态反应,通过释放各种炎症介质引发炎症级联反应[48]。具体来说,手术中受损的组织激活了巨噬细胞、单核细胞、成纤维细胞和内皮细胞。这些细胞的活化是对组织损伤最早的细胞反应之一,并且与多种炎症介质的释放有关,包括炎症细胞因子、补体分裂产物和氧化自由基[49]。外周细胞因子可以通过主动转运机制直接穿透血脑屏障,也可通过迷走神经刺激间接穿透血脑屏障[50],进而影响CNS相关功能。生理条件下,细胞因子很难在CNS中被检测到,但在病理状态下会迅速上调,而基质金属蛋白酶也参与这一过程。有研究证实,基质金属蛋白酶在神经炎症性疾病的血脑屏障早期破坏中发挥了显著作用[51]。外周炎性细胞因子对CNS的影响可以是直接或间接的。比如,细胞因子可以与它们在CNS中的受体结合并激活小神经胶质细胞及血管内皮细胞,进而诱导神经炎症反应[50]。当然,手术也可以通过围手术期产生的微栓子和应激反应直接诱发神经炎症反应[52]。神经炎症反应最重要标志是小胶质细胞的激活。激活的小胶质细胞可以分泌许多可溶性炎症分子[53]。而由手术介导的炎性细胞因子依赖激活的神经胶质细胞诱导的海马炎症反应则直接与术后的认知功能下降相关[22]。此外,炎症介质还可能通过影响神经递质、神经可塑性和产生神经毒性来损害认知。比如在外科手术过程中,组织损伤后IL-1β及其上游标志物TNF-α从吞噬细胞和内皮细胞中释放出来[52],升高的IL-1β可以通过增强谷氨酸的神经毒性,从而诱发认知功能障碍[46]。
炎症诱发POCD的病理机制也在本试验中被观察到。与术前相比,术后24 h及72 h,两组患者的炎症细胞因子IL-1β、TNF-α水平大幅上升(p<0.05),提示炎症反应剧烈。与炎症、脑损伤高度相关的另一特异性生化标记物S100-β蛋白也在术后24 h骤升(p<0.05),尽管在术后72 h已经有所回落,但与术前基线值相比仍然偏高(p<0.05)。MMSE总分/神经心理学测试得分与血清炎症标志物水平之间的负相关关系再次证实老年患者TURP术后认知功能损害的确与系统炎症水平的升高显著相关。
术后两组患者的MMSE总分均有所下降,但在术后72 h,对照组患者的MMSE总分下降更为显著(p<0.05),说明认知损害更为显著。同时,无论在术后24 h还是72 h,对照组患者IL-1β和TNF-α炎症因子水平的涨幅均高于治疗组患者(p<0.05),提示对照组患者的炎症反应较治疗组更剧烈。由此推断,对照组患者炎症反应更剧烈,所以术后认知损害更严重,相反,治疗组患者因术后炎症反应相对较轻,因此术后认知损害程度较轻,而两者的差异则在于术前是否进行了三线放松功锻炼。
根据ISPOCD提出的“抑制炎症水平进而改善认知损害”的防治策略[47],可大胆推断,术前连续15 d的三线放松功作为一种“预干预”手段,可能是减轻老年患者TURP手术后早期(24 h及72 h)认知损害的一种潜在干预策略。而且,其改善术后认知损害的机制,则可能与其对系统炎症表达的抑制有关。但是,在术后24 h及72 h,两组患者POCD的发生率均无统计学差异,提示尚未有足够证据证明术前连续15 d的三线放松功锻炼可以有效降低术后早期POCD的发生率。需要说明的是,这一结果并不意味着三线放松功对于POCD是无效的。结合表3-表7可知,尽管三线放松功对于术后早期POCD发生率的影响不显著,但该锻炼的确减缓了术后认知水平下降的趋势(比如,患者锻炼后MMSE总分及神经心理学测试得分/正确率下降趋势放缓,不锻炼的患者相比鍛炼的患者MMSE总分及神经心理学测试得分/正确率下降更剧烈),即在一定程度上起到了神经保护作用。
对于为何该锻炼在降低术后24 h及72 h POCD的发生率方面效益不显著,经分析认为可能与以下两个原因有关:①可能是“假阴性”结果,主要是由于干预剂量不足(锻炼强度、锻炼周期、锻炼频率等不足)或样本量过小所致;②可能与本研究的观察周期较短有关。POCD在术后24 h至术后半年(甚至更久)都可能发生,其发生率也因测评时间点的不同而存在差异。研究中,考虑到医疗资源的有效利用(医院对床位周转率的客观限制)、患者的实际恢复情况及住院经济成本等实际情况,结合本研究的研究目的(仅观察术后早期而非长期认知损害的情况),本研究的观察周期仅仅设为术后72 h,无更长周期的随访,所以不能否认,三线放松功锻炼可能对于术后72 h内POCD的发生率影响不显著,但或许对于术后7 d、30 d或半年内POCD的发生率具有一定的影响。而且,从POCD发生率的统计情况来看,在术后24~72 h,治疗组患者的POCD发生率仅从30.00%升高至33.33%(上升了3.33%),而对照组患者的POCD发生率却从33.33%升高至46.67%(上升了13.34%),升幅远超治疗组。由此可推测,或许POCD的发生率会随着术后时间延长进一步上升,由于本研究观察周期太短,所以两组间的涨幅差异虽然已有所体现,但是尚未达到统计学意义,如果继续延长观察周期,或许可以观察到统计学差异。当然,这些推测和假设需要更严谨的设计、更长期的随访去验证。
从本研究中还观察到,两组被试在术中一般情况无显著差异(p>0.05),也均无人在术后入住SICU。但是,治疗组患者在术后住院天数上明显短于对照组患者(p<0.05)。根据既往的研究结果,缩短患者术后住院时间可在一定程度上减少其术后认知能力的减退[43]。从这一角度也可以解释练习三线放松功对于POCD的有益防治效果。而且,缩短住院天数也有利于降低患者的经济成本、提高医疗资源的有效利用率。
4.2 三线放松功减轻术前焦虑的潜在效益与机制
术前焦虑与术后康复密切相关。例如高水平的术前焦虑可能会引起更大的术中出血量、术后疼痛、延长术后恢复期等[54-55],因此,有效管理术前焦虑也是围手术期医学领域重要的研究课题。
在本研究中观察到,与术前15 d相比,经三线放松功锻炼后,在术前1 d时,治疗组患者HAMA总分显著下降(p<0.05),提示治疗组患者的术前焦虑得到明显改善;未锻炼的对照组患者在术前1d时HAMA总分显著上升(p<0.05),提示随着手术的临近,患者的术前焦虑愈发明显。同时,两组别间HAMA总分比较有极显著差异(p<0.001)。因此,有理由推测,三线放松功可能是一种改善术前焦虑的有效非药物疗法。
三线放松功减轻焦虑的潜在机制在既往研究中已有所讨论。比如Chan等学者就曾从脑电层面证实三线放松功可通过优化相应脑区的θ和α脑波等电生理变化缓解焦虑、改善认知[19]。通过观察患者的三线放松功锻炼过程发现,这套功法旨在“以意行气,以气运功”,即在脑的调控下,由“意”生“气”,以“气”驭“意”,从而调动全身各有关器官、组织、细胞的生理机能,随着肌肉(或效应器)的活动而进行有序化的随“意”运动。而锻炼过程中将“气”灌注于脏腑、肢节、孔窍,通过肌肉“紧-松-紧”的交替张弛循环模式(非常类似于西方心理治疗技术中的Jacobsen渐进性肌肉放松训练[56]),配合口吐“松”字,有意识地在3条身体通路间管理肌肉、情绪、认知等身心功能,维持低水平的生理唤醒。
值得一提的是,术前焦虑也被认为是诱发POCD的潜在风险因素之一[27]。一项覆盖156例髋部骨折手术患者的跟踪性调查发现,术前焦虑显著增加了患者POCD的发生率[57]。另一项研究从性别角度证实体外循环心脏手术前患者存在紧张与焦虑情绪可增加术后发生POCD的概率,且女性更高[58]。神经心理学测试则发现,焦虑程度更高的患者在术后表现出更为显著的执行功能缺陷,尤其表现为更差的信息更新及转换能力、定势转换能力,工作记忆的表现也更差[59-62]。执行功能是认知功能的重要组成部分[63]。当术前焦虑共病术后抑郁时,这种执行功能的损害会表现得更为明显[61-62]。有学者认为,这是由于抑郁引发精神运动性迟滞导致的直接结果[61-62]。记忆也是重要的认知功能[64]。术前焦虑与术后记忆损害被证明存在“曲线关系”,即重度及轻度的焦虑均会引起记忆损害,但重度焦虑引起的术后记忆损害最为显著[59,65-66]。对于术前焦虑引起术后认知损害的神经机制尚不明确,但认为可能与杏仁核结构的变化有关[59-61]。杏仁核广泛参与情感过程(包括情感性学习、感知等)[67]。显著焦虑情绪下,杏仁核在协调无意识危险反应及情感整合中被异常激活,协同纹状体结构改变,及前扣带回皮质灰质体积减少,间接引起了认知功能的损害[67-69]。
5 结论
术前连续15 d的三线放松功锻炼可以被认为是一种安全有效的、有助于减少老年患者TURP术后早期认知功能损害的预防性策略。同时,该锻炼或还能在一定程度上减轻患者术前焦虑、缩短患者的术后住院天数,值得临床推广,但是,尚未有足够证据证明该锻炼可有效降低术后24 h及72 h的POCD发生率。
6 研究的局限性與展望
本研究尚存在一些局限性有待完善:①由于未能找到合适的能够与三线放松功形成对比的“安慰剂”,所以将对照组设置成空白对照。②样本资料相对偏少。③虽然在术后72 h内观测到练习三线放松功的患者相比未练习者认知损害程度更轻、POCD发生率更低,但未发现两组别间的显著统计学差异。这可能与观察周期太短有关。
研究展望:①进一步完善研究设计,根据Cochrane对于随机对照实验的质量评价标准开展更严谨的标准化临床研究,引入意向性分析和符合方案集分析对结局指标进行整合、分析。②扩大样本量,纳入更多手术类型,探讨三线放松功是否同样有益于心脏手术、关节置换术等其他手术引发的POCD。③寻找合适的“安慰剂”对照或盲法设计,开展多中心研究。④将观察周期延长至术后14 d或术后30 d,而更长期的随访可利用电话、微信等线上形式完成。⑤进一步探索术前焦虑在三线放松功改善POCD过程中是否存在“中介效应”。⑥取得临床疗效的基础上,利用人工智能、大数据等技术总结最佳的三线放松功运动处方(包括最佳的运动时间、运动频率、运动强度等)。
参考文献:
[1] BERGER M, NADLER JW, BROWNDYKE J, et al. Postoperative cognitive dysfunction: minding the gaps in our knowledge of a common postoperative complication in the elderly [J]. Anesthesiology Clinics, 2015, 33(3):517.
[2] NTALOUKA M P, ARNAOUTOGLOU E, TZIMAS P. Postoperative cognitive disorders: an update[J]. Hippokratia, 2018, 22(4): 147.
[3] URITS I, ORHURHU V, JONES M, et al. Current perspectives on postoperative cognitive dysfunction in the ageing population[J]. Turkish Journal of Anaesthesiology and Reanimation, 2019, 47(6): 439.
[4] HO Y S, ZHAO F Y, YEUNG W F, et al. Application of acupuncture to attenuate immune responses and oxidative stress in postoperative gognitive dysfunction: what do we know so far? [J]. Oxidative Medicine and Cellular Longevity, 2020: 9641904.
[5] ZHANG Y, BAO H G, LV Y L, et al. Risk factors for early postoperative cognitive dysfunction after colorectal surgery[J]. BMC Anesthesiology, 2019(19) :6.
[6] BROWN C, DEINER S. Perioperative cognitive protection [J]. British Journal of Anaesthesia. 2016, 117(S13): iii52.
[7] STEINMETZ J, CHRISTENSEN K B, LUND T, et al. Long-term consequences of postoperative cognitive dysfunction [J]. Anesthesiology, 2009, 110(3):548.
[8] EVERED L, SCOTT D A, SILBERT B, et al. Postoperative cognitive dysfunction is independent of type of surgery and anesthetic [J]. Anesthesia & Analgesia, 2011, 112(5):1179.
[9] YOUNG M J, ELMUSSAREH M, MORRISON T, et al. The changing practice of transurethral resection of the prostate[J]. Annals of the Royal College of Surgeons of England, 2018, 100(4):326.
[10] 朱志威,張代君,高成杰. 不同麻醉方式对老年患者经尿道前列腺电切术术后POCD发生率、血清S-100β及Aβ1-42水平的影响[J]. 中国医师杂志,2018, 20(5): 721.
[11] 杜恒彬. 经尿道前列腺等离子电切术后认知功能障碍临床分析[J]. 家庭医药,2019(5):194.
[12] 马玉倩,李宏. 老年经尿道前列腺电切术患者术后认知功能障碍危险因素分析[J]. 武警后勤学院学报(医学版),2018,27(10):856.
[13] JACOBS G D, FRIEDMAN R. EEG spectral analysis of relaxation techniques [J]. Applied Psychophysiology and Biofeedback, 2004, 29(4):245.
[14] GEISLER F C M, BECHTOLDT M N, OBERL?魧NDER N, et al. The benefits of a mindfulness exercise in a performance situation [J]. Psychological Reports, 2018, 121(5):853.
[15] DILLBECK M C, ORME-JOHNSON D W. Physiological differences between transcendental meditation and rest [J]. American Psychologist, 1987, 42(9):879.
[16] INFANTE J R, TORRES-AVISBAL M, PINEL P, et al. Catecholamine levels in practitioners of the transcendental meditation technique [J]. Physiology & Behavior, 2001, 72(1/2):141.
[17] JONES B M. Changes in cytokine production in healthy subjects practicing Guolin Qigong : a pilot study[J]. BMC Complementary and Alternative Medicine, 2001(1):8.
[18] 馬丽亚. 三线放松功对轻度认知功能损害干预效果的研究[D]. 上海:上海中医药大学,2016.
[19] CHAN A S, HAN Y M, CHEUNG M C. Electroencephalographic (EEG) measurements of mindfulness-based triarchic body-pathway relaxation technique: a pilot study[J]. Applied Psychophysiology And Biofeedback, 2008, 33(1):39.
[20] 李学菊. 从脑电、五态性格等变化探讨放松训练心身调节机制[D]. 北京:北京中医药大学,2004.
[21] ROSCZYK H A, SPARKMAN N L, JOHNSON R W. Neuroinflammation and cognitive function in aged mice following minor surgery [J]. Experimental Gerontology, 2008, 43(9):840.
[22] WAN Y, XU J, MA D, et al. Postoperative impairment of cognitive function in rats: a possible role for cytokine-mediated inflammation in the hippocampus [J]. Anesthesiology, 2007, 106(3):436.
[23] OGASAWARA K, YAMADATE K, KOBAYASHI M, et al. Effects of the free radical scavenger, edaravone, on the development of postoperative cognitive impairment in patients undergoing carotid endarterectomy[J]. Surgical Neurology, 2005, 64(4):309.
[24] 王耀光. 气功、太极拳锻炼对老年人SOD含量及活性影响的研究[J]. 中国气功,1998,1(5):11.
[25] 彭琳莹. 短期锻炼降低老年人POCD的发生和炎症因子水平[D]. 湖南:中南大学,2014.
[26] COCKRELL J R, FOLSTEIN M F. Mini-mental state examination (MMSE) [J]. Psychopharmacology Bulletin, 1988, 24(4):689.
[27] RUDOLPH J L, SCHREIBER K A, CULLEY D J, et al. Measurement of post-operative cognitive dysfunction after cardiac surgery: a systematic review [J]. Acta Anaesthesiologica Scandinavica, 2010, 54(6):663.
[28] PENG L, XU L, OUYANG W. Role of peripheral inflammatory markers in postoperative cognitive dysfunction (POCD): a meta-analysis [J]. PLOS One, 2013, 8(11):e79624.
[29] TERRANDO N, MONACO C, MA D, et al. Tumor necrosis factor-alpha triggers a cytokine cascade yielding postoperative cognitive decline [J]. Proceedings of the National Academy of Sciences, 2010, 107(47):20518.
[30] BASILE A M, FUSI C, CONTI A A, et al. S-100 protein and neuron-specific enolase as markers of subclinical cerebral damage after cardiac surgery: preliminary observation of a 6-month follow-up study [J]. European Neurology, 2001, 45(3):151.
[31] ENESTVEDT B K, EISEN G M, HOLUB J, et al. Is the American Society of Anesthesiologists classification useful in risk stratification for endoscopic procedures?[J]. Gastrointestinal Endoscopy, 2013, 77(3):464.
[32] OKEEFFE S T, MULKERRIN E C, NAYEEM K, et al. Use of serial mini-mental state Examinations to diagnose and monitor delirium in elderly hospital patients[J]. Journal of the American Geriatrics Society, 2005, 53(5):867.
[33] SNAITH R P, BAUGH S J, CLAYDEN A D, et al. The clinical anxiety scale: an instrument derived from the hamilton anxiety scale [J]. British Journal of Psychiatry, 1982(141):518.
[34] ZHENG J W, MENG B, LI X Y, et al. NF-κB/P65 signaling pathway: a potential therapeutic target in postoperative cognitive dysfunction after sevoflurane anesthesia [J]. European Review for Medical and Pharmacological Sciences, 2017, 21(2):394.
[35] DONATO R, CANNON B R, SORCI G, et al. Functions of S100 proteins [J]. Current Molecular Medicine, 2013, 13(1):24.
[36] JENSEN A R, ROHWER W D J R. The stroop color-word test: a review [J]. Acta Psychologica, 1966, 25(1):36.
[37] SWAN G E, CARMELLI D, LARUE A. Performance on the digit symbol substitution test and 5-year mortality in the western collaborative group study[J]. American Journal of Epidemiology, 1995, 141(1):32.
[38] 郭起浩,金麗琳,洪震 等. 动物流畅性测验在中国老人中的应用[J]. 中国心理卫生杂志,2007,21(9):623.
[39] KOTEKAR N, KURUVILLA C S, MURTHY V. Post-operative cognitive dysfunction in the elderly: A prospective clinical study [J]. Indian Journal of Anaesthesia, 2014, 58(3): 263.
[40] BILOTTA F, DORONZIO A, STAZI E, et al. Postoperative cognitive dysfunction: toward the alzheimers disease pathomechanism hypothesis[J]. Journal of Alzheimers Disease, 2010, 22(3): 81.
[41] BELROSE J C, NOPPENS RR. Anesthesiology and cognitive impairment: a narrative review of current clinical literature [J]. BMC Anesthesiology, 2019, 19(1): 241.
[42] RASMUSSEN L S. Postoperative cognitive dysfunction: incidence and prevention [J]. Best Practice & Research Clinical Anaesthesiology, 2006, 20(2): 315.
[43] WANG W, WANG Y, WU H B, et al. Postoperative cognitive dysfunction: current developments in mechanism and prevention [J]. Medical Science Monitor, 2014,20:1908.
[44] 胡艳婷,苏跃,赵斌江,等. 中医中药与老年患者术后认知功能障碍的研究进展[J]. 医学综述,2018,24(8):1612.
[45] LEE S S, LO Y, VERGHESE J. Physical activity and risk of postoperative delirium [J]. Journal of the American Geriatrics Society. 2019, 67(11):2260.
[46] SAFAVYNIA S A, GOLDSTEIN P. The role of neuroinflammation in postoperative cognitive dysfunction: moving from hypothesis to treatment[J]. Frontiers in Psychiatry, 2018(9): 752.
[47] FUNDER K S, STEINMETZ J. Post-operative cognitive dysfunction - lessons from the ISPOCD studies[J]. Trends in Anaesthesia & Critical Care, 2012, 2(3): 94.
[48] BARRIENTOS R M, FRANK M G, HEIN A M, et al. Time course of hippocampal IL-1 beta and memory consolidation impairments in aging rats following peripheral infection [J]. Brain, Behavior, and Immunity, 2009, 23(1):46.
[49] SHEERAN P, HALL G M. Cytokines in anaesthesia[J]. British Journal of Anaesthesia, 1997, 78(2):201.
[50] WILSON C J, FINCH C E, COHEN H J. Cytokines and cognition—the case for a head-to-toe inflammatory paradigm [J]. Journal of the American Geriatrics Society, 2002, 50(12):2041.
[51] YONG V W, KREKOSKI C A, FORSYTH P A, et al. Matrix metalloproteinases and diseases of the CNS[J]. Trends in Neurosciences, 1998, 21(2):75.
[52] GRAPE S, RAVUSSIN P, ROSSI A, et al. Postoperative cognitive dysfunction[J]. Trends in Anaesthesia and Critical Care, 2012, 2(3): 98.
[53] MINAGAR A, SHAPSHAK P, FUJIMURA R, et al. The role of macrophage/microglia and astrocytes in the pathogenesis of three neurologic disorders: HIV-associated dementia, Alzheimer disease, and multiple sclerosis [J]. Journal of the Neurological Sciences, 2002, 202(1/2):13.
[54] 謝敏,孙晓嘉. 术前焦虑的研究现状及进展[J]. 卫生职业教育,2012,30(15):153.
[55] 李慧姣,史静华. 日间手术病人术前焦虑的影响因素及护理研究进展[J]. 护理研究,2019,33(24):4258.
[56] LYNDA B, MELANIE L, CHARLES M. Cognitive behavioral therapy for insomnia in older adults [J]. Cognitive and Behavioral Practice, 2012, 19(1):101.
[57] 胡英. 术前焦虑对老年髋部骨折患者术后认知功能的影响[J]. 健康研究,2018,38(6):644.
[58] 汤海楠,杨薇. 紧张和焦虑对体外循环心脏手术患者术后认知功能的影响[J]. 中国实用神经疾病杂志,2016,19(11):69.
[59] NYAMATHI A, KASHIWABARA A. Preoperative anxiety: its affect on cognitive thinking [J]. AORN Journal, 1988, 47(1):164.
[60] HEM S, ALBITE R, LORESI M, et al. Pathological changes of the hippocampus and cognitive dysfunction following frontal lobe surgery in a rat model [J]. Acta Neurochirurgica, 2016, 158(11): 2163.
[61] BRUCE K M, YELLAND G W, SMITH J A, et al. Cognitive impairment after cardiac surgery: confounding factors and recommendations for improved practice [M]. Singapore: Springer, 2016: 32.
[62] LAALOU F Z, JOCHUM D, PAIN L. Postoperative cognitive dysfunction(POCD): strategy of prevention, assessment and management[J]. Annales Franaises dAnesthésie et de Réanimation, 2011, 30(10): e49.
[63] WIEBE S A, KARBACH J. Executive function: development across the life span[M]. New York: Taylor & Francis eBooks, 2018: 105.
[64] TORTELL P, TURIN M, YOUNG M. Memory [M]. British Columbia: Vancouver, 2018: 71.
[65] LIU R, BARRY J E, WEINMAN J. Effects of background stress and anxiety on postoperative recovery [J]. Anaesthesia, 1994, 49(5):382.
[66] AUST H, EBERHART L, STURM T, et al. A cross-sectional study on preoperative anxiety in adults[J]. Journal of Psychosomatic Research, 2018(111):133.
[67] EWBANK M P, PASSAMONTI L, HAGAN C C, et al. Psychopathic traits influence amygdala-anterior cingulate cortex connectivity during facial emotion processing [J]. Social Cognitive and Affective Neuroscience, 2018, 13(5):525.
[68] ADAMEC R. Amygdala kindling and rodent anxiety [M]. Boston: Springer, 1998: 48.
[69] HALLEY S A, WRENCH J M, REUTENS D C, et al. The amygdala and anxiety after epilepsy surgery[J]. Epilepsy & Behavior, 2010, 18(4):431.

