HPLC波长切换法同时测定经典名方槐花散中5种成分的含量
向泽栋 薛晴 于海涛 孙志强 李震 刘菊妍 张加余 高鹏 代龙

中圖分类号 R917 文献标志码 A 文章编号 1001-0408(2021)16-1964-05
DOI 10.6039/j.issn.1001-0408.2021.16.08
摘 要 目的:建立同时测定经典名方槐花散中芦丁、柚皮苷、新橙皮苷、槲皮素和胡薄荷酮等5种成分含量的方法。方法:采用高效液相色谱波长切换法。色谱柱为Cosmosil C18,流动相为乙腈-0.05%磷酸溶液(梯度洗脱),检测波长依次为257 nm(芦丁)、283 nm(柚皮苷、新橙皮苷)、254 nm(槲皮素)、252 nm(胡薄荷酮),流速为1.0 mL/min,柱温为30 ℃,进样量为10 μL。结果:芦丁、柚皮苷、新橙皮苷、槲皮素、胡薄荷酮检测质量浓度的线性范围分别为21.7~2 170、46~4 600、22.3~2 230、0.96~96、2.7~270 μg/mL(r均大于0.999);精密度、稳定性(24 h)、重复性试验的RSD均小于2%(n=6);平均加样回收率分别为100.70%、99.31%、101.10%、100.03%、99.63%(RSD均小于2%,n=9)。3批槐花散样品中,上述5种成分的含量分别为20.055~22.615、25.557~27.806、11.428~13.250、0.350~0.478、2.372~4.011 mg/g。结论:所建含量测定方法操作简便、结果准确、重复性好,可用于槐花散中5种成分的同时测定。
关键词 槐花散;高效液相色谱波长切换法;芦丁;柚皮苷;新橙皮苷;槲皮素;胡薄荷酮;含量测定
Simultaneous Determination of 5 Components in the Classical Formula Huaihua San by HPLC Wavelength Switching Method
XIANG Zedong1,XUE Qing1,YU Haitao2,SUN Zhiqiang2,LI Zhen1,LIU Juyan3,ZHANG Jiayu4,GAO Peng1, DAI Long4(1. College of Pharmacy, Shandong University of TCM, Jinan 250355, China; 2. Shandong Yuze Institute of Pharmaceutical and Health Industry Technology, Shandong Dezhou 251200, China; 3. Technology and Quality Department, Guangzhou Pharmaceutical Group Co., Ltd, Guangzhou 510130, China; 4. School of Pharmacy, Binzhou Medical University, Shandong Yantai 264003, China)
ABSTRACT OBJECTIVE: To develop a method for simultaneous determination of 5 components in classical formula Huaihua san, including rutin, naringin, neohesperidin, quercetin and pulegone. METHODS: HPLC wavelength switching method was adopted. The determination was performed on Cosmosil C18 column with mobile phase consisted of acetonitrile-0.05% phosphoric acid solution (gradient elution) at the flow rate of 1.0 mL/min. The detection wavelengths were set at 257 nm for rutin, 283 nm for naringin and neohesperidin, 254 nm for quercetin, 252 nm for pulegone, respectively. The column temperature was set at 30 ℃, and sample size was 10 μL. RESULTS: The linear range was 21.7-2 170 μg/mL for rutin, 46-4 600 μg/mL for naringin, 22.3- 2 230 μg/mL for neohesperidin, 0.96-96 μg/mL for quercetin, 2.7-270 μg/mL for pulegone (all r>0.999), respectively. RSDs of precision, stability (24 h) and reproducibility tests were all lower than 2% (n=6). Average recoveries were 100.70%, 99.31%, 101.10%, 100.03% and 99.63% (all RSD<2%, n=9). Among 3 batches of Huaihua san samples, the contents of above 5 components were 20.055-22.615, 25.557-27.806, 11.428-13.250, 0.350-0.478, 2.372-4.011 mg/g, respectively. CONCLUSIONS: Established method is simple, accurate and reproducible, and could be used for the simultaneous determination of 5 components in Huaihua san.
KEYWORDS Huaihua san; HPLC wavelength switching method; Rutin; Naringin; Neohesperidin; Quercetin; Pulegone; Content determination
槐花散始载于宋代许叔微所著的《普济本事方》,是治疗肠风脏毒的经典方[1]。该方为《古代经典名方目录(第一批)》第34方,具有清肠凉血止血、疏风行气的功效,主治风热湿毒、壅遏肠道、损伤血络证,常用于溃疡性结肠炎的临床治疗[2]。槐花散由槐花(炒)、侧柏叶(烂杵焙)、荆芥穗、枳壳(去穰细切,麸炒)等4味药材组成,依据文献[3-6]和2020年版《中国药典》(一部)[7],该方主要含有黄酮类(如槐花所含的芦丁和槲皮素、侧柏叶所含的槲皮苷、枳壳所含的柚皮苷和新橙皮苷)和单萜类(如荆芥穗所含的胡薄荷酮)成分。现代研究表明,上述6种成分均具有抗炎作用[8-11]。
目前,关于槐花散化学成分及质量控制的研究较少,主要集中在黄酮类成分的分离纯化、薄层鉴别和含量测定方面:例如,陈建真等[3]建立了AB-8大孔树脂分离纯化槐花散总黄酮的工艺;巨福星等[4]建立了槐花散中君药槐花(炒)主要成分芦丁的薄层鉴别法及其含量测定的高效液相色谱法(HPLC)。现有关于槐花散质量控制的研究仅以黄酮类成分作为指标,而方中荆芥穗具有祛风理血止血的功效,其主要成分胡薄荷酮具有薄荷香气,能够改善槐花散的气味,且具有显著的抗炎、止痛作用,也是该方的指标成分之一[12-13]。可见,仅对总黄酮类成分或单一成分进行控制已不能满足槐花散质量标准日益提高的要求。多指标成分的含量测定更符合中药复方多成分、多靶点治疗疾病的特点[5],也是控制槐花散质量的有效手段。虽然,吴笛等[6]利用HPLC技术,建立了同时测定槐花散中芦丁、柚皮苷、新橙皮苷、槲皮素等4种黄酮类成分含量的方法,但其未对方中单萜类有效成分进行测定;另外,该研究的检测波长为283 nm,芦丁、槲皮素等化学成分在该波长下不能达到最大吸收,检测灵敏度低、误差较大[14]。笔者在实验前期参考2020年版《中国药典》(一部)和相关文献发现,槐花散中芦丁、柚皮苷、新橙皮苷、槲皮素、胡薄荷酮分别在257、283、283、254、252 nm波长处存在最大吸收[7,14]。基于此,本研究建立了同时测定槐花散方中芦丁、柚皮苷、新橙皮苷、槲皮素和胡薄荷酮等5种成分(前期预实验未能成功检出槲皮苷)含量的HPLC波长切换法,旨在从整体层面有效控制槐花散的质量,亦为其临床安全有效应用提供参考。
1 材料
1.1 主要仪器
本研究所用主要仪器有Waters e2695型 HPLC仪(美国Waters司)、LC2030 型HPLC仪(日本Shimadzu公司)、ME104E型万分之一分析天平(瑞士梅特勒-托利多公司)、KQ-500DV型数控超声波清洗器(昆山市超声仪器有限公司)、DZKW-C型双列六孔恒温水浴锅(上海树立仪器仪表有限公司)等。
1.2 药品与试剂
芦丁(批号Y16M9S61523,纯度≥98%)、槲皮素(批号C01J10Y91727,純度≥98%)、胡薄荷酮(批号Y21F12Q138984,纯度≥98%)对照品均购自上海源叶生物科技有限公司;柚皮苷(批号110722-201815,纯度≥91.7%)、新橙皮苷(批号111857-201804,纯度≥99.4%)对照品均购自中国食品药品检定研究院;乙腈、磷酸为色谱纯,其余试剂均为分析纯,水为纯净水。
槐花(批号分别为200601、200605、200702)、侧柏叶(批号分别为200405、200406、200505)、荆芥穗(批号分别为200311、200202、200504)、枳壳(批号分别为200802、200807、200901)药材均购自安徽省亳州市思远药业销售有限公司,经原济南市药品检验所宋希贵主任药师鉴定,分别为豆科植物槐Sophora japonica L.的干燥花及花蕾、柏科植物侧柏Platycladus orientalis(L.)Franco的干燥枝梢和叶、唇形科植物荆芥Schizonepeta tenuisfolia Briq.的干燥花穗、芸香科植物酸橙Citrus aurantium L.及其栽培变种的干燥未成熟果实。槐花炮制品按2020年版《中国药典》(一部)槐花“炒槐花”项下方法制备;侧柏叶炮制品按槐花散处方捣碎,并按2020年版《中国药典》(四部)“0213炮制通则”清炒法炒至表面深黄色;枳壳炮制品按2020年版《中国药典》(一部)枳壳“麸炒枳壳”项下方法制备;荆芥穗炮制品按2020年版《中国药典》(一部)荆芥穗“饮片”项下方法制备[7,15]。上述炮制品均平行制备3批。将各批炮制品粉碎成细粉(过五号筛)后,按槐花散处方配制(各取细粉10 g,混合均匀),即得3批槐花散样品(编号分别为201201、201202、201203),真空密封保存,备用。
2 方法与结果
2.1 色谱条件
以Cosmosil C18(250 mm×4.6 mm,5 μm)为色谱柱,以乙腈(A)-0.05%磷酸溶液(B)为流动相进行梯度洗脱(0~5 min,15%A;5~10 min,15%A→20%A;10~20 min,20%A;20~25 min,20%A→35%A;25~35 min,35%A→65%A;35~45 min,65%A→95%A);检测波长依次为257 nm(0~16 min,芦丁)、283 nm(16~27 min,柚皮苷、新橙皮苷)、254 nm(27~31 min,槲皮素)、252 nm(31~45 min,胡薄荷酮);流速为1.0 mL/min;柱温为30 ℃;进样量为10 μL。
2.2 溶液的制备
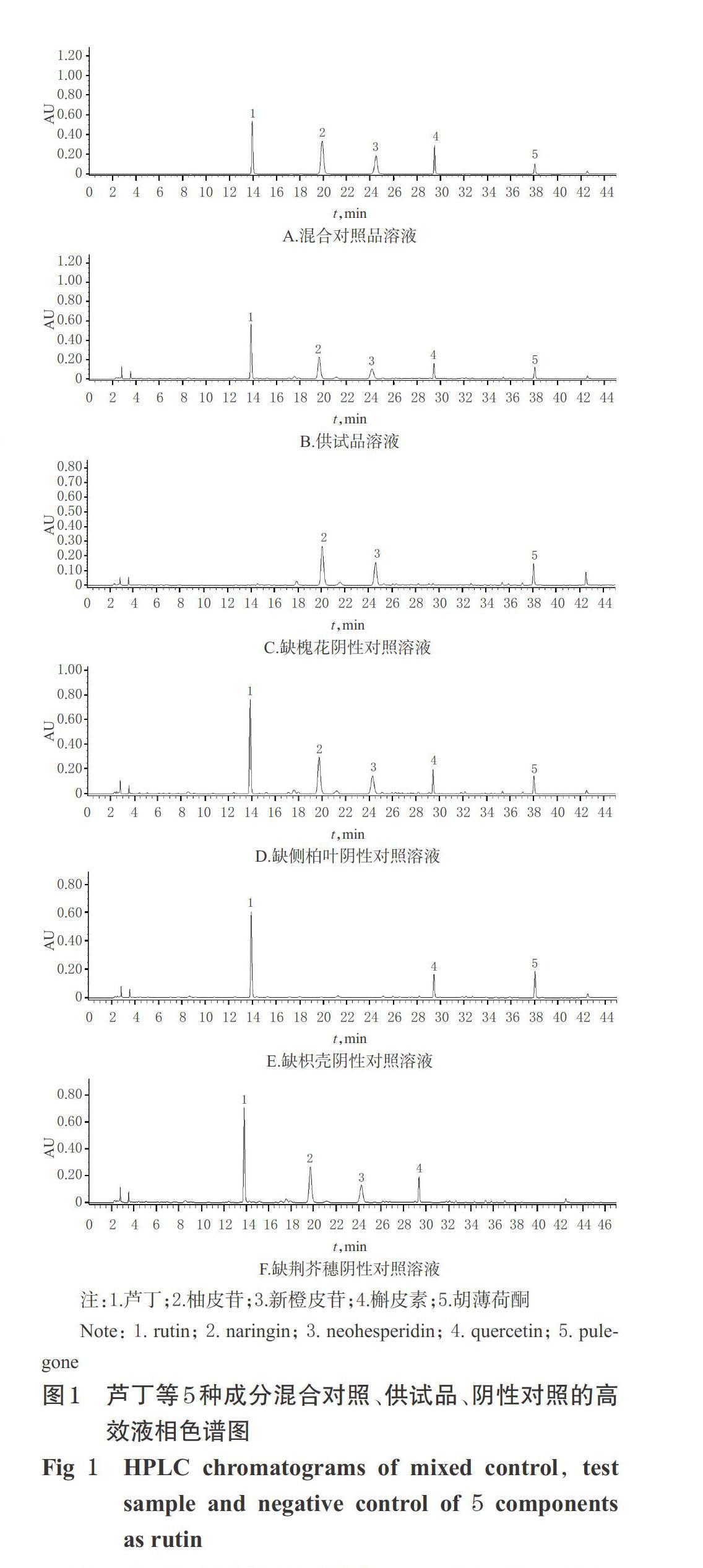
2.2.1 混合对照品溶液 精密称取干燥至恒定质量的芦丁、柚皮苷、新橙皮苷、槲皮素、胡薄荷酮对照品各适量,用甲醇制成质量浓度分别为200、500、200、10、30 μg/mL的混合对照品溶液。
2.2.2 供试品溶液 取槐花散样品约0.25 g,精密称定,置于具塞锥形瓶中,精密加入甲醇25 mL,称定质量,加热回流45 min,放冷,再次称定质量,用甲醇补足减失的质量,摇匀,经0.45 μm微孔滤膜滤过,取续滤液,作为供试品溶液。
2.2.3 阴性对照溶液 按槐花散处方要求,分别制备不含槐花、侧柏叶、枳壳、荆芥穗的阴性样品,再按“2.2.2”项下方法分别制备各阴性对照溶液。
2.3 专属性考察
分别精密吸取“2.2”项下混合对照品溶液、供试品溶液(编号201201)和阴性对照溶液适量,按“2.1”项下色谱条件进样测定,记录色谱图。结果,各待测成分色谱峰峰形较好且均已实现基线分离,分离度均大于1.5;阴性对照对待测成分的测定无干扰,详见图1。
2.4 线性关系考察
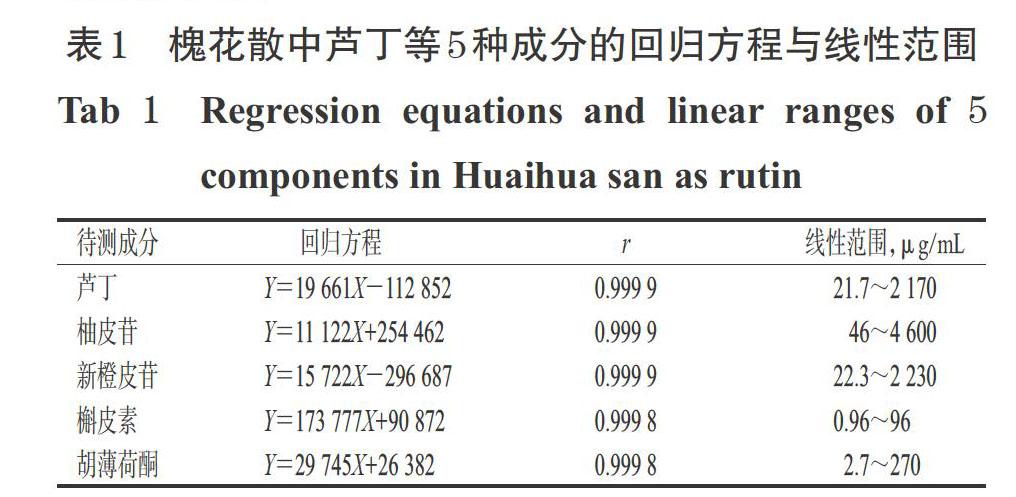
取干燥至恒定質量的芦丁、柚皮苷、新橙皮苷、槲皮素、胡薄荷酮对照品各适量,精密称定,用甲醇制成质量浓度分别为2 170、4 600、2 230、96、270 μg/mL的混合贮备液;取上述混合贮备液适量,用甲醇分别稀释5、10、50、100倍,制得芦丁质量浓度分别为434、217、43.4、21.7 μg/mL、柚皮苷分别为920、460、92、46 μg/mL、新橙皮苷分别为446、223、44.6、22.3 μg/mL、槲皮素分别为19.2、9.6、1.92、0.96 μg/mL、胡薄荷酮分别为54、27、5.4、2.7 μg/mL的线性工作溶液。取上述贮备液和线性工作溶液各适量,按“2.1”项下色谱条件进样测定,以各待测成分质量浓度(X,μg/mL)为横坐标、峰面积(Y)为纵坐标进行线性回归,结果见表1。
2.5 精密度试验
取“2.4”项下相应质量浓度的线性工作溶液(芦丁、柚皮苷、新橙皮苷、槲皮素、胡薄荷酮的质量浓度分别为217、460、223、9.6、27 μg/mL)适量,按“2.1”项下色谱条件连续进样6次,记录峰面积。结果,芦丁、柚皮苷、新橙皮苷、槲皮素、胡薄荷酮峰面积的RSD分别为0.61%、1.19%、0.46%、0.41%、0.24%(n=6),表明仪器精密度良好。
2.6 稳定性试验
精密吸取“2.2.2”项下供试品溶液(编号201201)适量,分别于室温下放置0、4、8、12、16、24 h时按“2.1”项下色谱条件进样测定,记录峰面积。结果,芦丁、柚皮苷、新橙皮苷、槲皮素、胡薄荷酮峰面积的RSD分别为0.91%、1.78%、1.54%、1.36%、0.96%(n=6),表明供试品溶液于室温下放置24 h内稳定性良好。
2.7 重复性试验
精密称取槐花散样品(编号201201)6份,每份约0.25 g,精密称定,按“2.2.2”项下方法制备供试品溶液,再按“2.1”项下色谱条件进样测定,记录峰面积并按外标法计算样品中5种待测成分的含量。结果,芦丁、柚皮苷、新橙皮苷、槲皮素、胡薄荷酮的平均含量分别为20.058、27.806、13.165、0.475、2.766 mg/g,RSD分别为1.03%、1.02%、1.22%、0.54%、0.25%(n=6),表明方法重复性良好。
2.8 加样回收率试验
精密称取已知含量(芦丁20.058 mg/g、柚皮苷27.806 mg/g、新橙皮苷13.165 mg/g、槲皮素0.475 mg/g、胡薄荷酮2.766 mg/g)的槐花散样品(编号201201)约0.125 g,精密称定,分别按已知量的0.8、1、1.2倍精密加入芦丁(0.512 4 mg/mL,4、5、6 mL)、柚皮苷(0.710 0 mg/mL,4、5、6 mL)、新橙皮苷(0.840 7 mg/mL,1.6、2、2.4 mL)、槲皮素(0.061 0 mg/mL,0.8、1、1.2 mL)、胡薄荷酮(0.353 2 mg/mL,0.8、1、1.2 mL)单一对照品溶液(按“2.2.1”项下方法制备),按“2.2.2”项下方法制备供试品溶液,再按“2.1”项下色谱条件进样测定,记录峰面积并计算加样回收率,结果见表2。
2.9 耐用性试验
精密称取槐花散样品(编号201201)适量,按“2.2.2”项下方法制备供试品溶液,再按“2.1”项下色谱条件以不同色谱仪(Waters e2695型、Shimadzu LC2030型HPLC仪)、不同色谱柱(Cosmasil C18、Kromasil C18,规格均为250 mm×4.6 mm,5 μm)、不同流速(0.8、1.0、1.2 mL/min)、不同柱温(25、30、35 ℃)进样测定,记录峰面积并按外标法计算样品中5种待测成分的含量。结果,改变上述色谱条件后,5种待测成分的色谱峰分离度均良好,含量的RSD均小于2.0%(n=3),表明方法耐用性良好。
2.10 样品含量测定
取3批槐花散样品,按“2.2.2”项下方法制备供试品溶液,再按“2.1”项下色谱条件进样测定,记录峰面积并按外标法计算样品中5种待测成分的含量。每样品平行操作3次,结果见表3。
3 讨论
3.1 提取条件的确定
本课题组前期考察了不同提取溶剂、不同提取方法对槐花散中5种待测成分提取效果的影响。首先,采用甲醇、70%甲醇、乙醇、70%乙醇等4种不同溶剂进行提取,结果发现,以甲醇为提取溶剂时,5种待测成分的提取效果明显优于其他3种溶剂。同时,本课题组还考察了超声提取30、45、60 min以及加热回流提取30、45、60 min的效果,结果发现,加热回流法的提取效果明显优于超声法,尤以回流45 min时各成分的提取效果最优,故选择甲醇为提取溶剂,加热回流提取45 min。
3.2 色谱条件的选择
本课题组前期考察了以0.05%、0.1%、0.5%等不同浓度甲酸、磷酸溶液为水相时各成分的分离效果,结果显示,各浓度磷酸溶液均能使5种待测成分完全分离,分离效果相似。同时,本课题组又考察了甲醇、乙腈为有机相对各成分分离效果的影响,结果发现,以乙腈为有机相时,各成分色谱峰峰形良好,色谱柱柱压低,为延长色谱柱的使用寿命,故选择乙腈-0.05%磷酸溶液为流动相。由于槐花散中芦丁等5种成分的极性差异较大,故采用梯度洗脱以保证在较短时间内实现对各成分含量的同时测定。本研究测定的5种待测成分主要为黄酮类和单萜类成分,最大吸收波长有较大差异,为准确测定各成分含量,笔者参考2020年版《中国药典》(一部)及相关文献[7,14],最终采用了波长切换法进行测定。
3.3 含量测定结果分析
本研究同时测定了槐花散中5种成分的含量,结果发现,槐花散中5种成分的平均含量从高到低為柚皮苷>芦丁>新橙皮苷>胡薄荷酮>槲皮素。不同批次槐花散中各成分的含量差异较大,推测这可能与所用药材的品质和炮制的操作过程有关。因此,在槐花散生产过程中,应注意投料药材质量的均一性和炮制过程的规范性,以保证槐花散的稳定性和临床用药的安全性。本课题组前期考察了槐花散中槲皮苷的测定,但并未检出,推测其在侧柏叶炮制过程中因受热而被破坏[6,16],因此未选择槲皮苷作为槐花散质量控制的指标成分。
本研究以经典名方槐花散为对象,成功建立了同时测定槐花散中芦丁、柚皮苷、新橙皮苷、槲皮素、胡薄荷酮等5种成分含量的HPLC波长切换法,该方法操作简便、结果准确、重复性好,可为经典名方槐花散的质量控制和临床安全用药提供参考。
参考文献
[ 1 ] 刘志威,王学群,李甜甜.槐花散对溃疡性结肠炎急性期糖皮质激素用量影响及疗效[J].牡丹江医学院学报,2017,38(4):66,69-71.
[ 2 ] 郭建平,夏勤,顿文亮,等.槐花散治疗溃疡性结肠炎肠风下血证作用机制研究[J].现代中医药,2020,40(5):9-14,21.
[ 3 ] 陈建真,季忆,陈彬.槐花散总黄酮大孔树脂分离纯化的工艺研究[J].中华中医药杂志,2015,30(7):2607-2609.
[ 4 ] 巨福星,丁兴莉,张蕾,等.槐花散质量标准研究[J].中兽医医药杂志,2018,37(6):58-61.
[ 5 ] 聂欣,庞兰,江华娟,等.经典名方化肝煎物质基准特征图谱及多指标成分含量测定研究[J].中草药,2020,51(20):5177-5186.
[ 6 ] 吴笛,雷昌. HPLC同时测定槐花散中4种黄酮类成分含量[J].中国中医药信息杂志,2020,27(6):69-72.
[ 7 ] 国家药典委员会.中华人民共和国药典:一部[S]. 2020年版.北京:中国医药科技出版社,2020:225,244,257,370.
[ 8 ] 刘琳,程伟.槐花化学成分及现代药理研究新进展[J].中医药信息,2019,36(4):125-128.
[ 9 ] 杨琳.槲皮苷药理活性研究进展[J].亚太传统医药,2015,11(6):61-63.
[10] 龚斌,李琴,胡小红,等.枳壳化学成分及药理作用研究进展[J].南方林业科学,2019,47(3):40-45.
[11] 温桃群.荆芥挥发油与胡薄荷酮对LPS中毒模型小鼠的抗炎效应及NLRP3通路机制研究[D].成都:成都中医药大学,2017.
[12] 程梦娟,耿晓桐,龚海燕,等.基于GC-MS的荆芥和荆芥穗饮片挥发油中化学成分特征分析[J].天然产物研究与开发,2021,33(3):362-372.
[13] RA J,CHUNG J H,LEE H,et al. Reduction of interleukin-1β induced matrix metalloproteinase-3 release by extracts of six plants:inhibitory screening of 35 traditional medicinal plants[J]. Immunopharmacol Immunotoxicol,2011,33(3):461-465.
[14] 马开,田萍,张迪文,等.波长切换HPLC法同时测定六神曲中9个成分的含量[J].药物分析杂志,2019,39(3):526-530.
[15] 国家药典委员会.中华人民共和国药典:四部[S]. 2020年版.北京:中国医药科技出版社,2020:31.
[16] 石典花,戴衍朋,苏本正,等.侧柏叶“炒炭存性”科学内涵初探[J].中草药,2020,51(23):5963-5971.
(收稿日期:2021-03-11 修回日期:2021-06-11)
(编辑:陈 宏)

