陆生伊萨酵母WJL-G4降解柠檬酸的条件研究
唐 莹,王金玲,2*,卢志全,蒋 莹,何红英,董 丹,晏雨辰,李巧月
(1 东北林业大学林学院 哈尔滨 150040 2 黑龙江省森林食品资源利用重点实验室 哈尔滨 150040 3 黑龙江省宾县农业技术推广中心 哈尔滨 150040)
柠檬酸(Citric acid)又名枸橼酸,学名2-羟基丙烷-1,2,3-三羧酸,是天然的有机多元羧酸[1-2],具有令人愉快的酸味,入口爽快,无后酸味,也是主要的中间代谢产物,参与三羧酸循环[3-4]。实际生产中,可作为安全无毒的防腐剂[5],酸味剂[6-7],被广泛用于各种饮料、汽水、葡萄酒、糖果、点心、饼干、罐头果汁、乳制品等食品的制造中[8]。
在以柠檬酸含量高的果实为原料生产的果汁、果酒及其它产品中,因柠檬酸含量较高而出现酒味酸涩、酒体粗糙等现象[2,9]。常用的降酸方法有物理、化学、生物降酸法。柯旭清等[10]采用树脂降酸法处理浸泡型树莓果酒,得到酒体清澈透明、醇香突显的果酒,然而物理降酸法不适于去除固定酸[11]。梁敏等[12]将碳酸钠等加入蓝靛果酒中,发现酒中酸含量降低,花色苷含量也降低了。化学降酸法虽简单易行,降酸效果明显,但往往影响果酒的口感、色泽,同时还会引入金属离子,导致酒体不稳定,如失光、混浊[13]等。生物降酸为现代降酸研究的发展方向。目前,关于降酸菌的研究大都是针对苹果酸,如酒球菌属(Oenococcus)、明串珠菌属(Leuconostoc)、乳杆菌属(Lactobacillus)和片球菌属(Pediococcus)等[14-15],通过苹果酸-乳酸发酵(Malolactic fermentation,MLF)能够较专一地把苹果酸转变成乳酸和CO2,从而达到降酸的目的[16]。文连奎等[17]分别在柠檬酸和苹果酸为唯一碳源的培养基上,筛选出1 株可以降解苹果酸和柠檬酸的酵母菌,鉴定为陆生伊萨酵母(Issatchenkia terricola),其发酵特性尚未见报道。陈思睿等[18]筛选降解柠檬酸的优良酵母菌种并应用于红树莓果汁降酸研究中,筛选出具有高效降解柠檬酸作用的非酿酒酵母菌,经鉴定、命名为陆生伊萨酵母WJL-G4(Issatchenkia terricola WJL-G4)、陆生伊萨酵母WJL-T2,分别接种于红树莓果汁中,果汁pH 值由3.08 分别升至3.36 和3.27,柠檬酸降解率分别达59.54%和58.55%,该结论为红树莓等柠檬酸含量高的水果提供有利的降解途径,然而关于该菌种代谢柠檬酸的途径尚未展开。
本试验中以实验室前期分离得到的陆生伊萨酵母WJL-G4 为试验菌种,探索其最佳降酸培养基配方、培养条件及其耐受性,为非酿酒酵母代谢柠檬酸的途径提供理论基础。
1 材料与方法
1.1 材料与试剂
1.1.1 材料 陆生伊萨酵母WJL-G4,由本实验室于树莓果园红树莓鲜果上筛选获得,并经形态学和分子生物学鉴定命名其为陆生伊萨酵母菌WJL-G4。
1.1.2 培养基及试剂 基础培养基为酵母浸粉10 g,硫酸镁1 g,柠檬酸20 g,溶于1 000 mL 蒸馏水中。配制固体培养基时,加入琼脂25 g,溶于800 mL 蒸馏水中,柠檬酸溶于200 mL 水中,121℃高压蒸汽灭菌20 min。灭菌后冷却到50~60 ℃,混合倒平板。
柠檬酸,天津市致远化学试剂有限公司;酵母浸粉、牛肉膏、蛋白胨,北京奥博星生物技术有限责任公司;硫酸镁、硫酸铵、尿素、硝酸钾、硫酸锌、硫酸铁、磷酸二氢钾、氯化钠、硫酸锰、亚硫酸氢钠、无水乙醇等均为国产分析纯,天津市天力化学试剂有限公司。
1.2 仪器与设备
ELx800NB 型酶标仪,美国Bio Tek 公司;BS 200S-WEI 电子天平,北京赛多利斯仪器系统有限公司;722 型可见分光光度计,上海光谱仪器有限公司;手提式压力蒸汽灭菌锅,上海博迅实业有限公司医疗设备厂;SW-CJ-IPO 净化工作台,南京晓晓仪器设备有限公司;SHZ-C 水浴恒温振荡器,上海博迅实业有限公司。
1.3 试验方法
1.3.1 陆生伊萨酵母种子液的制备
1)种子液制备[19]用接种环挑取1 环保藏于4 ℃冰箱中的陆生伊萨酵母菌WJL-G4,划线于基础固体培养基,于28 ℃恒温培养箱活化培养24 h,挑取形态饱满的菌落,接种于100 mL/250 mL锥形瓶的现配基础液体培养基,于28 ℃、120 r/min 摇床培养12 h,加入4 粒无菌玻璃珠,震荡10 min,制得种子液,并测定活菌数为2.25×108CFU/mL,放入4 ℃冰箱,待用[20]。
2)培养条件 种子液以体积分数1%接种量接入,28 ℃、120 r/min 摇床培养,时间12 h,装液量为100 mL/250 mL 锥形瓶。
3)菌种保藏 长期保存(30 d),试管斜面低温保藏;短期(3~5 d),定期移接。
1.3.2 生长曲线绘制 取种子液以1%(v/v)接种量转接于100 mL/250 mL 锥形瓶液体培养基,于28 ℃,120 r/min 摇床培养。4 h 后每隔1 h 混匀取样,测定波长600 nm 处的吸光值(以“OD600nm”计),重复3 次。以取样时间(h)为横坐标,OD600nm为纵坐标,绘制酵母细胞生长曲线[21-22]。
1.3.3 菌种降酸培养基研究 以基础培养基为对照,首先确定菌种对柠檬酸的最大耐受范围,取种子液分别接种于柠檬酸质量浓度为20,40,60,80,100,120,140 g/L 的液体培养基中,以OD600nm为生长量指标判断菌种最大柠檬酸耐受质量浓度;然后取种子液分别接种于柠檬酸质量浓度分为1,5,10,15,20,25 g/L 的液体培养基中,以降酸率和生长量为指标筛选最适柠檬酸质量浓度;以不加氮源的基础培养基作为对照,选取酵母浸粉、牛肉膏、蛋白胨、硫酸铵、尿素、硝酸钾代替基础培养基中的氮源配制培养基,使含氮量为1 g/L,筛选最适氮源;以筛选出的最佳氮源分别添加1,5,10,15,20 g/L 的质量浓度筛选最适氮源的质量浓度。
以不加无机盐的基础培养基作为对照,选取硫酸亚铁、硫酸锌、硫酸铁、磷酸二氢钾、氯化钠、硫酸锰、硫酸镁代替基础培养基中的无机盐配制培养基,使含盐量为0.01 mol/L,筛选最适无机盐;以最适无机盐添加量为添加0.001,0.005,0.01,0.015,0.02 mol//L,筛选出最适无机盐的最适添加量。
1.3.4 菌种降酸条件及生长特性研究 取上述种子液以1%(v/v)接种量,接种于100 mL/250 mL 锥形瓶液体培养基,分别置于25,28,30,33,35 ℃,于120 r/min 摇床培养48 h,通过测定降酸率和OD600nm确定最适温度;取种子液以1%(v/v)接种量,分别接种于装液量为20,40,60,80,100 mL/250 mL 锥形瓶液体培养基中,于28 ℃、120 r/min摇床培养48 h 后,通过测定降酸率和OD600nm确定装液量;取种子液分别按1%,2%,3%,4%,5%(v/v)的接种量接种于100 mL/250 mL 锥形瓶液体培养基,于28 ℃、120 r/min 摇床培养48 h,通过测定降酸率和OD600nm来确定接种量;取陆生伊萨酵母菌种子液以1%(v/v)接种量,接种于100 mL/250 mL 锥形瓶液体培养基,置于转速分别为80,120,160,200,240 r/min 的震荡培养箱中,于28 ℃,培养48 h,通过测定降酸率和OD600nm确定最适转速。
1.3.5 菌种培养条件的优化试验设计 在1.3.4节试验结果的基础上,选取温度、接种量、装液量、转速4 个因素和相应的三个水平,采用 L9(34)正交表安排试验进行正交试验,以降酸率和OD600nm为考察指标,对正交试验的结果进行方差分析,进一步优化降酸条件,正交试验设计见表1。

表1 正交因素水平表Table 1 Factors and levels of orthogonal test
1.3.6 菌种耐受性研究 取上述种子液以1%(v/v)接种量分别接于不同质量浓度的SO2和不同酒精体积分数的液体培养基中,于上述培养条件培养,取菌悬液,测定OD600nm,确定该菌种对SO2和酒精的耐受量。
1.4 指标测定方法
1)生长量 采用分光光度法,测定菌液在波长600 nm 处的吸光值,以“OD600nm”计。
2)总酸[23]参考GB/T 12456-2008《食品中总酸的测定》中NaOH 滴定法(以柠檬酸计,单位g/L)。

式中,ρ0——降解前柠檬酸的质量浓度,g/L;ρ1——降解后柠檬酸的质量浓度,g/L。
1.5 数据处理
每个试验3 次重复,数据以平均值±标准差显示,数据采用Excel、SPSS 软件进行分析处理并作图。
2 试验结果
2.1 生长曲线
由图1可知,陆生伊萨酵母与一般酵母菌生长曲线基本一致,经历迟缓期、对数生长期、稳定期和衰亡期,这与姚博等[24]研究的浆水中酵母菌生长曲线结果一致。该菌种较党辉等[25]研究的馒头中酵母菌Y-1、Y-2 和AQ 迟缓期略长,这说明该菌种在以柠檬酸为唯一碳源的培养基中,适应新环境而合成必需的酶、辅酶及中间代谢产物的时间较长。8~18 h 为该菌株对数生长期,此时菌种的细胞生长速率最大,酶系活跃,代谢旺盛,且抗不良环境的能力最强;20 h 后,菌种生长速率下降,进入稳定期。随着培养时间的延长,受培养基中营养成分的限制,菌种发酵34 h,进入衰亡期。

图1 陆生伊萨酵母WJL-G4 的生长曲线图Fig.1 Growth curve of Issatchenkia terricola WJL-G4
2.2 降酸培养基的优化
2.2.1 柠檬酸对菌种降酸率及生长量的影响 进行最适柠檬酸质量浓度筛选时,首先对该菌种能耐受最大柠檬酸质量浓度进行确定,结果如图2a所示。不同柠檬酸质量浓度的培养基对应的pH值见表2,不同柠檬酸质量浓度对菌种降酸率及生长量的影响如图2b所示。
由图2a 可知,当柠檬酸质量浓度≤60 g/L时,菌种的生长基本不受抑制。当柠檬酸质量浓度≥80 g/L 时,菌种生长量呈现显著降低趋势(P<0.05),这可能是由于柠檬酸质量浓度过高,导致培养基渗透压过高,不利于酵母生长[26]。由表2可知,该菌中耐受最大pH 值为2.41,当菌种生长环境的pH<2.41,则会影响菌种的生长。因此,菌种耐受柠檬酸的最大质量浓度为60 g/L,对应的pH值为2.41。

表2 不同柠檬酸质量浓度对应的pH 值Table 2 pH value corresponding to different citric acid mass concentrations
饶炎炎等[27]测得树莓中柠檬酸含量为17.21 g/L;张晶琳等[28]测得春香和柠檬2 个品种的柑橘有机酸含量为7 g/L 左右,可见不同果实柠檬酸含量不同。为了得到菌种降解柠檬酸的最佳质量浓度,进一步进行柠檬酸质量浓度的筛选。由图2b可知,柠檬酸质量浓度在1~25 g/L 范围内,菌种降酸率随质量浓度的增加先增加后趋于平稳。文连奎等[17]的试验结果显示,当试验培养基总酸质量浓度大于12 g/L 时,试验菌种对L-苹果酸的降解能力变化不大,但对柠檬酸的降解能力明显减小,这可能是因为当酸质量浓度大于12 g/L 时,会影响菌种代谢产生的降酸酶的作用。本研究中,柠檬酸质量浓度在10 g/L 时,降酸率最高为92.9%,OD600nm为1.269,且此时菌种降酸率与5 g/L 时无显著性差异(P>0.05),其生长量除了与1 g/L 时呈现显著性差异(P<0.05),与其它均无显著性差异(P>0.05)。鉴于目的是降低柠檬酸含量,故选取柠檬酸质量浓度10 g/L 作为最佳碳源添加量。

图2 柠檬酸质量浓度对陆生伊萨酵母WJL-G4 生长量及降酸率的影响Fig.2 Effects of citric acid mass concentrations on deacidification and growth of Issatchenkia terricola WJL-G4
2.2.2 氮源种类及添加量对降酸率及生长量的影响 氮源的作用是为微生物细胞提供氮元素及能量,不同氮源对微生物有不同的生理学效应[29]。氮也是组成核酸和蛋白质的重要元素,为微生物提供合成细胞物质代谢产物的原料[30]。不同氮源及添加量对菌种降酸率及菌种生长量的影响如图3所示。
由图3可知,相同含氮量条件下,不同种类的氮源对菌种降酸率及生长量影响不同。从图3a 可知,与无机氮源相比,有机氮源更适合菌种生长并有利于柠檬酸降解,这与文连奎等[17]的试验结果一致。添加酵母浸粉时,菌种降酸率和生长量最大。图3b 表明,酵母浸粉的添加量为5 g/L 时,菌种降酸率为63.08%,与其它添加量呈显著性差异(P<0.05),且此时菌种生长量OD600nm最大。故选酵母浸粉为降酸最佳氮源,其最适添加量为5 g/L。

图3 不同氮源种类及添加量对陆生伊萨酵母WJL-G4 降酸率及生长量的影响Fig.3 Effects of different nitrogen source types and addition amount on deacidification rate and growth of Issatchenkia terricola WJL-G4
2.2.3 无机盐种类及添加量对降酸率及生长量的影响 无机盐在微生物生长过程中起着十分重要的作用,如构成细胞物质、调节渗透压等。不同种类的无机盐及添加量对菌种降酸率及生长量的影响如图4。
由图4a 可知,相同浓度下,供试的无机盐因种类不同,菌种降酸率也不同。其中,添加硫酸镁时菌种降酸率为65.56%,大于其它供试无机盐,然而此时菌种生长量却不是最大,可能是因为菌种降酸率与生长量不是呈正相关关系,还需进一步研究。由图4b 可知,当硫酸镁的添加量为0.005 mol/L 时,菌种降酸率均最大,但与0.001,0.01 mol/L 时的降酸率和生长量均无显著性差异(P>0.05)。考虑到节约成本,选择最佳无机盐硫酸镁的添加量为0.001 mol/L。

图4 无机盐种类及硫酸镁浓度对菌种降酸率及生长量的影响Fig.4 Effects of inorganic salt types and the amount of magnesium sulfate on deacidification rate and growth of Issatchenkia terricola WJL-G4
2.3 菌种降酸率及生长量的单因素试验
温度是影响菌种生长的主要因素之一,同时也是影响菌种功能性的主要因素[31]。根据图5a 可知,温度为25 ℃和35 ℃时,菌种的降酸率较低,且生长量小。温度为28 ℃时,菌种降酸率最大,为60.59%,且与30 ℃时无显著性差异(P>0.05)。实际应用中,考虑到减少能耗,选择28 ℃为最佳降酸温度。
由图5b 可知,转速为80 r/min 时,菌种的降酸率、生长量与其它转速条件相比呈现显著性降低(P<0.05)。当转速为240 r/min 时,菌种降酸率、生长量均达最高,但降酸率与200 r/min 时相比无显著性差异(P>0.05)。鉴于实际生产中转速高会出现菌液溅出等不良现象,且考虑到减少能耗,故最佳转速选为200 r/min。
由图5c 可知,随着接种量增加,菌种降酸率、生长量呈先增加后趋于稳定的趋势。接种量在3%,4%,5%(体积分数)时,菌种降酸率无显著性差异(P>0.05);接种量在2%时,菌种降酸率、生长量与1%相比无显著性差异(P>0.05),但较体积分数3%,呈现显著性差异(P<0.05)。因此,接种量选为1%(体积分数)。
由图5d 可知,当装液量≥60 mL 时,菌种的降酸率及生长量均有所下降,并都具有显著性差异(P<0.05)。装液量在20 mL 和40 mL 时,菌种的降酸率及生长量较高,且均无显著性(P>0.05)。这与王恳[32]的试验结论一致,当装液量大于50 mL,试验菌种降酸能力有所下降。考虑到经济因素,故选取40 mL 为降酸最佳装液量。

图5 不同条件对陆生伊萨酵母WJL-G4 降酸率及生长的影响Fig.5 Effects of different conditions on deacidification rate and growth of Issatchenkia terricola WJL-G4
2.4 降酸率与生长量的正交优化试验
陆生伊萨酵母菌降解柠檬酸条件优化正交试验结果见表3,方差分析见表4和5。
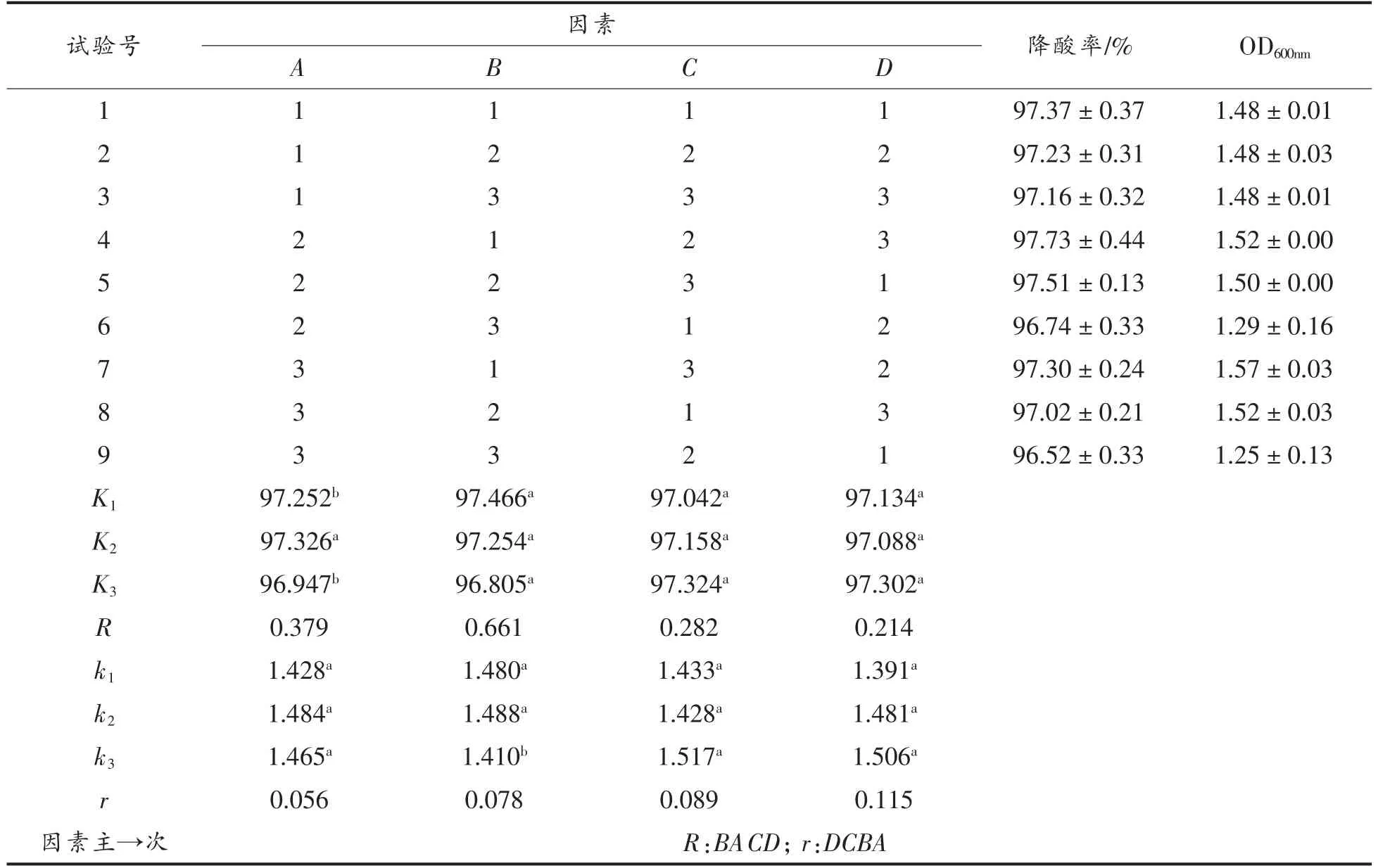
表3 陆生伊萨酵母WJL-G4 降酸率和OD600nm 试验结果分析Table 3 Analysis of results of deacidification rate and OD600nm test of Issatchenkia terricola WJL-G4
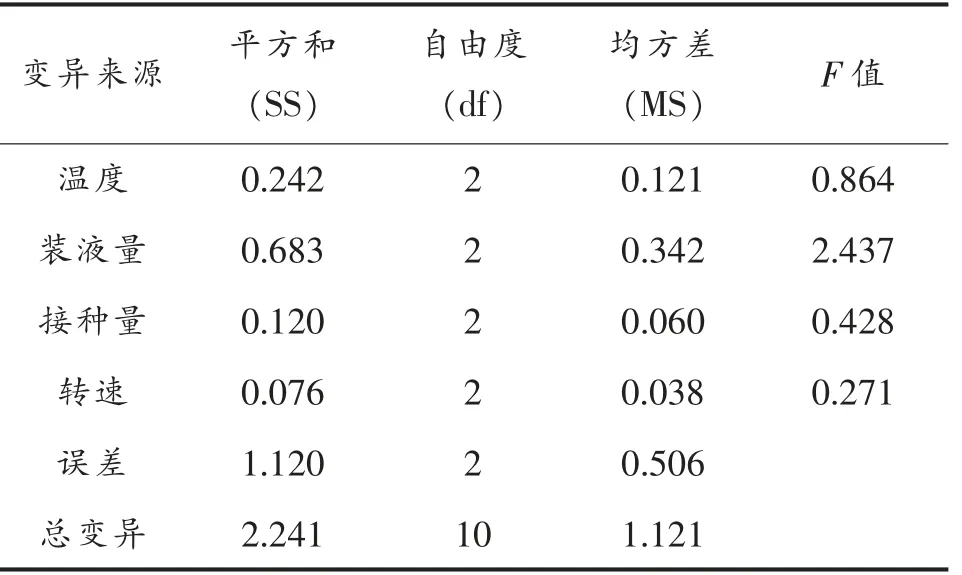
表4 陆生伊萨酵母WJL-G4 降酸率试验结果的方差分析Table 4 Analysis of variance of test results of deacidification rate of Issatchenkia terricola WJL-G4
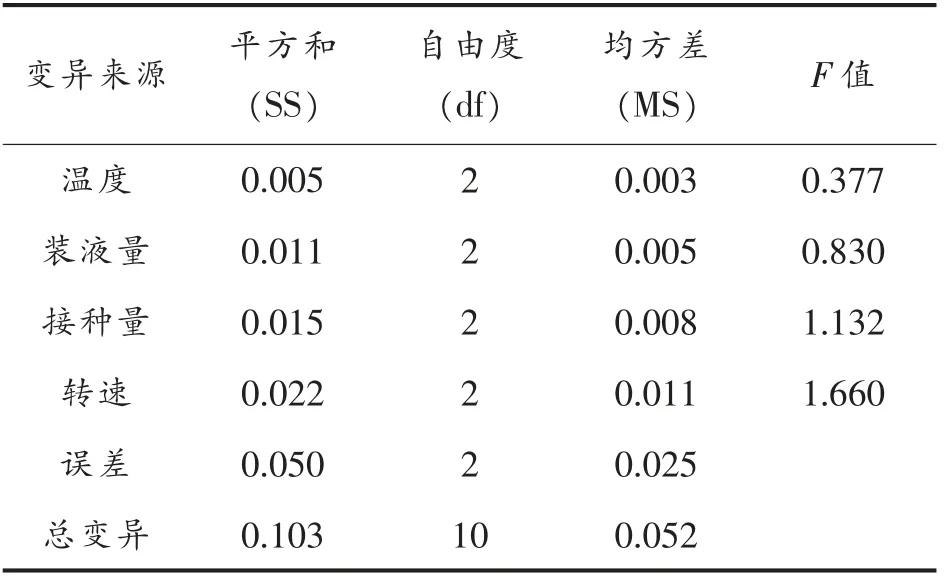
表5 陆生伊萨酵母WJL-G4 OD600nm正交试验结果的方差分析Table 5 Analysis of variance of test OD600nm of Issatchenkia terricola WJL-G4
由表3和4可知,对于因素B,菌种生长量在B1和B2水平间无显著性差异,而在B3水平间显著降低(P<0.05),其降酸率在3 个水平间无显著性差异(P>0.05),鉴于降酸率是本试验的第一考察指标,且考虑经济因素,因此以B3为最佳。对于因素A,菌种降酸率在A2与A1和A3水平间呈现显著性差异(P<0.05),其生长量在3 个水平下差异不显著,因此,选取A2为最佳水平。对于因素C和D,菌种降酸率和生长量均无显著性差异(P>0.05),考虑到经济因素,在实践中为了节约能耗,故选取C1和D1为最佳。综合比较得出:陆生伊萨酵母菌WJL-G4 降解柠檬酸的最佳条件为B3A2C1D1,即温度28 ℃、装液量40 mL/250 mL、接种量为1%(v/v)、转速为160 r/min。
2.5 时间对菌种降酸率及生长量的影响
根据2.4 节的优化试验结果,测定不同时间该菌种的降酸效果及生长量,结果如图6所示。
由图6可知,降酸率随着时间的延长呈现增大的趋势,在48 h 时,菌种降酸率为97.26%,与2.4 节中试验号为6 的试验结果无显著性差异(P>0.05),这也验证了2.4 节的菌种降酸条件优化结果。当时间≥24 h,菌种生长量无显著性增加(P>0.05)。当时间为48 h,菌种降酸率为97.26%,与36 h 时相比具有显著性差异(P<0.05),而与60 h时相比无显著性差异(P>0.05)。饶炎炎等[27]测定红树莓果酒0~300 d 发酵过程中有机酸的变化,结果显示,主要有机酸柠檬酸的含量变化范围是17.21~11.40 g/L。水果中的主要有机酸含量为0.2%~0.3%[33]。根据GB 15037-2006 《葡萄酒》中的规定,甜葡萄酒、加香型葡萄酒的总酸含量要求在5.0~8.0 g/L(以酒石酸计)范围。通过计算得知,当菌种降酸时间为12 h,树莓发酵过程中的总酸含量已经达到要求,且考虑到经济、效率因素,故最佳降酸时间选为12 h,降酸率为91.82%。

图6 时间对菌种降酸及生长的影响Fig.6 Effects of culture time on acid reduction and growth of Issatchenkia terricola
2.6 耐受性试验结果
由图7a 可知,当SO2质量浓度≤8 mg/L 时,菌体生长基本不受抑制;SO2质量浓度>10 mg/L时,菌种生长量急剧下降。Chang 等[34]的研究表明,SO2通过干扰蛋白质的运输,并与辅酶和维生素结合,最终导致细胞的死亡。在果酒发酵前,SO2的通入量一般在60~100 mg/L 范围,就可以抑制其它菌的生长[32]。因此,菌种可耐受8 mg/L SO2,降酸过程中应先接入本降酸菌进行降酸,以免由于菌种不能耐受SO2而影响降酸效果,也可在实际应用中,通过控制SO2通入量从而控制降酸程度。
由图7b 可知,菌种的生长量在酒精体积分数为6%时,呈现显著性下降(P<0.05)。因此,该降酸菌能耐受的最高酒精体积分数为5%。这与文连奎等[17]的试验结果一致,该降酸菌不能耐受较高酒精度。因此,在实际降酸应用中,可以利用酒精发酵控制降酸程度。

图7 SO2 和酒精对陆生伊萨酵母WJL-G4 生长的影响Fig.7 Effects of SO2 and alcohol concentration on the growth of lssatcheakia terricnla WJL-G4
3 结果与讨论
水果中的主要有机酸为柠檬酸、苹果酸、酒石酸和抗坏血酸,总含量约为0.2%~3.0%[33]。Yu 等[35]研究发现,甜橙中的主要有机酸为柠檬酸。Kim等[36]试验结果显示,猕猴桃中柠檬酸含量占总酸含量的60%~80%。生物降酸由于对原料的成分、色泽、风味和稳定性影响较小,而使得筛选具有降酸能力的酵母菌成为研究热点。Lucio 等[37]通过同时接种植物乳杆菌和酿酒酵母混合发酵,可以控制葡萄酒的酸度。杨华[38]将从130 株菌株中筛选降酸效果最好的菌株BY-9 接种至红豆越橘果酒中,使其总酸度降低12.26%。郝爱玲等[2]为获得降解柠檬酸并可应用于酸含量较高的猕猴桃国酒发酵的优良菌株,筛选降解柠檬酸的酵母,试验发现菌株M130 能够将猕猴桃中的柠檬酸由13.12 g/L降至10.74 g/L,且发酵结束后,酒体澄清、透明、香气浓郁,然而未见其对降酸的机理的深一步探究。目前,专门针对柠檬酸降解的菌种研究较少,且降酸率很难达到90%及以上,制约了柠檬酸型果实生产加工的发展,也进一步限制菌种代谢柠檬酸途径的研究。本试验中使用的具有降酸功能的菌株属于非酿酒酵母,与酿酒酵母相比,其在形态特征、生理生化特性、遗传及代谢等方面存在着较大的差异,尤其是许多非酿酒酵母具有独特的生化代谢特征,显示出良好的工业应用前景[39],其代谢有机酸途径及机理还有待进一步研究。试验中发现,在以柠檬酸为唯一碳源的培养基中生长,通过碳源、氮源和无机盐最佳降酸量的选择以及最适降酸条件的优化,使得陆生伊萨酵母菌WJL-G4的降酸率可达90%。
本试验中,为了提高陆生伊萨酵母菌WJLG4 降解柠檬酸的程度,对该菌株最佳降酸培养基配方及条件进行筛选。其中,培养条件的优化是提高微生物发酵生产水平的重要因素[40]。试验结果表明,该降酸菌最佳培养基配方为柠檬酸质量浓度10 g/L,最佳氮源为酵母浸粉,其添加量为5 g/L,最适无机盐为硫酸镁,其添加浓度为0.001 mol/L。陆生伊萨酵母菌降解柠檬酸的最佳条件优化方案为温度28 ℃、装液量40 mL/250 mL 锥形瓶、接种量1%(体积分数)、转速160 r/min,时间12 h,此时降酸率达91.82%、OD600nm为1.55,且菌种耐受SO2的最大质量浓度及酒精体积分数分别为8 mg/L 和5%。
4 结论
陆生伊萨酵母菌WJL-G4 具有降解柠檬酸的功能,且在最佳降酸条件下降酸率可达90%,其降酸效率较优化前显著提高,本研究为非酿酒酵母代谢柠檬酸的途径提供理论基础,也丰富了柠檬酸型水果及其加工品降酸工艺的研究内容。

