克雷伯氏菌Z3还原Cr(Ⅵ)的细胞定位及相关功能蛋白分析
曹子敬, 张智超, 高明, 杜文涛, 张继冉, 张世敏, 吴坤, 徐淑霞
(河南农业大学生命科学学院,河南 郑州 450002)
随着中国工业水平的提高,铬(Cr)及其化合物在电镀、冶金、印染、制革等行业中的应用越来越广泛,大量的含Cr废水、废渣对环境造成了严重的危害[1]。Cr在环境中通常以Cr(Ⅲ)和Cr(Ⅵ)的形式存在,其他价态为中间过渡态[2-3]。Cr(Ⅲ)在人类机体中参与脂肪、葡萄糖和蛋白质代谢[4],在环境中迁移率低,无致癌性;而Cr(Ⅵ)毒性最强,易被生物体吸收,具有强氧化性、致突变性和生物富集性,是公认的致癌金属物之一[5-6]。因此,将高毒性的Cr(Ⅵ)还原为低毒性的Cr(Ⅲ)是治理Cr污染的有效途径[7]。微生物还原法对Cr污染治理效果好,具有操作方便和无二次污染等优势,具有广阔的发展前景。大多数研究表明,微生物对Cr(Ⅵ)的还原方式为胞内还原,如ACKERLEY等[8]发现,Pseudomonasputida能够在好氧条件下利用胞内的可溶性还原酶ChrR对Cr(Ⅵ)进行还原;也有研究显示,微生物通过分泌胞外酶对Cr(Ⅵ)进行胞外还原,如韩剑宏等[9]对Micrococcusluteus细胞各组分还原能力的研究发现,胞外分泌物具有较高的还原能力,还原部位发生在胞外。相对于胞内还原,胞外还原由于发生在菌体细胞外,不会导致Cr在菌体细胞内蓄积。
克雷伯氏菌(Klebsiellasp.)是无芽孢、无鞭毛、有荚膜的革兰氏阴性菌[10],该菌还原Cr(Ⅵ)的研究已有相关报道。刘洪艳等[11]分离得到的克雷伯氏菌KB52,在添加Fe(Ⅲ)的条件下对Cr(Ⅵ)的还原率最高为42%。目前,克雷伯氏菌还原Cr(Ⅵ)的细胞定位未见报道。克雷伯氏菌Z3是1株从矿渣堆放区土壤中分离得到的嗜碱性Cr(Ⅵ)高效还原细菌,其还原Cr(Ⅵ)的最适温度为36 ℃,最适pH值为9.0,适宜条件下Cr(Ⅵ)还原率高达92%[12]。为了研究微生物对Cr(Ⅵ)的还原位置、不同位置的还原能力以及微生物还原Cr(Ⅵ)的全细胞蛋白表达差异,本研究以菌株Z3为研究对象,运用能量色散X射线谱(energy dispersive spectroscopy, EDS)、X射线光电子能谱分析(X-ray photoelectron spectroscopy, XPS)、扫描电镜(scanning electron microscope, SEM)、双向电泳等技术,研究了Cr在菌株Z3内的细胞分布特征、细胞各组分对Cr(Ⅵ)的还原能力以及Cr胁迫条件下菌株Z3的全细胞蛋白表达差异。本研究旨在揭示菌株Z3还原Cr(Ⅵ)的细胞定位,以及还原过程中相关蛋白的功能,以期为Cr(Ⅵ)的污染治理提供理论支持。
1 材料与方法
1.1 试验材料
1.1.1 菌株 克雷伯氏菌(Klebsiellasp.) Z3(以下简称菌株Z3)为河南农业大学环境微生物实验室前期筛选分离得到[12]。
1.1.2 仪器与试剂 MIKRO-22R高速冷冻离心机(德国Hettick公司);TU-1900双光束紫外可见分光光度计(北京普析通用仪器有限责任公司);ESCALAB-250Xi X射线光电子能谱仪(美国赛默飞世尔科技公司);ETHOS UP微波消解仪(意大利Milestone公司); EM-3O扫描电镜(北京天耀科技有限公司);串联飞行时间质谱仪 (美国应用生物系统公司)。试剂购自天津市科密欧化学试剂有限公司,分析纯。
1.1.3 培养基 LB培养基:胰蛋白胨10 g,氯化钠10 g,酵母粉5 g,加水至1 L,pH值为7.2。
1.2 不同价态Cr质量浓度测定
参照火焰原子吸收法测定总Cr质量浓度,二苯碳酰二肼分光光度法测定Cr(Ⅵ)质量浓度[13]。
1.3 菌株Z3还原Cr(Ⅵ)的细胞定位
1.3.1 总Cr在菌株Z3细胞组分中的分布 将菌株Z3在Cr(Ⅵ)质量浓度分别为100、200 mg·L-1的LB培养基中于35 ℃、180 r·min-1条件下培养24 h后,在4 ℃条件下6 000 r·min-1离心10 min得到菌体细胞,参照吕常江等[14]方法进行细胞分离,分别得到胞外多聚物、细胞壁、细胞膜和细胞质,将所得细胞组分置于7 mL HNO3+2 mL H2O2中进行微波消解[15],根据1.2方法测定各组分总Cr质量浓度。
1.3.2 菌株Z3细胞组分对Cr(Ⅵ)的还原 将菌株Z3接种至LB培养基中,36 ℃、180 r·min-1振荡培养24 h后,在4 ℃条件下6 000 r·min-1离心10 min收集菌体,分离细胞各组分。将各组分加入到Cr(Ⅵ)质量浓度为8 mg·L-1、pH值9.2的10 mL Tris-HCl缓冲液中,36 ℃、180 r·min-1振荡培养24 h,根据1.2方法测定Cr(Ⅵ)质量浓度。
1.4 菌株Z3还原前后的扫描电镜分析
将菌株Z3分别接种至Cr(Ⅵ)质量浓度0、50、100、200 mg·L-1的LB培养基中,35 ℃、180 r·min-1振荡培养24 h后,在4 ℃条件下6 000 r·min-1离心10 min,收集菌体,经洗涤、固定、脱水、置换、干燥、喷金后采用SEM观察细胞形态[16]。
1.5 菌株Z3还原过程的能量色散X射线谱分析
将菌株Z3接种至Cr(Ⅵ)质量浓度100 mg·L-1的LB培养基中,36 ℃、180 r·min-1振荡培养24 h。根据菌株Z3对Cr(Ⅵ)的还原特性于10、24 h取样[12],在4 ℃条件下6 000 r·min-1离心10 min收集菌体,无菌水洗涤3次,冷冻干燥后用于EDS分析[17]。
1.6 还原产物的X射线光电子能谱分析
菌株Z3于Cr(Ⅵ)质量浓度为100 mg·L-1,pH值为9的LB培养基中振荡培养24 h,在4 ℃条件下6 000 r·min-1离心10 min,将沉淀真空抽滤,去离子水冲洗3遍,冷冻干燥后进行XPS分析[18]。
1.7 菌株Z3还原Cr(Ⅵ)的相关功能蛋白鉴定
1.7.1 SDS-PAGE全细胞蛋白质电泳及双向电泳 菌株Z3于2组LB培养基中,36 ℃、180 r·min-1振荡培养至8 h,处理组添加Cr(Ⅵ)至质量浓度为100 mg·L-1,对照组不添加Cr(Ⅵ)。处理组和对照组在相同条件下培养至24 h,,在4 ℃条件下6 000 r·min-1离心10 min收集菌体制备全细胞蛋白质溶液后进行电泳及双向电泳[19]。
1.7.2 凝胶扫描分析 对凝胶进行扫描并备份图像,使用PDQuest8.0软件进行分析[20]。选取差异定量值≥1.5倍的蛋白质胶点进行蛋白质鉴定。
1.7.3 蛋白质质谱鉴定及聚类分析 将胶块切碎后进行胶内酶解及Ziptip脱盐。将冻干后的酶解样品点样于样品靶自然干燥,样品靶氮吹后串联飞行时间质谱仪进行测试分析,质谱测试结果使用Mascot 2.2 软件检索相应的数据库,得到蛋白质的鉴定结果, 于SwissProt数据库中查询相应的蛋白功能进行蛋白质聚类分析[21]。
2 结果与分析
2.1 菌株Z3还原Cr(Ⅵ)的细胞定位
2.1.1 总Cr在菌株Z3细胞组分中的分布 通过分析总Cr在菌株Z3细胞组分中的分布情况发现(图1),在100 mg·L-1Cr(Ⅵ)处理组中胞外多聚物、细胞膜、细胞壁、细胞质中总Cr质量浓度分别为8.00、1.49、1.84、3.05 mg·L-1;在200 mg·L-1Cr(Ⅵ)处理组中胞外多聚物、细胞膜、细胞壁、细胞质中总Cr质量浓度分别为16.96、0.75、1.44、2.48 mg·L-1。细胞各组分中总Cr质量浓度从高到低依次为胞外多聚物>细胞质>细胞壁>细胞膜。大多数Cr主要分布在菌体胞外多聚物中,表明菌体分泌的胞外多聚物对Cr具有一定聚集作用,是菌体细胞中Cr的主要分布位置。
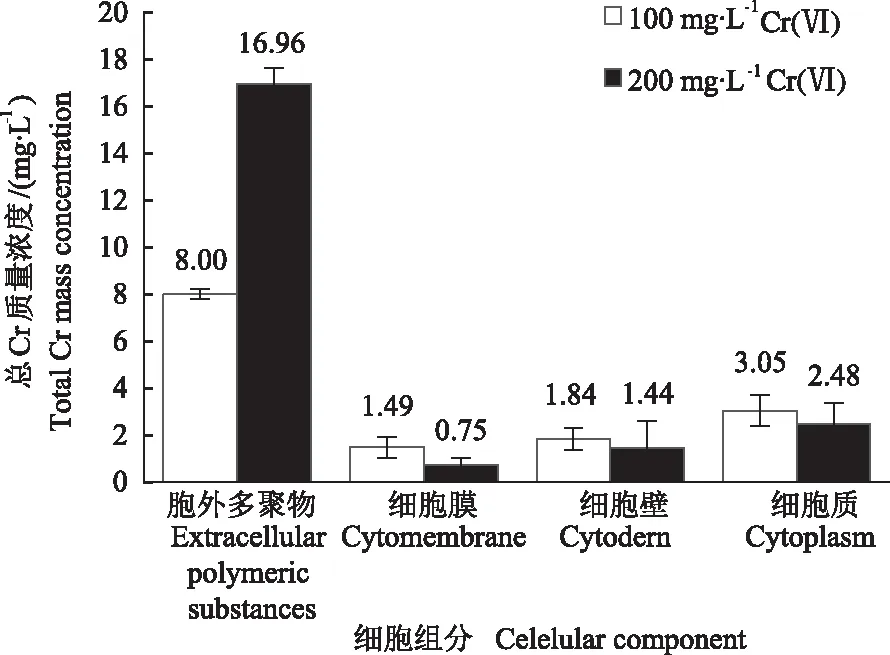
图1 菌株Z3细胞组分中Cr的分布
2.1.2 菌株Z3细胞组分对Cr(Ⅵ)的还原能力 通过分析各细胞组分对Cr(Ⅵ)的还原能力发现(图2),胞外多聚物、细胞膜、细胞壁和细胞质还原率分别为31.5%、4.3%、1.7%和16.2%。细胞组分中Cr(Ⅵ)的还原能力由高到低为胞外多聚物>细胞质>细胞膜>细胞壁。胞外多聚物对Cr(Ⅵ)的还原率最高为31.5%,呈现较好的还原能力。

图2 菌株Z3细胞组分对Cr(Ⅵ)的还原
2.2 菌株Z3还原Cr(Ⅵ)前后的扫描电镜分析
通过电镜观察不同质量浓度Cr(Ⅵ)胁迫条件下菌株Z3形态(图3)。Cr(Ⅵ)质量浓度0 mg·L-1时菌体细胞呈短棒状,大小为4 μm×12 μm,表面光滑平整,个体形态明显。随着Cr(Ⅵ)质量浓度升高至50和100 mg·L-1菌体时,表面开始有少量分泌物生成,并伴随轻微的集聚现象。当Cr(Ⅵ)质量浓度增大至200 mg·L-1时,菌体细胞严重皱缩变小并由短棒状变为椭球状,同时菌体周围生成大量黏稠状的多聚物,集聚现象更加明显。

a: 0 mg·L-1 Cr(Ⅵ);b: 50 mg·L-1 Cr(Ⅵ);c: 100 mg·L-1 Cr(Ⅵ);d: 200 mg·L-1 Cr(Ⅵ)
2.3 菌株Z3还原过程的EDS分析
菌株Z3还原Cr(Ⅵ)过程中10、24 h的菌体细胞EDS结果表明(图4和图5),还原前后的菌体细胞中均检测到C、N、O、P、K、Na、Mg等元素。在还原过程的10 h,菌体细胞中检测到Cr元素存在,而在24 h,菌体细胞中没有检测到Cr元素。由于只有Cr(Ⅵ)能够通过菌体细胞膜,因此在还原过程中进入细胞的为Cr(Ⅵ),菌体中未检出Cr元素,证明菌株Z3对Cr(Ⅵ)的还原过程发生在胞外[22]。
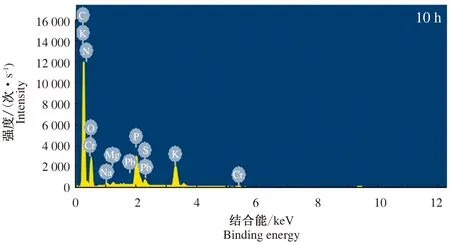
图4 菌株Z3还原Cr(Ⅵ) 10 h的EDS分析

图5 菌株Z3还原Cr(Ⅵ) 24 h的EDS分析
2.4 菌株Z3作用下铬分子形态的变化
采用XPS对菌体还原Cr(Ⅵ)产生的蓝灰色沉淀成分进行分析(图6),结果显示,图谱中主要存在5个峰:C1S、N1S、O1S、Na1S和CR2P,表明沉淀中主要存在C、N、O、Na和Cr元素,H元素则不能被XPS检出。Cr(Ⅲ)和Cr(Ⅵ)的特征峰分别位于577.4和579.5 eV,图谱结果显示,只在577.4 eV处存在CR2P峰,为Cr(Ⅲ)的特征峰,在579.5 eV处未出现峰,表明菌株Z3将Cr(Ⅵ)还原为Cr(Ⅲ)。
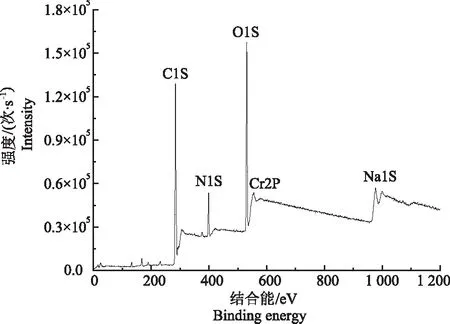
图6 Cr(Ⅵ)还原产物的XPS分析
2.5 菌株Z3的全蛋白质SDS-PAGE电泳分析
通过分析菌株Z3在Cr(Ⅵ)胁迫下的全蛋白SDS-PAGE图谱(图7)发现,菌株Z3在Cr(Ⅵ)胁迫下产生的蛋白与对照组相比有明显的差异,差异蛋白主要集中于右侧箭头指示处,在19、40、58和76 kD附近蛋白表达量明显上调,在28和36 kD附近出现新增条带。该结果表明,Cr(Ⅵ)胁迫下菌体蛋白整体的表达处于上调水平,且Cr(Ⅵ)胁迫能够特异性诱导菌株Z3部分蛋白表达。

1: 对照组; 2: 试验组。 1:Control group; 2: Treated group.
2.6 菌株Z3差异蛋白鉴定及聚类分析
双向电泳凝胶经考马斯亮蓝染色后由PDQuest软件进行分析(图8),共检测到(600±20)个蛋白点,其中,菌株Z3受Cr(Ⅵ)诱导表达上调且表达量增加1.5倍以上的蛋白点为36个。对36个蛋白点进行质谱鉴定,共获得其中23个功能蛋白的信息(表1)。

a:对照组;b:处理组。 a:Control group; b: Treated group.
由蛋白鉴定结果,可将Cr(Ⅵ)诱导表达蛋白按功能可分为以下7大类群:蛋白质合成、能量代谢、氨基酸代谢、胁迫应答、免疫应答、信号传导和脂肪酸代谢。通过聚类分析发现(表1),与胁迫应答相关的蛋白7个,分别为分子伴侣DnaK(点4)、分子伴侣60 kD(点5)、DNA错配修复蛋白MutS(点7)、核型复制蛋白N(点11)、尿嘧啶磷酸核糖基转移酶(点12)、亚硫酸盐还原酶(点13)以及超氧化物歧化酶(点21);蛋白质合成相关蛋白6个,分别为甲硫氨酸-tRNA合成酶(点1)、核糖体循环因子(点2)、GUF1翻译因子(点17)、延伸因子Tu (点18)、转录延伸因子GreA(点20)以及肽脱甲酰基酶(点22);免疫应答相关蛋白4个,分别为细胞骨架相关蛋白5(点6)、双功能蛋白FolD(点9)、肌动蛋白(点16)以及小根蛋白(点23);能量代谢相关蛋白3个,分别为丙酮酸脱氢酶E1β亚基(点3)、2,3,4,5-四氢吡啶-2,6-二羧酸N-乙酰基转移酶(点8)以及苹果酸脱氢酶(点19);氨基酸代谢相关蛋白1个,为丝氨酸羟甲基转移酶(点15);信号传导相关蛋白1个,为兰尼碱受体(点10);脂肪酸代谢相关蛋白1个,为脂烯酰基酰基载体蛋白还原酶(点14)。
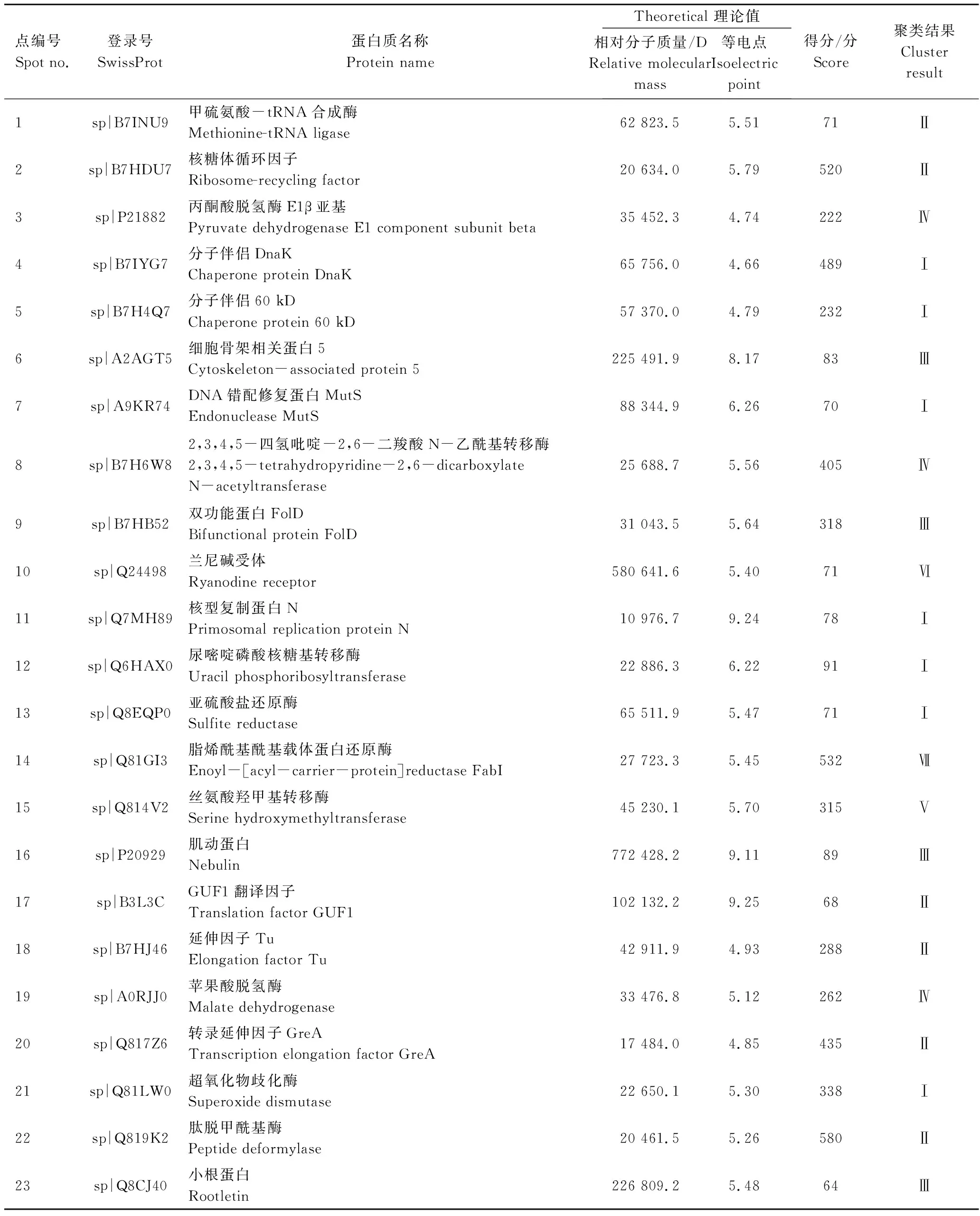
表1 Cr(Ⅵ) 诱导菌株Z3特异表达蛋白的质谱鉴定结果Table 1 Mass spectrometry identification results of Z3 specific expression protein inducted by Cr(Ⅵ)
3 结论与讨论
本试验研究了克雷伯氏菌Z3细胞结构中总Cr分布特征,发现菌株Z3细胞各组分总Cr质量浓度从高到低依次为胞外多聚物>细胞质>细胞壁>细胞膜,在Cr(Ⅵ)质量浓度升高的条件下,总Cr质量浓度在细胞膜、细胞壁及细胞质中呈下降趋势,在胞外多聚物中呈现明显升高的趋势。这表明以细胞形式固定的Cr在胞外多聚物中的分布明显多于细胞其他组分,与KHATTAR等[23]研究结果一致。结合电镜扫描结果,在Cr(Ⅵ)质量浓度提高的条件下,胞外分泌物也显著增加,证明了胞外多聚物为细胞中Cr的主要分布区域,菌体对Cr(Ⅵ)的还原主要在胞外多聚物中进行。
细胞各组分中,胞外多聚物对Cr(Ⅵ)的还原能力最高。Cr(Ⅵ)的还原是在微生物自身Cr还原酶的催化作用下进行的,而这些酶广泛分布于菌体细胞的细胞膜及细胞质中。JOUTEY等[24]研究指出,某些情况下还原酶以细胞外或胞质的可溶性形式存在。本研究中细胞质、细胞膜组分对Cr(Ⅵ)的还原能力均不高,表明对Cr起高效还原作用的酶并非位于细胞膜及细胞质中。细胞各组分中,胞外多聚物对Cr(Ⅵ)的还原率最高,为31.5%,呈现较好的还原能力。以上结果表明,菌株Z3高效还原Cr(Ⅵ)的酶主要为胞外分泌型,位于胞外多聚物中,其对Cr(Ⅵ)的还原作用主要是通过胞外还原的方式进行的。

VITI等[26]研究表明,Cr(Ⅵ)还原菌去除Cr(Ⅵ)的机理主要是将可溶性Cr(Ⅵ)还原为易沉淀Cr(Ⅲ)。本研究还原产物的XPS结果显示,在577.4 eV处只检测到Cr(Ⅲ)的特征峰,可以证明菌株Z3将Cr(Ⅵ)还原成Cr(Ⅲ)。由于Z3对Cr(Ⅵ)的还原是在碱性条件下进行的,Cr(Ⅲ)在碱性环境中主要以Cr(OH)3形式存在,推测还原产生的蓝灰色沉淀主要为Cr(OH)3。
Cr(Ⅵ)胁迫下菌体蛋白表达整体处于上调水平,全蛋白质SDS-PAGE电泳结果显示多处出现新增条带,表明Cr(Ⅵ)的存在能够特异诱导一些蛋白的表达。本研究质谱鉴定结果显示,与免疫应答相关的细胞骨架相关蛋白5以及肌动蛋白表达量增加,推测是菌株Z3在Cr(Ⅵ)胁迫下维持细胞形态正常的应对方式。肌动蛋白在菌体细胞中的含量最丰富,在维持细胞的形态及内部结构的完整性方面发挥重要作用[27]。李彬辉[28]研究表明,菌体产生的亚硫酸盐还原酶能够显著提高Cr(Ⅵ)的去除效果。刘媛等[29]研究表明,超氧化物歧化酶的表达上调与Cr(Ⅵ)胁迫有关,是菌体适应Cr(Ⅵ)环境产生的抗氧化机制。本研究质谱结果显示,与胁迫应答相关的亚硫酸盐还原酶、超氧化物歧化酶表达量上调1.5倍以上,推测是菌体应对Cr(Ⅵ)压力而产生的抗氧化机制,在Cr(Ⅵ)还原的过程中发挥主要作用。

