妊娠期糖尿病中胎盘外泌体对滋养细胞增殖、细胞周期及凋亡的影响*
曾 燕 勾宪飞 陈晓燕 郝从莉
(1 重庆市第七人民医院妇产科,重庆 400069;2 重庆市涪陵区妇幼保健院产科,重庆 408000;3 重庆市中医院妇科,重庆 400021;4 成都中医药大学基础医学院,成都 611137)
近年,妊娠期糖尿病(gestational diabetes mellitus,GDM)的发病率随着肥胖与2 型糖尿病发生率的增加也随之升高[1]。国际糖尿病联合会(International Diabetes Federation,IDF)调查结果显示,我国2013年已超过100 万GDM 患者,并严重危害母婴健康[2]。然而,GDM 的具体病因及发病机制尚不明确。外泌体是在某些特殊生理或病理状态下,母体细胞选择性地将一部分生物信息物质(如蛋白、DNA、mRNA/miRNA/lncRNA、脂类等)包裹进直径为40~120 nm 的脂质双分子层囊泡内的一种物质,故外泌体因其特殊结构能够介导不同细胞间的信息交流及物质交换。既往研究表明外泌体在胎盘发育、子宫螺旋动脉重塑及母体免疫耐受等过程中发挥重要作用[3-5]。有研究表明GDM患者的胎盘外泌体在浓度、成分及生物活性方面均较正常妊娠组不同,这提示胎盘外泌体可能对GDM 的发生发展、诊断和治疗等具有重要意义[6-8]。有数据证实在GDM 患者的胎盘组织中,滋养细胞的数量、增殖能力显著增加,同时细胞周期调控蛋白PCNA、cyclin D3 等表达明显升高,而细胞凋亡却显著降低[9-13],但滋养细胞上述行为改变是否受到胎盘外泌体的影响尚不明确。鉴于此,本研究分离纯化GDM 患者血浆中胎盘外泌体,并在体外培养滋养细胞系HTR-8/SVneo,探讨胎盘外泌体对滋养细胞增殖、细胞周期及凋亡的影响,以期从胎盘外泌体方面阐明GDM 的相关发病机制。
1 材料和方法
1.1 临床标本、细胞系及主要试剂
选取2018年3月至2019年4月期间重庆市第七人民医院50 例诊断为GDM 孕产妇患者(GDM组),GDM 诊断参考2013年世界卫生组织GDM 诊断标准[1]。另选同期50 例口服葡萄糖耐量试验(oral glucose tolerance test,OGTT)阴性的孕产妇作为正常对照组。纳入标准:(1)单胎妊娠;(2)排除患有其他妊娠期合并症,如心脑血管、肺、肝、肾、甲状腺等疾病及孕前即诊断为糖尿病或有糖尿病家族史;(3)均经阴道分娩。所有受试者均在分娩当日晨起时抽取空腹静脉血5 mL,置于含有抗凝剂的紫色管中,静置30 min 后,室温下5 460 r/min离心5 min,取血浆置于试管中,30 min 内进行检测或储存于-80℃冰箱中,用于提取胎盘外泌体。本研究经过本院伦理委员会审批,患者及家属均签署知情同意书。
人绒毛膜滋养细胞系HTR-8/SVneo(HTR8)购自北京维通利华生物公司;DMEM/F12、0.25%胰蛋白酶(美国Hyclon 公司);胎牛血清(FBS)、青链霉素混合液(杭州四季青生物公司);RIPA 裂解液、BCA 蛋白定量试剂盒(美国Invitrogen 公司);TRIzol、逆转录试剂盒、外泌体RNA/蛋白提取试剂盒(美国Thermo 公司);兔抗胎盘碱性磷酸酶(PLAP)、CD63、TSG101、GAPDH 单克隆抗体(美国Santa Cruz 公司);辣根过氧化物酶(HRP)标记的山羊抗兔IgG 二抗(北京中杉金桥生物有限公司);PKH67 绿色荧光膜连接染料、DAPI 、MTT试剂盒(美国Sigma 公司);Annexin V-FITC/PI 细胞凋亡试剂盒(美国BD 公司)。
1.2 胎盘外泌体的提取及鉴定
取1 mL 血浆,参考相关文献[7,14]利用超速离心与蔗糖密度梯度分离法相结合提取孕产妇外周血的外泌体后,使用二喹啉甲酸(BCA)法进行定量,-80℃保存备用。取20 μL PBS 稀释2 μL 外泌体,3.5%的多聚甲醛固定后滴加到铜网上,2%的铀酸盐染色,晾干后应用透射电镜(TEM)观察外泌体形态;用950 μL PBS 稀释50 μL 的外泌体,0.22 μm 滤膜过滤外泌体稀释液后使用Nanosight 纳米粒径跟踪分析(nanoparticle-tracking analysis,NTA)进行外泌体粒直径检测。
1.3 滋养细胞HTR8 细胞系培养及细胞分组
常规复苏HTR8细胞后,使用含10 % FBS、1 %青链霉素的DMEM/HG 培养基于37 ℃、5 % CO2恒温培养箱进行培养。待细胞生长融合至80%~90%时,用0.25 %胰酶进行消化传代。取处于对数生长期的HTR8 细胞,调整细胞后以4×104个/孔接种于24 孔板中,并将细胞分为5 组:NP-10 μg Exo 组为含10 μg 正常妊娠组外泌体(NP-Exo)处理的HTR8 细胞;NP-20 μg Exo 组为含20 μg 正常妊娠组外泌体(NP-Exo)处理的HTR8 细胞;GDM-10 μg Exo 组为含10 μg 妊娠期糖尿病组外泌体(GDM-Exo)处理的HTR8 细胞;GDM-20 μg Exo 组为含20 μg 妊娠期糖尿病组外泌体(GDMExo)处理的HTR8 细胞;设含200 μL PBS 处理的HTR8 细胞为对照组。
1.4 PKH67/DAPI 双染标记及追踪外泌体
收集分离纯化的外泌体,根据PKH67 试剂说明书进行标记外泌体,同时根据DAPI 染料说明书将HTR8 细胞进行染核,再将PKH67 标记的外泌体加入到经DAPI 染核的HTR8 细胞中,于37℃、5%CO2恒温培养箱培养24 h,PBS 洗涤2~3 次后,荧光共聚焦显微镜进行观察。实验单独重复3 次。
1.5 MTT 检测细胞增殖能力
取各组对数生长期的HTR8 细胞,常规消化后按2×104个/孔接种于96 孔板中,分别于0、12、24、36、48 h 向每孔加入5 mg/mL 的MTT 试剂20 μL,培养箱中继续培养4 h,弃除原培养液后,每孔加入150 μL 的二甲基亚砜(DMSO)溶液,室温下震荡10 min 使形成的紫色甲瓒结晶充分溶解。酶标仪于490 nm 检测每孔吸光度值(OD490),每个时间点每组设置5 个复孔,取平均值,绘制细胞的生长曲线。
1.6 流式细胞术检测细胞周期
取各组对数生长期的HTR8 细胞,调整细胞密度后以1×105个/孔接种于24 孔板中,于37℃、5%CO2恒温培养箱培养48 h。培养终止后,4℃预冷的PBS 轻轻洗涤细胞后,并进行常规消化,1 500 r/min 离心5 min,弃上清,收集细胞,加入500 μL的PBS 重悬细胞,并迅速加入3.5 mL -20℃预冷的70%乙醇,将细胞吹打均匀后,于4℃固定过夜。PBS 洗涤细胞3 次,2 000 r/min 离心5 min 以充分去除固定液,按照细胞周期流式细胞术检测试剂盒说明方法进行操作,加入500 μL PI/RNase 染色液,4℃条件下避光孵育30 min,上流式细胞仪检测各组细胞周期。实验单独重复3 次
1.7 Annexin V-FITC/PI 双染色结合流式细胞术检测细胞凋亡
取各组对数生长期的HTR8 细胞,调整细胞密度后以1×105个/孔接种于24 孔板中,于37℃、5% CO2恒温培养箱中培养48 h 后,1 500 r/min 离心5 min,弃上清,4℃预冷的PBS 洗涤细胞2 次,1 500 r/min 离心5 min,收集细胞沉淀,用195 μL Annexin V-FITC 结合液重悬细胞,调整细胞至7×105/mL,依次加入5 μL 的Annexin V-FITC 及10 μL 的碘化丙啶(PI)染色液,轻轻摇晃离心管以充分混匀后,室温下避光孵育30 min。300 目滤膜过滤细胞团块后,上流式细胞仪检测。实验单独重复3 次。
1.8 免疫印迹检测胎盘外泌体标志蛋白的表达
应用外泌体RNA/蛋白提取试剂盒提取胎盘外泌体中的总蛋白。BCA 法进行蛋白定量,按照1∶4 向上清液中加入5×上样缓冲液,并于沸水中加热变性10 min。取30 μg 的蛋白进行聚丙烯酰胺凝胶(SDS-PAGE)电泳分离蛋白,采用湿转法将分离的蛋白转至PVDF 膜上,5%的脱脂牛奶于室温下封闭2 h 后,分别加入CD63(1∶500)、PLAP(1∶800)、TSG101(1∶500)、GAPDH(1∶1 000)一抗,4 ℃摇床孵育过夜。TBST 溶液清洗3 次,每次5 min,以辣根酶标记的二抗(1∶5 000)室温孵育1 h,以 TBST 溶液清洗3 次,每次5 min。最后均匀滴加ECL 发光液后于凝胶成像仪进行曝光拍照。Image J 软件测定条带灰度值,以目标蛋白与内参GAPDH 的比值作为其相对含量。以上实验单独重复3 次。
1.9 统计学处理
采用 SPSS 19.0 软件进行统计学分析。计量资料采用±s表示。多组间比较采用单因素方差分析(one-way ANOVA),两组间比较采用独立样本t检验。P<0.05 为差异有统计学意义。
2 结果
2.1 孕产妇的一般临床资料比较
与对照组相比,GDM 组的产前BMI、胎盘质量及新生儿体质量均显著增加,差异均具有统计学意义(P<0.05),而平均年龄、分娩周数、新生儿性别差异均无统计学意义(P>0.05)(表1)。
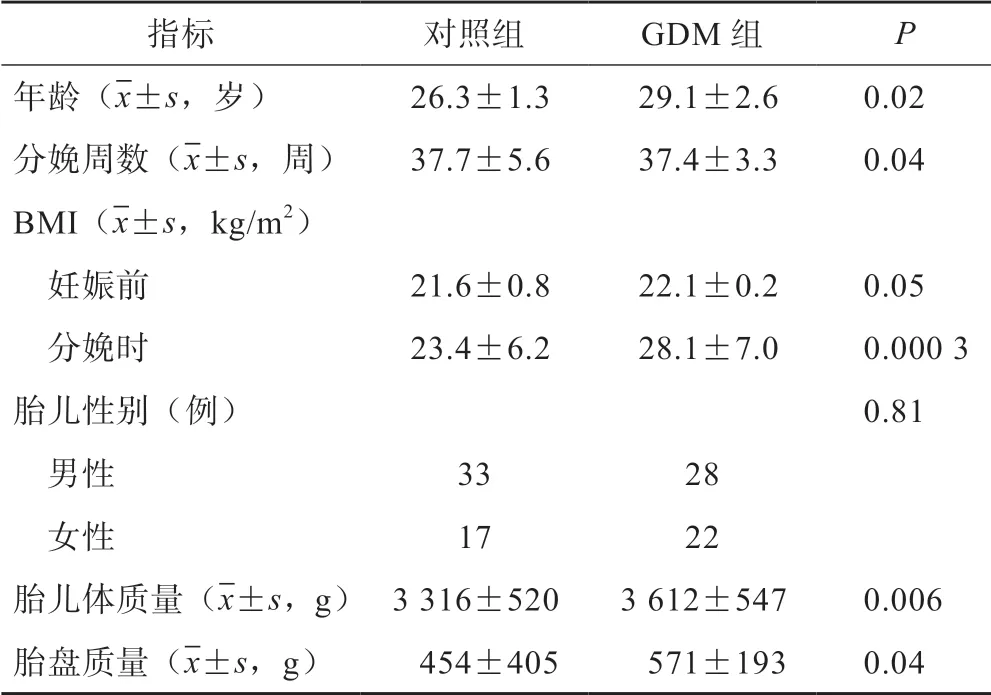
表1 两组孕产妇一般临床资料比较
2.2 胎盘外泌体的鉴定
TEM 观察显示,胎盘外泌体呈典型的杯状或双凹状形态,直径为40~120 nm(图1A,见封二);NTA 检测结果显示,分离纯化的外泌体直径多集中于(84±5)nm(86%±3%)之间,这与TEM观察的微粒大小相近(图1B,见封二)。免疫印迹检测结果显示,胎盘外泌体标志性蛋白CD63、TSG101、PLAP 表达均呈阳性(图1C,见封二)。

图1 胎盘外泌体的鉴定。A:透射电镜观察母体血清中胎盘外泌体呈典型的杯状或双凹状形态,标尺=100 nm,右上角插图的标尺=10 nm;B:NTA 检测分离纯化的胎盘外泌体的粒径大小及密度分布;C:免疫印迹检测胎盘外泌体标志性蛋白CD63、TSG101、PLAP 的表达.
2.3 胎盘外泌体的摄取
PKH67(绿色荧光)标记的胎盘外泌体与DAPI 染核(蓝色荧光)的HTR8 细胞共培养24 h 后,激光共聚焦显微镜观察可见,PKH67 标记的外泌体能够进入HTR8 细胞中,即胎盘外泌体能够被滋养细胞HTR8 细胞所摄取(图2,见封二)。

图2 滋养细胞HTR8 细胞摄取胎盘外泌体,标尺=20 μm,白色箭头指示外泌体.
2.4 胎盘外泌体对滋养细胞增殖的影响
MTT 检测结果显示,NP-Exo 对HTR8 细胞增殖能力无明显变化,而GDM-Exo 能够显著促进HTR8 细胞增殖能力,且GDM-Exo 的浓度越高,HTR8 细胞的增殖能力越强。与对照组相比,GDM-10 μg Exo 组及GDM-20 μg Exo 组滋养细胞在GDM-Exo 处理24 h 后,细胞的增殖活性显著增强,差异均有统计学意义(P<0.05),NP-10 μg Exo 组、NP-20 μg Exo 组滋养细胞的增殖活性无明显变化(P>0.05);与NP-10 μg Exo 组或NP-20 μg Exo 组相比,GDM-10 μg Exo 组与GDM-20 μg Exo组的滋养细胞增殖能力显著增强(P<0.05)(图3,见封二)。

图3 GDM胎盘外泌体促进滋养细胞的增殖能力。*P<0.05 vs 对照组;#P<0.05 vs Np-10 μg Exo 组或Np-20 μg Exo 组.
2.5 胎盘外泌体对滋养细胞的细胞周期影响
流式细胞周期检测结果显示,NP-Exo对HTR8细胞的细胞周期无明显影响,而GDM-Exo能明显促进HTR8细胞的细胞周期进展,即处于G1期的细胞比例显著减少,S期细胞明显增加,且GDMExo 的浓度越高对HTR8细胞的细胞周期进展的促进作用越强。与对照组相比,GDM-10 μg Exo组及GDM-20 μg Exo组的滋养细胞处于G1期的细胞比例显著降低,S期的细胞比例显著增加,差异均有统计学意义(P<0.05),NP-10 μg Exo组、NP-20 μg Exo组无明显变化(P>0.05);与NP-10 μg Exo组或NP-20 μg Exo组相比,GDM-10 μg Exo组及GDM-20 μg Exo组的滋养细胞周期进展显著增加(P<0.05)(图4,见封二)。

图4 GDM胎盘外泌体促进滋养细胞的细胞周期进展。A:对照组;B:NP-10 μg Exo 组;C:NP-20 μg Exo 组;D:GDM-10 μg Exo 组;E:GDM-20 μg Exo 组;F:不同细胞周期的细胞比例。*P<0.05 vs 对照组;#P<0.05 vs NP-10 μg Exo 组或Np-20 μg Exo 组.
2.6 胎盘外泌体对滋养细胞凋亡的影响
Annexin V-FITC/PI凋亡实验结果显示,NPExo对HTR8细胞凋亡率无明显影响,而GDM-Exo明显抑制HTR8细胞的凋亡,且GDM-Exo 的浓度越高对HTR8细胞的凋亡抑制率越强。与对照组相比,GDM-10 μg Exo组及GDM-20 μg Exo组滋养细胞在GDM-Exo处理24 h后,细胞的凋亡率明显降低,差异均有统计学意义(P<0.05),NP-10 μg Exo组、NP-20 μg Exo组滋养细胞无明显变化(P>0.05);与NP-10 μg Exo组或NP-20 μg Exo组相比,GDM-10 μg Exo组及GDM-20 μg Exo组的滋养细胞凋亡率均显著降低(P<0.05)(图5,见封二)。

图5 GDM胎盘外泌体抑制滋养细胞发生凋亡。A:对照组;B:NP-10 μg Exo 组;C:NP-20 μg Exo 组;D:GDM-10 μg Exo 组;E:GDM-20 μg Exo 组;F:各组HTR8细胞的凋亡率. *P<0.05 vs 对照组;#P<0.05 vs NP-10 μg Exo 组或NP-20 μg Exo 组.
3 讨论
GDM 是指在妊娠后首次发现或发生糖代谢异常的疾病,其一般发生在妊娠的中晚期,是一种常见的妊娠合并症。根据流行病学研究显示,GDM在我国的发病率增加了2.8 倍(1999年为2.4%,2008年为6.8%)[15],而2017年国内GDM 多中心研究显示其发病率已高达12.2%[16]。GDM 严重影响母婴健康,大量研究数据显示,GDM 不仅增加胎儿并发症,如巨大儿、新生儿低血糖、高胆红素血症等的发生率,还增加孕妇慢性高血压、心血管疾病以及2 型糖尿病的发病率[17]。外泌体自1983年被Harding 等[18]发现以来,其作为细胞间重要信号转导的重要载体已被人们广泛重视。外泌体直径为30~150 nm,内含丰富蛋白质、脂质、RNA 等生物活性物质,其主要标志物为CD63、TSG101、CD81 等[6]。胎盘组织作为高度特异化器官,其来源的外泌体不仅表达上述外泌体标志性蛋白,同时还表达PLAP,后者是鉴定外泌体来源于胎盘组织的重要标志分子之一。
既往研究表明,胎盘外泌体对维持正常的妊娠及胚胎的发育起着关键作用,如在妊娠相关的免疫耐受中显示,胎盘外泌体能够通过表达具有生物活性的死亡信使Fas配体与TRAIL,从而触发细胞凋亡来介导母胎间免疫耐受[19];Miranda等[20]报道胎盘外泌体在母体血浆中的表达量反映了胚胎的生长情况。同时,与正常发育的胎儿相比,胎儿宫内生长受限的胎盘外泌体分泌显著减少。在子痫前期的研究中证实,子痫前期患者胎盘外泌体能够通过高表达miR-155抑制血管内皮细胞释放具有舒张血管作用的内皮型一氧化氮合酶,从而导致血管收缩,最终诱发子痫前期的产生[21]。研究显示,与正常妊娠女性相比,GDM患者在孕早、中、晚期胎盘外泌体的浓度分别为1.6倍、1.5倍及1.3倍[6],提示胎盘外泌体可能参与调节GDM的发生和发展。
滋养细胞是胎盘组织的主要成分,其正常功能对胎盘的形成和妊娠的维持具有重要作用[22]。既往在对GDM 相关研究中表明,GDM 患者胎盘中滋养细胞的增殖活力显著增加,而细胞凋亡减少,细胞周期相关蛋白表达增加,导致胎盘组织生长较大,进而引起胎儿过度发育,新生儿体质量增加[12,23]。本研究结果显示,与正常妊娠的胎盘外泌体相比,GDM 外泌体能够显著促进滋养细胞的增殖、细胞周期进展,并抑制其发生凋亡,且外泌体浓度越高,其对上述滋养细胞的作用越大。提示妊娠期糖尿病中胎盘外泌体可能通过促进滋养细胞的增殖、细胞周期进展,抑制其发生凋亡等作用参与妊娠期糖尿病发生和发展,为外泌体在妊娠期糖尿病中的应用奠定了基础。