前列腺素EP4受体激动剂HY-128686对实验性缺血性脑梗死的神经保护作用*
罗彩琴 荆 忻 沈 佳 马晓薇 朱金源
(宁夏医科大学总医院重症监护室,银川 750004)
脑梗死是常见致死疾病之一,其中87%为缺血性脑梗死[1-2]。缺血性脑梗死由大脑主要动脉闭塞导致,从动脉支配的中心区细胞坏死持续到周围半影区[3]。活性氧(reactive oxygen species,ROS)异常生成会激活金属基质蛋白酶(matrix metalloproteinases,MMP)[4-5]。MMP-9 通 过 破坏血脑屏障(blood brain barrier,BBB)的完整性,引起免疫细胞的炎症反应和渗透,加速组织损伤[6-8]。研究表明MMP 在炎症介导的神经血管损伤中至关重要,而敲除或抑制MMP-9 表达可以显著降低脑缺血后的神经血管损伤[9-10]。前列腺素E2(prostaglandin E2,PGE2)是4 个G 蛋白偶联受体EP1-EP4 的内源性配体,具有旁分泌或自分泌效应,对炎症信号至关重要[11]。缺血性脑梗死后,磷脂酶从膜上释放大量花生四烯酸,然后进一步代谢为包括PGE2 的几种前列腺素进而导致血脑屏障通透性改变和周围免疫细胞渗透[12-14]。HY-128686 是有效的、选择性、可口服的前列腺素E2 受体亚型4(EP4)激动剂。它对EP4 的选择性比其他类前列腺素受体高4 000 倍[15]。有研究显示EP4 激活能够通过cAMP 及Wnt 等信号通路促进CD34+细胞的抗凋亡和增殖作用以减少炎症及促进血管生成等作用[16]。本研究旨在通过检测在短暂性局灶性脑缺血的临床相关动物模型中使用EP4 受体激动剂HY-128686,观察对脑组织IgG、MMP-9、IL-1β 以及IL-6 表达变化,研究HY-128686 对脑梗死神经保护作用。
1 材料和方法
1.1 动物
成年雄性大鼠60 只,6~8 周龄,280~320 g,购自温州医科大学动物实验中心,饲养于温州医科大学动物实验中心,在12 h 光照/黑暗周期下自由饮食饮水,温度保持在18 ℃~26 ℃,湿度40%~70%,每笼2 只大鼠。所有动物程序均遵守大学实验动物护理和使用指南,实验方案经过大学动物护理使用委员会以及伦理委员会批准。
1.2 线栓法短暂性局灶性脑缺血大鼠模型
使用短暂性局灶性缺血的线栓法模型对大鼠进行90 min 的短暂性脑中动脉闭塞(MCAO)。医用级氧气中添加2%~2.5%的异戊烷深度麻醉大鼠,手术过程中使用恒温加热台(Global Industries,美国)维持37℃。颈中线切口后从迷走神经中分离出颈总动脉(CCA),并用4-0 丝线缝合结扎(Holliston,美国)。临时用微血管夹夹住颈外动脉和翼腭动脉,在结扎上方CCA 上进行动脉切开术,通过颈内动脉向上插入4-0 硅酮包覆线(Doccol Corporation,美国)进入大脑中动脉直到检测到轻微阻力。暂时关闭切口,让大鼠在恒温加热室(Paso Robles,美国)中恢复约80 min 后进行后续操作。
1.3 药物处理
HY-128686 购自美国Cayman Chemical 公司,线栓法短暂性局灶性脑缺血大鼠模型建立后,使大鼠在恒温加热室(Paso Robles,美国)中恢复约80 min,动物随机分组,每组10 只:使用不同剂量的HY-128686(0~1.2 mg/kg,溶于5 mL 生理盐水中),尾静脉注射处理大鼠;对照组大鼠静脉注射等体积生理盐水,每日注射1 次,持续处理21 d,处理结束后颈椎脱臼处死大鼠。
1.4 组织收集和裂解均质
使用戊巴比妥(150 mg /kg;i.p)(碧云天试剂公司,中国)深度麻醉后颈椎脱臼法处死大鼠,放入4℃的生理盐水。使用脑模具(Zivic Instruments,美国)提取大鼠大脑,并切割为2 mm 切片。第4 切片对应前囟,为该模型脑梗死核心区域,将其切成同侧和对侧皮层以及同侧和对侧下皮层后在干冰上冷冻用于ELISA 、RT-PCR 和免疫印迹检测。剩余的切片用于计算梗死面积。
将组织称重并用组织裂解器在放射免疫沉淀缓冲液中匀浆,每mg组织中添加10 µL 1%十二烷基硫酸钠(SDS)、1%脱氧胆酸钠(碧云天试剂公司,中国);150 mmol/L NaCl,50 mmol/L Tris-HCl(pH=7.6)和1%的IGEPAL RCA-630(百奥莱博试剂公司,中国);裂解后每毫升裂解混合物添加10µL HALT 蛋白酶抑制剂混合物、HALT 磷酸酶抑制剂混合物和0.5 mol/L EDTA(Thermo Fisher,美国)。用Vibra-CellTM超声仪(Sonics&Materials,美国)处理样品2 次,每次15 s,冰上孵育15 min后,4℃,14 000 r/min,离心20 min。吸取上清液于EP 管,-80℃下保存至使用。
1.5 梗死面积及体积检测
将脑片1~3 和5~6 在2%的2,3,5-三苯基四唑氯化物磷酸盐缓冲溶液(PBS,海派医药公司,中国)中室温孵育30 min,然后置于4%多聚甲醛中染色,活组织染为红色,死亡组织为白色。用HP Scanjet 8300(帕洛阿尔托公司,美国)扫描各切片,分辨率为600 dpi,除第3 片外均沿延髓侧向下扫描切片。第3 切片沿尾侧向下扫描,代表第4 切片延髓侧。
使用Adobe Photoshop CS5(EG 公司,英国)将每个切片划分红色组织,脑梗死表面积(mm2)=对侧红色组织-同侧红色组织;总梗死体积=死组织总表面积(mm2)×切片厚度(2 mm)。
1.6 ELISA 试剂盒测定IgG 活性
按照制造商的说明,使用免疫球蛋白G(IgG)ELISA 试剂盒(圣克鲁斯生物技术公司,美国):每个反应孔中加0.05 mL 抗体结合蛋白A/G(圣克鲁斯生物技术公司,美国)包被96 孔板,4℃孵育过夜。每孔添加50 uL 切片匀浆液,37℃ 孵育0.5 h。弃液后洗涤3 次,每孔中加入相应酶标抗体100 μL,37℃ 孵育0.5 h 后洗涤,加入100 μL 四甲基联苯胺(TMB,圣克鲁斯生物技术公司,美国),室温孵育30 min,加入50 μL 终止溶液。使用酶标仪(艾森博奥公司,美国)测量450 nm 处吸光度。
1.7 免疫印迹检测MMP-9 和紧密结合蛋白
使用5%β-巯基乙醇稀释40 μg 总蛋白(1∶1 000),加热变性10 min 后检测紧密结合蛋白闭合蛋白;使用2%的β-巯基乙醇稀释40 μg 总蛋白(1∶500)后检测紧密结合蛋白-1(zonula occludens-1,ZO-1);使用5%β-巯基乙醇稀释50 μg 总蛋白(1∶5 000),加热变性10 min 后检测MMP-9。
蛋白变性后上样,0.1%SDS Tris-甘氨酸缓冲液中电泳通过Mini-PROTEAN TGX 凝胶电泳(15%,CST,美国),200 V,45 min;在10%甲醇的Tris-甘氨酸缓冲液中平衡10 min,25 V 下转移到PVDF 膜上(Billerica,美国)。室温下在含5%脱脂牛奶的TBS 中封闭1 h,然后在含5%脱脂牛奶的TBST 中与一抗4℃孵育过夜。用TBST 洗涤PVDF 膜4 次,在含0.01%SDS,5%脱脂牛奶的TBST 中(格鲁斯特,中国)与山羊抗兔IRDye 800 CW(1∶3 000,西格玛奥德里奇公司,美国)室温孵育1 h。TBST 洗涤去除多余抗体,与β-肌动蛋白一抗(1∶1 000,西格玛奥德里奇公司,美国)室温孵育2 h。TBST 洗涤4 次,在含0.01%SDS、5%脱脂牛奶的TBST 中与驴抗大鼠IRDye 680LT(1∶40 000,LiCor 公司,美国)室温孵育1 h,然后用奥德赛红外扫描系统(LiCor 公司,美国)进行扫描。以肌动蛋白信号为内参进行蛋白表达的标准化。
1.8 qRT-PCR
将第4 个切片(该模型脑梗死核心区域)对应组织切成同侧和对侧半球,并进一步分为纹状体和皮层部分,放入RNA 稳定试剂(10 µL/mg 组织,Qigen,德国)。根据制造商的说明,采用TRIzol 法提取组织和细胞总RNA,紫外分光光度法检测RNA 浓度和纯度。用iScriptTMReverse Transcription Supermix(Integrated DNA Technologies,美国)将1 µg RNA 反转录为cDNA,并用IDTE 缓冲液(pH=8.0,Integrated DNA Technologies,美国)稀释至10 ng/µL。分别使用20 ng 同侧和对侧半球纹状体和皮层组织部分cDNA 进行qPCR,用IL-1β、IL-6、MMP-9 靶向探针(500 nmol/L,Integrated DNA Technologies,美国)进行探测。依据qPCR 说明书进行检测,反应条件为:95℃预变性30 s;95℃变性5 s;60℃45 s;70℃ 45 s,共40 个循环。qPCR 引物见表1。相应 mRNA 表达量检测以参考基因(Ywhaz)进行归一化处理。Ct 值以2-ΔΔCt方法进行计算,代表相应mRNA 的相对表达量。

表1 qRT-PCR 实验引物序列
1.9 神经系统缺陷评估
在诱导MCAO 前以及药物注射后2、7、14、21 d,对大鼠进行24 h 和48 h 的任务训练,并在48 h 时进行测试。训练大鼠去除前侧以及对侧爪上的小贴纸,记录去除小贴纸的潜伏期,试验重复3 次后取平均值进行分析,以此评估大鼠长期感觉。训练大鼠使其停留在自动旋转脚架上(4 r/min 加速到40 r/min),记录大鼠跌倒潜伏期,试验重复5 次后取平均值作为每只动物的基线值,以此评估精细运动控制缺陷。
1.10 统计学处理
使用GraphPad Prism 6.0版统计学软件,分类变量以计数和百分比形式表示,进行χ2检验或Fisher精确检验进行分析;定量资料用±s表示,组间比较选用t检验。P<0.05时差异具有统计学意义。
2 结果
2.1 梗死面积
与对照组相比,再灌注24 h 后,使用(0.2~1.2 mg/kg)HY-128686 治疗后皮质和皮质下部分(P<0.05,图1A、B)总梗死面积及体积(P<0.05,图1C)显著减少,提示1.0 mg/kg 的HY-128686 具有最好的疗效,因此选择此剂量处理的大鼠组织进行后续实验。
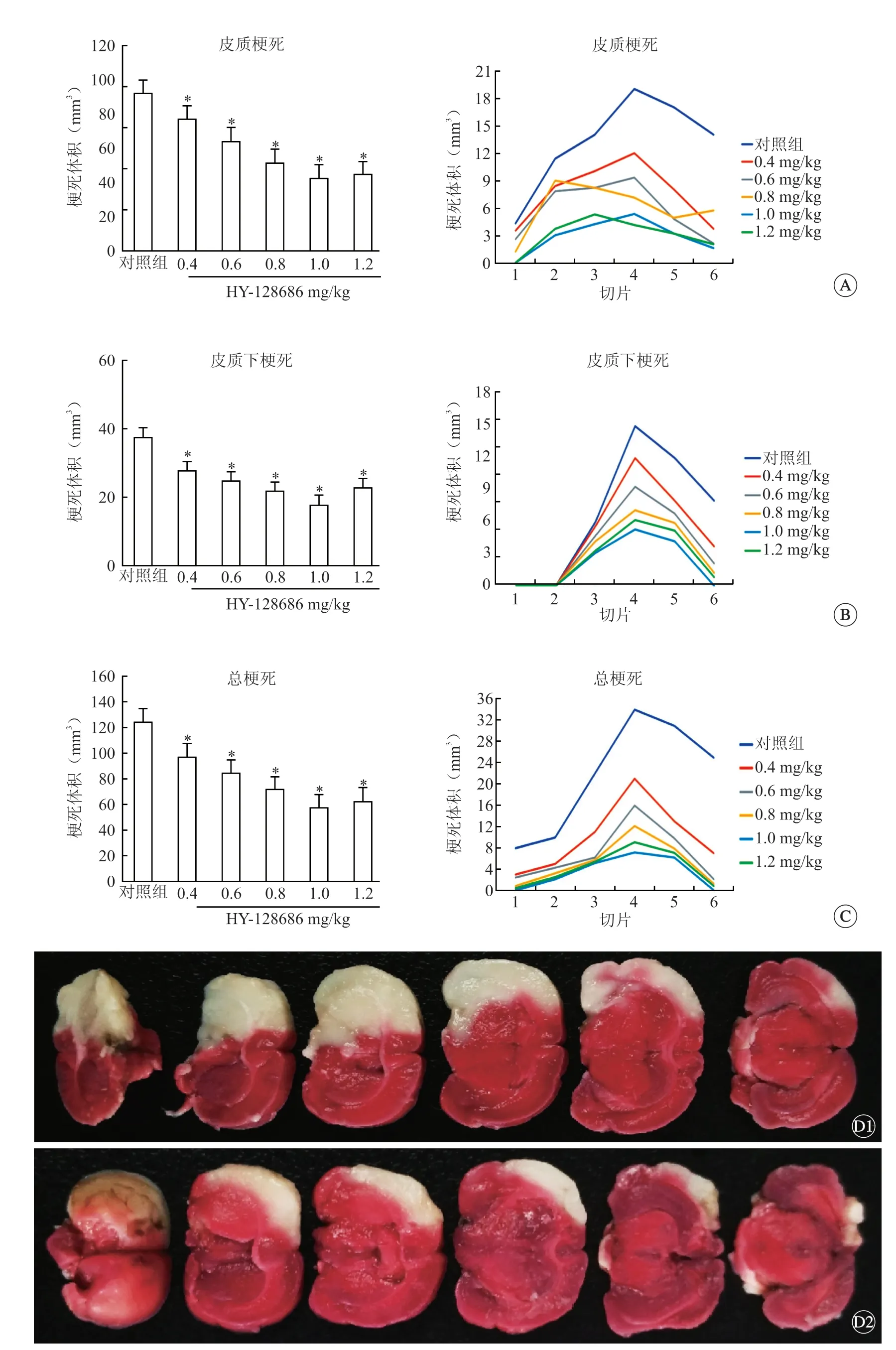
图1 使用EP4 质激动剂 HY-128686 治疗后梗死面积
2.2 IgG 水平
每组大鼠的第4 张切片(2 mm 厚)的脑组织用于IgG 的ELISA 分析。与对照组相比,使用1.0 mg/kg HY-128686 治疗后,皮质下和皮质中IgG 含量显著降低(P<0.05,图2)。
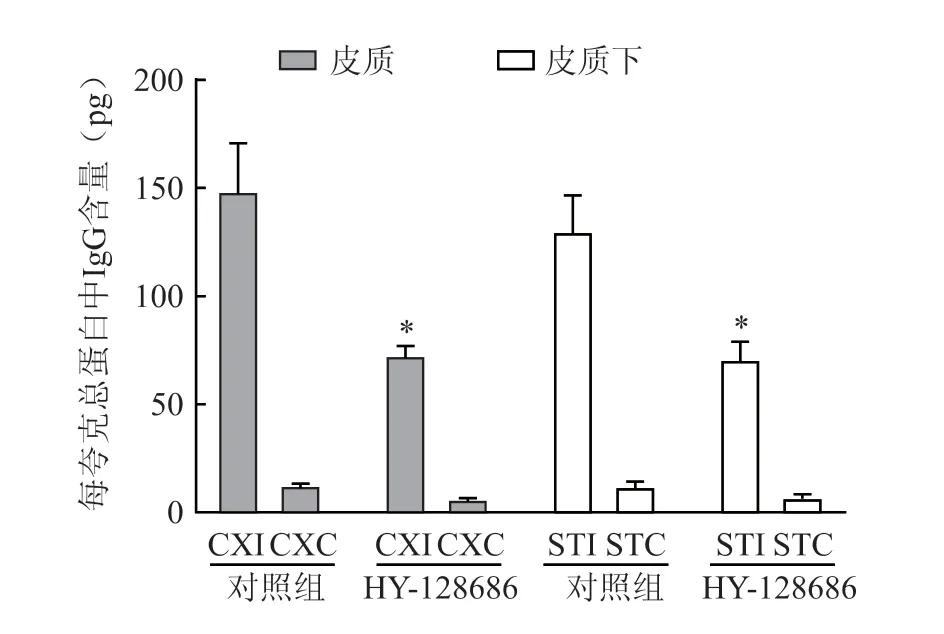
图2 用EP4 激动剂HY-128686 治疗脑梗死大鼠模型后大脑中IgG 含量
2.3 MMP-9、IL6、IL-1β 以及ZO-1 表达变化
免疫印迹检测表明,与对照组相比,使用1.0 mg/kg HY-128686 治疗后皮质中MMP-9 水平显著降低(P<0.05,图3),皮质下同样明显降低(P>0.05,图3);qRT-PCR 分析显示,与对照组相比,使用1.0 mg/kg HY-128686 治疗后皮质和皮质下IL-1β和IL-6 mRNA 显著降低(P<0.05,图4)。与对照组相比,使用 HY-128686 处理的大鼠同侧皮质中ZO-1 表达升高(图5)。
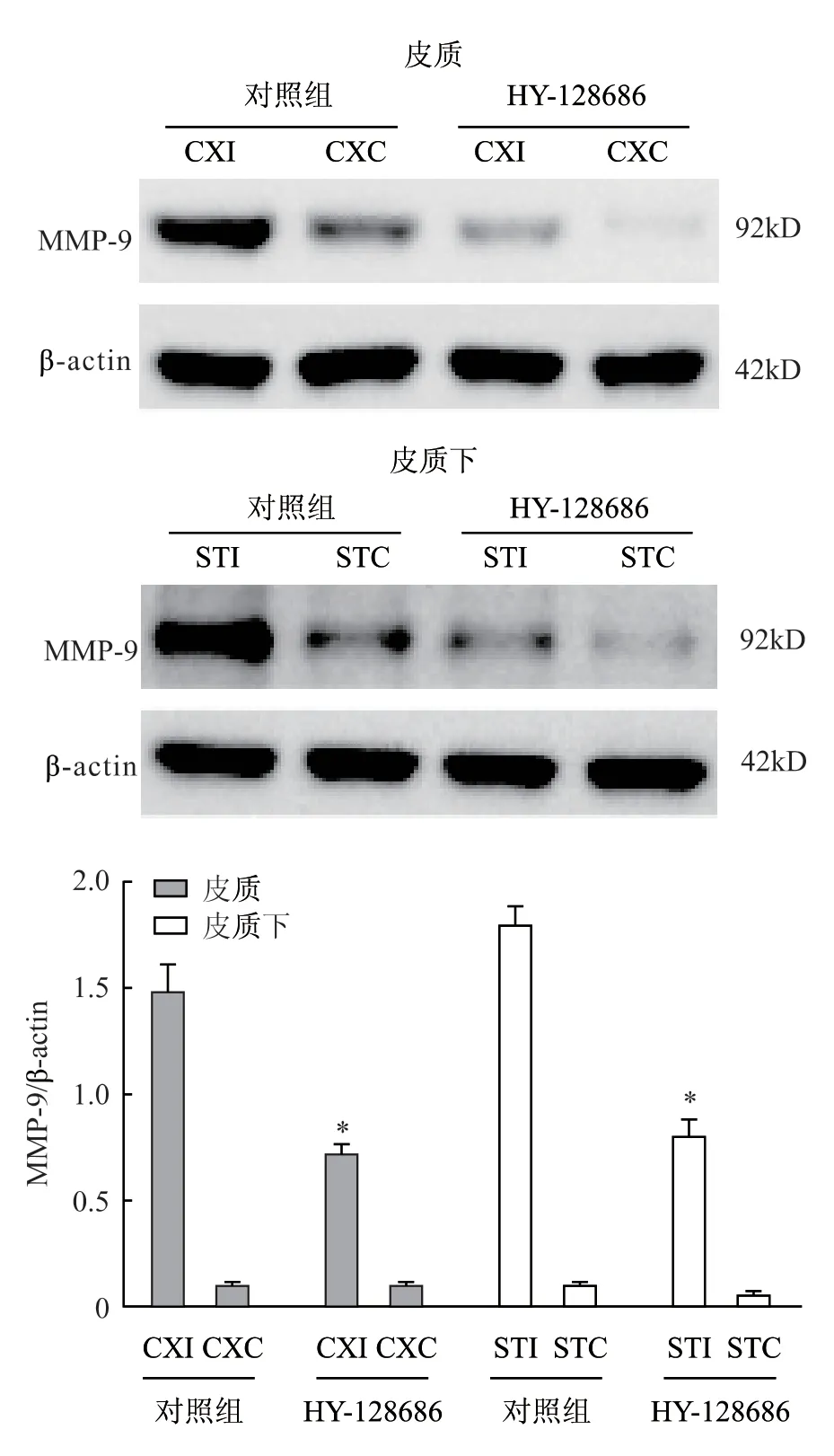
图3 EP4 激动剂 HY-128686 治疗后脑梗死大鼠模型中MMP-9 含量
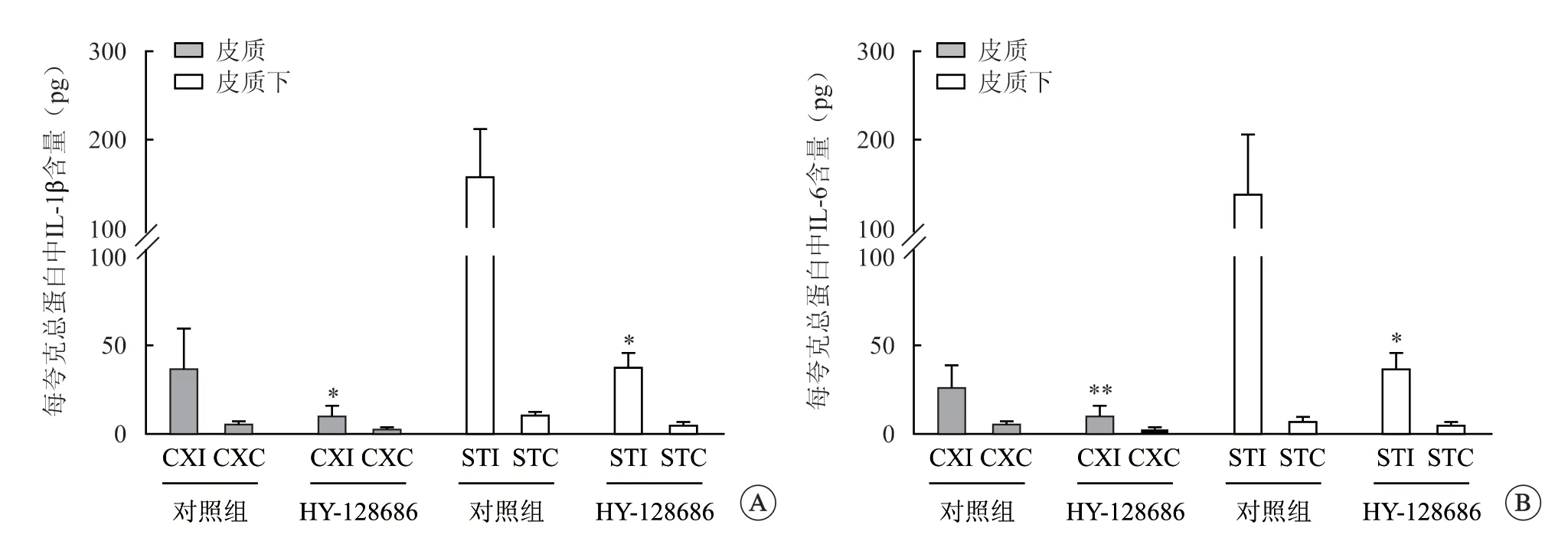
图4 HY-128686 处理后IL-1β、IL-6 mRNA 的表达
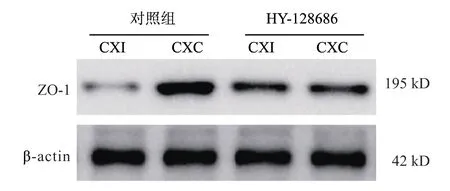
图5 HY-128686 对ZO-1 蛋白的影响
2.4 对受损神经功能的长期保护
再灌注开始时,与对照组相比,静脉注射1.0 mg/kg HY-128686的大鼠在梗死后1、2和3周的贴纸去除实验中表现更好(P<0.05,P<0.01,图6A),并且也停留在旋转脚手架上的时间更长(P<0.05,图6B),表明 HY-128686促进神经功能恢复。
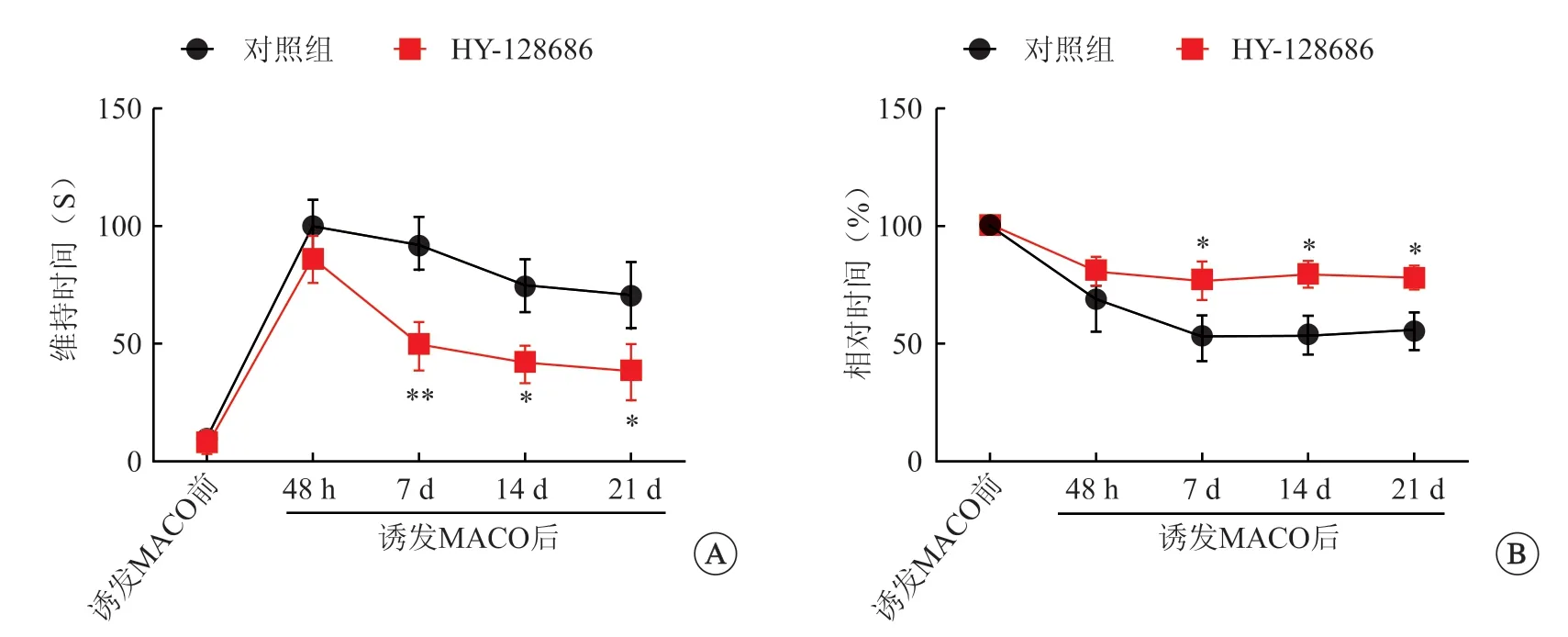
图6 HY-128686 治疗脑梗死引起的神经系统损伤评估
3 讨论
目前研究显示MMPs 在组织修复、血管生成、细胞迁移以及组织形态形成中扮演着重要角色,其中MMP-9 是 MMPs 家族一员,具有广泛的底物特异性,可有效降解Ⅱ、Ⅳ和Ⅸ型胶原蛋白,导致斑块破裂形成血栓,同时以蛋白水解方式分解内皮细胞和基底膜细胞之间神经血管单元屏障功能所必需的紧密连接蛋白,改变血脑屏障(BBB)的通透性,使得脑实质中出现包括IgG 蛋白,影响缺血性脑梗死的发病过程[17]。
血管神经单元(neurovascular unit,NVU)包括神经元和由其参与构成的血脑屏障,发挥维持渗透性平衡的作用,使脉管系统进行物质交换[18]。血脑屏障由脑毛细血管内皮细胞、胶质细胞足突和基底膜组成,通过其特殊结构能阻挡病原生物和其他大分子物质由血循环进入脑实质,减少脑组织受到血液循环中有害物质的损害,从而维持脑组织内环境稳态平衡,发挥中枢神经系统保护功能。细胞质附着蛋白ZO-1、跨膜蛋白闭合蛋白和细胞骨架蛋白共同组成紧密连接,是血脑屏障的结构基础,在维持血脑屏障结构发挥中枢神经稳态的重要作用[19-20]。本研究结果显示与对照组相比,使用HY-128686 处理的大鼠同侧皮层中ZO-1 表达升高,这说明HY-128686 能够有效改善脑组织渗透性及发挥治疗血脑屏障的作用。
脑梗死发生后神经血管细胞与外周免疫系统之间的细胞和分子之间的相互作用改变血脑屏障的通透性,引发炎症反应以及免疫细胞浸润,同时ROS 直接破坏组成BBB 的内皮细胞,并间接激活MMP,从而导致基底层蛋白和紧密连结蛋白水解降解,损害神经血管单元[21]。而本研究结果显示,与对照组相比,使用1.0 mg/kg HY-128686 治疗后皮层中MMP-9 水平显著降低,皮质下也明显降低;而qRT-PCR 分析显示,使用1.0 mg/kg HY-128686治疗后皮质和皮质下IL-1β 和IL-6 mRNA 显著降低,表明HY-128686 治疗后能够有效改善脑梗死引起的免疫反应,减轻炎症造成的脑损伤。
前列腺素类物质包括前列腺素和血栓烷素,是20 碳不饱和脂肪酸的环氧产物。EP 分为4 种亚型,分别为 EP1、EP2、EP3 和 EP4[22-23]。EP4 受体广泛表达于内皮细胞、神经元、星形胶质细胞、小胶质细胞和外周免疫细胞等多种细胞类型,为7 次跨膜激活型G 蛋白(Gs)-蛋白偶联受体,激活后促进细胞内cAMP 水平升高进而激活蛋白激酶A(PKA),磷酸iNOS 水平,从而增加局部NO 浓度诱导血管舒张从而改变脑血流量[24]。EP4 受体激动后能够抑制核因子-κB(NF-κB)的激活减少其靶基因IL-1β 转录[25]。另一项研究表明,在大鼠蛛网膜下腔出血模型中EP4 受体激动剂AE1-329 可显著改善脑水肿以及减少炎症因子IL-1β、IL-6 和TNF-α 的表达,从而保护脑损伤的发生[26-27]。同样地这一现象在本研究中得到证实,本研究结果证明了HY-128686 能够通过激活EP4 受体从而减少炎症因子IL-1β 基因转录和MMP-3 和MMP-9 表达,同时抑制缺血性脑梗死诱导的炎性细胞因子IL-1β 和IL-6 的表达,从而抑制神经元凋亡,发挥神经保护作用。通过以上结果验证了HY-128686 对脑梗死的治疗作用,为未来的脑梗死治疗提供了新的基础数据。