认知模型助力“宏观辨识与微观探析”素养落地
张金伟 吴飞


摘 要:以人教版第四章“物质结构 元素周期律”复习教学为例,以人体必需的微量元素硒(Se)为情境,运用建立的“构—位—性”宏微模型,解决预测陌生元素物质性质的问题,并重点发展学生“宏观辨识与微观探析”化学学科核心素养。
关键词:中学化学;宏观辨识与微观探析;认知模型;元素周期律;物质结构
中图分类号:G633.8 文献标识码:A 文章编号:1009-010X(2021)20/23-0107-05
“宏观辨识与微观探析”位于五大化学学科核心素养的第一个维度,体现了化学学科最具特征的认识视角与思维视角。“宏观辨识与微观探析”素养的培养,其核心在于学生通过相关的化学学习活动,有意识地利用宏微结合的视角看待物质世界的变化,然后发现问题、分析问题并创造性地解决问题,如此有助于学生化学学科观念和思维方式的形成。
一、“宏觀辨识与微观探析”的内涵以及思维意识
“宏观辨识与微观探析”的内涵:(1)能从不同层次认识物质的多样性,并对物质进行分类;(2)能从元素和原子、分子水平认识物质的组成、结构、性质和变化,并形成“结构决定性质,性质决定用途”的观念;(3)能从宏观和微观相结合的视角分析与解决实际问题,并形成对物质组成、结构、性质、变化、应用及其关系的本质认识。
“宏观辨识与微观探析”的思维意识是指学生能够自发地利用双向思维来分析解决相关化学问题,包括:(1)学生能从宏观层面辨识物质的形态及其变化现象,并能自发地从微观角度解释其本质的心理倾向;(2)学生能从微观层面探析物质的组成、结构,并能在此基础上进一步推断、预测物质的宏观性质的心理倾向,两者相互关联,形成了一个自发的思维回路。
二、“模型认知”是培养学生“宏观辨识与微观探析”核心素养的有力途径
化学学科研究的对象是分子、原子,属于微观层面,无法通过直观感受感知。在自然科学的研究中,当客观对象不能被直接研究时,人们一般通过应用科学方法,建立一个适当的模型来反映和代替该客观对象,并通过研究这个模型来揭示客观对象的形态、特征和本质,这就是模型法。认知模型可使具有微观性和抽象性的研究实体或者过程“可视化”,也可使抽象的知识系统化、结构化,以提高学生的学习效率,进而可培养学生的化学学科核心素养。
通过文献检索笔者发现,有关本章新授课教学设计的研究有很多,其中一些也比较新颖,但有关本章复习课教学设计的研究却寥寥可数,现与本章复习教学设计相关的教学设计思路有以下几类:(1)采用研究性学习的方式,即由学生自己提出问题,从微观上解释碱金属、卤族元素性质递变的原因,如此可充分调动学生的积极性。(2)IMMEX—C系统在“元素周期律”复习课中的探究应用,该系统可诊断学生在学习中的问题,并促进学生理解和应用相关知识。(3)通过进阶式教学任务对“位—构—性”模型和物质性质的认知模型进行建构。(4)从“问题先导”“图像整合”“知识应用”三方面进行阐述,重视具体的实践和价值体验,该法具有较高的创新性。
本文以人体必需的微量元素硒(Se)为情境,对“构—位—性”认知模型进行再认识、再深化,意在运用模型解决问题、揭示本质。
三、教材分析
(一)构建知识框架
“物质结构 元素周期律”该章内容,概念较多,比较抽象,理论性也较强。本章的知识框架可以图1来表示。
教材以原子结构为基础原点向外发散出两条明线:第一条明线从微观粒子的结构视角出发,意在使学生深刻理解元素间的内在联系,建立原子结构与元素性质的关系;认识元素的性质及其递变规律,进而进阶式地建构起对元素周期律的认识,强化“结构决定性质”的观念。第二条明线从微观粒子相互作用的视角出发,在原子结构的基础上,探究物质的构成,认识物质的分类及其变化,如此可深化学生对物质及其变化的理解。
从宏观角度自然转入到微观角度,如此可有效建立微粒观、结构观,进而可揭示出化学反应的实质,并进一步使学生感悟基础理论对生产生活实践的指导意义。同时这也为学生后续学习化学反应原理、有机化学等基础知识打下了坚实的基础。
(二)建立认知模型
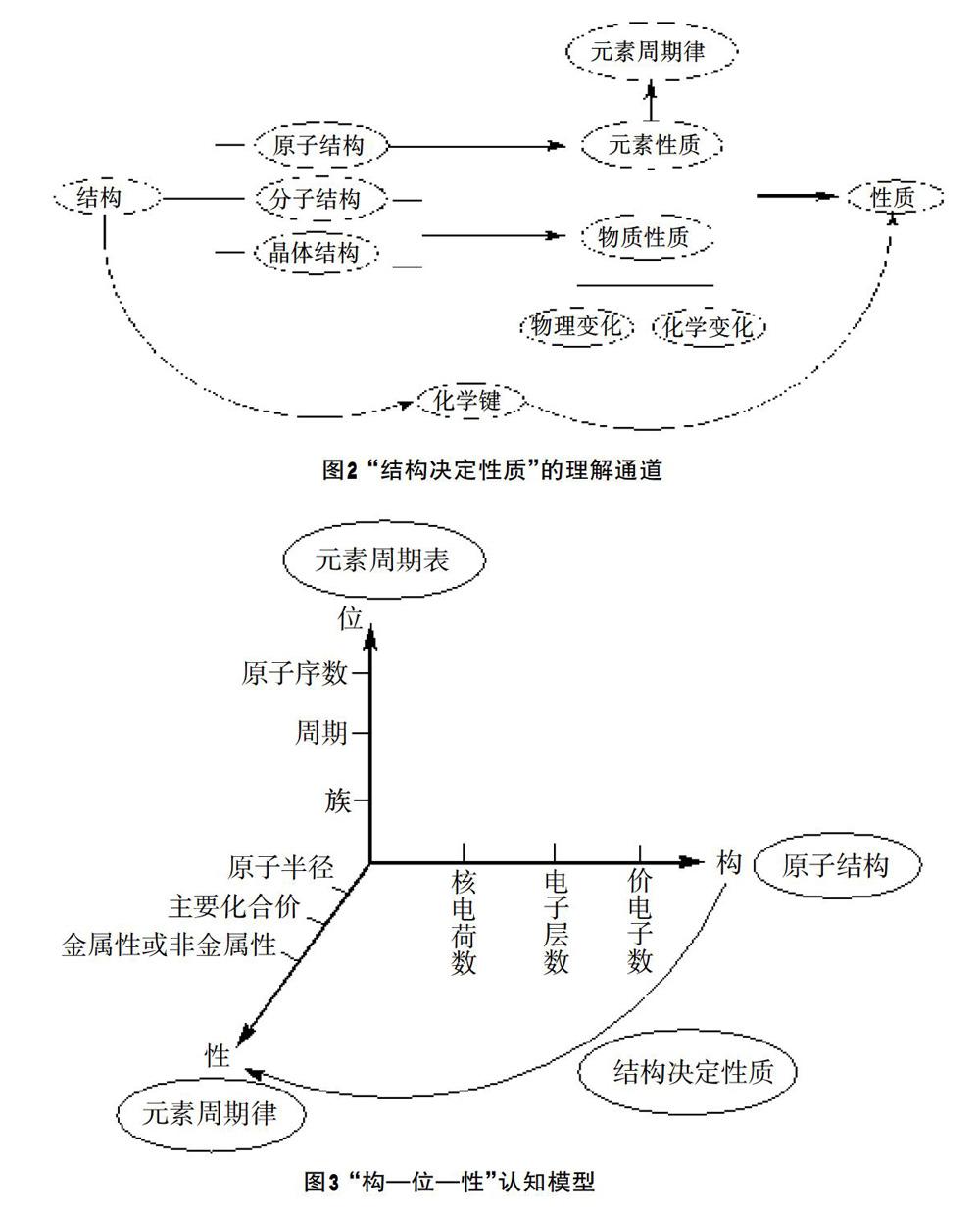
1.建立一个理解通道——结构决定性质。微观层面:元素的原子结构决定了元素的基本性质,例如化合价(得电子显示负电性,失电子显示正电性)、金属性或非金属性等,把这些性质归纳起来便是元素周期律;宏观层面:在日常生活中我们观察到的宏观物质具有不同的聚集状态、不同的物理性质和不同的化学性质……这些宏观性质是由于物质具有不同的结构造成的。对此,教师可引领学生从化学键、分子间的作用力等微观角度对其进行探究。但无论是从哪个层面进行研究,都应该让学生明白原子、分子是有结构的,是化学键使这些具有结构的原子、分子以一定的形式聚集在一起形成物质,并表现出它该有的宏观性质,即我们常说的:结构决定性质(如图2所示)。
2.构建认知模型——“构—位—性”认知模型和化学键认知模型。“宏观辨识与微观探析”是高中化学学科核心素养之一,其要求学生从元素和原子、分子的水平认识物质的组成结构、性质和变化。本节课构建了“构—位—性”宏微结合模型(构:微观结构,通常包括原子结构、分子结构等;位:周期表中的位置;性:元素的主要性质),并利用该模型预测未知元素的性质,如此可使元素周期律的内容结构化,促进并发展学生的系统化思维,进而可实现从化学学科知识向化学学科核心素养的转化。“构—位—性”认知模型如图3所示。
四、教学片段
教学环节1:创设情境,交流探讨——建构“构—位—性”模型
【教师】在浙江新安江、龙游、诸葛三角地带的土壤中含有丰富的硒元素。2000多年前姑蔑国就有富硒(Se)莲子酒,富硒莲子酒除了清爽的口感外,还能够提高机体免疫力,预防肿瘤、肝病等的发生。
【设问】Se的原子序数为34,请画出Se原子的结构示意图,并分析Se原子得失电子的能力、金属性和非金属性如何?
【学生】根据核外电子的排布规律,得到Se
原子的结构示意图为: ,最外层为6个电
子,因此易得到2个电子,达到8电子的稳定结构。所以Se元素表现出一定的非金属性。
【设问】请你指出Se在周期表中的位置?
【学生】第四周期ⅥA 族。
【设问】第三周期的S元素与Se为同一主族元素,从微观结构出发,比较Se与S元素得电子能力以及非金属性的强弱。
【学生】在最外层电子数相同的情况下,通过比较电子层数来分析元素原子得失电子的能力,Se的电子层较多,半径较大,对外层电子的束缚能力减弱,所以得电子能力减弱。因此,Se的非金属性比S弱。
【教师】研究其他周期的主族元素,也会得到类似的结论。即同一主族元素,从上到下,核电荷数依次增多,原子半径逐渐增大,失电子能力逐渐增强,得电子能力逐渐减弱,非金属逐渐减弱,金屬性逐渐增强。我们只要建立“构—位—性”模型,便能有效解决诸如此类的问题。
【设问】Se是典型的半导体,Te是位于Se下一周期的同主族元素,它也能导电,有一些金属的特性,那么其是否还有与O元素一样的氧化性呢?请从原子结构的角度进行分析。
【学生】Te、Se两者相比,Te元素的原子半径增大,金属性增强。Se是半导体,而Te已表现出一定的金属性,还具有氧化性,只是氧化性比O元素弱。
【设问】你是怎么分析推理的?
【学生】元素所在周期表的位置反映了它的结构,而结构决定了它的性质。
【设计意图】环节1以硒与人体健康的情境脉络为背景,通过问题驱动,引导学生由结构、位置去预测和解释物质的性质,并依据宏观事实去探究事物的微观本质,由此可内化“构—位—性”三者之间的逻辑关系,进而可建立“构—位—性”的宏微模型。本环节设计的目的是诊断和发展学生从宏观事实去探析微观本质的素养以及探究性、推理性思维。
教学环节2:问题驱动,分析推理——运用模型分析预测陌生物质的性质
【教师】硒在自然界中以有机硒和无机硒的形式存在,无机硒主要有硒酸钠盐和亚硒酸钠盐。
【设问】你能根据Na2SO4、Na2SO3写出硒酸
钠、亚硒酸钠的化学式吗?
【学生】硒酸钠、亚硒酸钠的化学式分别为:Na2SeO4、Na2SeO3。
【设问】分别判断Na2SeO4、Na2SeO3中Se元素的价态,并预测这两种盐可能具有的化学性质。
【学生】Na2SeO4中Se元素为+6价,为最高
价态,具有氧化性,Na2SeO3中Se元素为+4价,为中间价态,具有氧化性和还原性。
【教师】Na2SeO4中的Se元素为+6价,具有氧化性,可被某些还原剂还原,可作杀虫剂和氧化剂。Na2SeO3中的Se元素为+4价,具有还原性,可用于治疗缺Se导致的克山病,采取口服亚硒酸钠的方式对其有预防效果。除此之外,亚硒酸钠还是禽畜补硒的重要产品之一,可作为饲料添加剂使用。
【设问】将SO2通入NaOH溶液中可制得
Na2SO3,仿照此法,选用合适的试剂制取Na2SeO3,并试写出反应的化学方程式。
【学生】S和Se为同主族元素,具有相似性,SO2和SeO2也具有相似性,所以可以用SeO2与NaOH溶液反应得到Na2SeO3,其反应方程式为: SeO2+2NaOH═Na2SeO3+H2O
【设问】那么Se元素还有其他的价态吗?能形成什么样的物质呢?
【学生】还有-2价的Se,可以形成H2Se、
Na2Se等类型的物质,还有单质Se。
【教师】你能根据H2S的化学性质预测H2Se的化学性质吗?
【学生】H2Se水溶液具有酸性、还原性,H2Se的热稳定性比H2S差。
【教师】硒酸H2SeO4为无色晶体,熔点为
330K,熔融时为浓的油状液体,热硒酸与浓盐酸的混合液像王水一样,可以溶解金、铂。
【设问】请预测硒酸H2SeO4其他可能具有
的性质?硒酸的钡盐溶解性如何呢?
【学生】具有酸性、强氧化性。硒酸钡与硫酸钡一样不溶于水。
【教师】SeO2为Se的一种常见氧化物,化学性质与SO2相似,预测SeO2的性质并试着完成Cl2与SeO2溶液反应的化学方程式。
【学生】SeO2溶于水生成H2SeO3,可以和碱、某些盐反应,能发生氧化还原反应。
Cl2+SeO2+2H2O═H2SeO4+2HCl
【设计意图】环节2仍以硒与人体健康的情境脉络为背景,通过层层设疑,激发学生根据位置和结构去推测物质的性质,如此可进一步促进学生巩固和理解相关模型。本环节的设计和开展有助于诊断学生对模型的理解程度,进而可进一步深化学生“宏观辨识和微观探析”“证据推理和模型认知”化学学科核心素养。
教学环节3:素材引导,迁移拓展——熟练运用模型预测另一陌生元素的性质
【素材】锶(Sr)也是人体必需的微量元素,它是人体骨骼和牙齿的组成成分,锶能促进骨骼发育生长,维持人体正常的生理功能,它在人体内的代谢与钙极为相似。
【教师】用途往往是由性质决定的,锶元素的性质为什么会与钙元素相似呢?(已知锶是第38号主族元素)
【学生】锶和钙最外层都是2个电子,位于同一主族(ⅡA),因此化学性质具有相似性。
【素材】但是长期以来学者认为,过量的锶会干扰钙的吸收与代谢,锶可以代替骨骼中的钙,而且比钙更容易游离所以会导致一些疾病。
【教师】锶元素和钙元素的这些差异主要是什么原因导致的?
【学生】锶元素在元素周期表中位于钙元素的下方,金属性比钙强。
【设计意图】以不同主族的元素为例,对
“构—位—性”模型的应用再深化,如此可让学生深刻认识元素周期律的强大生命力,体会“结构决定性质”的深刻内涵。
五、板书设计
六、总结
构建认知模型是复习课有效的教学手段,其可激发学生的思维,促进知识外化于形,内化于心,为解决同类复习教学也提供了参考。在教学过程中,囿于时间限制,部分知识的归纳总结可放在课前完成,例如绘制元素主要化合价的递变规律图等。笔者认为这部分知识相对理性,采用数形结合的方法比较符合学生的认知特点。在学习元素周期律之前,学生对元素及其化合物这部分知识的感觉是抽象且零散的,本节课通过建模使该部分知识系统化且能被学生灵活迁移运用,如此可让知识由微观到宏观,由抽象到形象。通过有效设疑,可促进学生在原有知识的基础上更深入本质,找到知识内部的逻辑关系,这是建模的关键。

