阿尔茨海默病肠道菌群相对丰度与认知功能的关系
王旭,马素亚,周梦玲,李晨萌,魏明清,倪敬年,李婷,田金洲,时晶
(北京中医药大学东直门医院脑病三科,北京 100700)
阿尔茨海默病(Alzheimer′s disease,AD)是一种复杂、进行性、不可逆转的神经退行性疾病[1],表现为以记忆力减退为主的多领域认知功能损害[2]。全世界超过5 000万人患有AD[3],占所有痴呆病例的60%~80%[4]。AD的发病机制复杂,相关假说包括β淀粉样蛋白(amyloid β-protein,Aβ)假说、Tau蛋白假说、神经免疫假说、氧化应激假说等[5-6]。近年研究表明,许多神经退行性疾病的发病机制可能与肠道菌群有关。胃肠道的共生菌群可通过肠-脑轴调节神经炎症以及中枢神经系统自身免疫[7],有研究者在AD大脑中观察到抗炎细菌菌群的减少和促炎细菌菌群的增多[8]。同时,肠道菌群还可能通过触发代谢性疾病引起痴呆,研究表明,糖尿病和肥胖等代谢性疾病会增加AD的发生风险,而肠道菌群的代谢改变可引起机体的代谢异常[9]。因此,进一步了解肠道微生物的多样性,分析其与AD发生的关联性,对有关AD的临床危险因素和发病机制的研究具有推动作用,可为寻找有效干预手段提供一定参考[10]。本研究旨在探讨AD患者肠道菌群相对丰度与认知功能的相关性。
1 资料与方法
1.1一般资料 选取2018年5月至2019年5月北京中医药大学东直门医院脑病三科门诊、病房及社区招募的61例受试者作为研究对象,年龄52~91岁;根据诊断标准分为正常对照(normal control,NC)组(21例)、遗忘型轻度认知损害(amnestic mild cognitive impairment,aMCI)组(20例)、AD组(20例)。
1.1.1纳入标准 NC组采用美国梅奥诊所认知正常诊断标准[11]:①无记忆减退或其他认知损害主诉,或有不稳定的轻微记忆减退;②无记忆损害客观证据;③无活跃的神经或精神疾病及其他可能影响认知功能的疾病;④未使用精神药物;⑤简易精神状态检查表(mini-mental state examination,MMSE)得分大学>26分、中学>24分、小学>23分、文盲>22分[12];⑥临床痴呆评定量表(clinical dementia rating,CDR)评分为0分[13]。
aMCI组采用欧洲阿尔茨海默病协会的轻度认知损害诊断标准[14]:①受试者或其照料者有认知功能下降主诉;②客观的记忆障碍,延迟故事回忆(delayed story recall,DSR)量表评分<12.5分;③总体认知功能正常,MMSE得分大学>26分、中学>24分、小学>23分、文盲>22分[12];④临床评估证实存在认知障碍;⑤CDR评分为0.5分,记忆领域评分为0.5分;⑥日常生活能力正常或仅有轻微损害;⑦无痴呆,不符合美国国立神经病学语言障碍卒中研究所和AD及相关疾病协会的AD标准[15];⑧Hachinski缺血量表评分≤4分[16];⑨汉密尔顿抑郁量表评分<12分[17];⑩没有内侧颞叶萎缩(包括海马体积萎缩)。
AD组采用国家衰老研究所-美国阿尔茨海默病学会[2]很可能的AD痴呆核心临床标准:①起病隐匿,认知功能逐渐恶化达数月或数年;②情景记忆和至少一个其他认知领域的显著损害;③MMSE得分大学≤26分、中学≤24分、小学≤23、文盲≤22分[12];④日常生活能力受损[日常生活能力量表(activities of daily living scale,ADL)评分≥16分][18];⑤Hachinski缺血量表评分≤4分;⑥内侧颞叶萎缩;⑦有足够的听力和视力配合临床研究,有一定的文化程度,既往能够阅读简单的文章和书写简单的句子。
1.1.2排除标准 ①其他神经变性疾病,包括帕金森病、血管性痴呆、亨廷顿病、正常压力脑积水、脑肿瘤、进行性核上性麻痹、癫痫、慢性硬膜下血肿及多发性硬化;②有严重头脑外伤史伴有持续神经功能缺损或已知的脑结构异常;③严重的脑血管疾病及肝脏、肾脏、肺部、代谢性或内分泌系统疾病(如甲状腺功能异常);④抑郁状态(汉密尔顿抑郁量表评分≥12分),或其他精神障碍;⑤有显著的维生素B12或叶酸缺乏;⑥有癫痫病史或严重的药物或乙醇滥用病史;⑦1个月内服用过抗生素;⑧1个内服用过胃肠动力药、泻药或其他影响胃肠动力的药物;⑨1个内服用过益生菌等影响肠道菌群的药物;⑩有严重的神经功能缺损以至于不能完成相关检查,如便利手偏瘫、各种失语、视听障碍等。
1.2方法 采用MMSE评估受试者总体认知功能,CDR评定认知损害的程度,ADL评估日常生活能力,DSR评估情景记忆。
对所有受试者进行培训,指导其按照同样的步骤使用一次性便盒采集粪便样品约10 g,迅速置于4 ℃冰箱内冷藏,并于24 h内将样品置于-80 ℃冰箱保存。采用TIANamp粪便提取试剂盒(购自北京天根生化科技有限公司)提取粪便中菌群的DNA,用于16S核糖体RNA高通量测序。对获得的DNA进行文库质检合格后,用16S特定引物对特异可变区V4区域进行扩增。使用Illuminam MiSeq平台进行细菌16S核糖体RNA高通量测序。得到有效序列数据后,使用Mothur v1.34.4在97%相似水平下对所有序列进行操作分类单元(operational taxonomic units,OTU)归类。根据OTU归类结果对细菌物种间的亲缘关系和物种间的差异进行分析,获得细菌分类和细菌相对丰度。
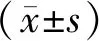
2 结 果
2.13组一般资料比较 3组受试者的性别、年龄、受教育年限、体质指数比较差异均无统计学意义(P>0.05),见表1。

表1 3组受试者的一般资料比较
2.23组认知功能比较 3组受试者的MMSE、DSR、ADL、CDR评分比较差异有统计学意义(P<0.01),AD组的MMSE、DSR评分均低于NC组和aMCI组,ADL、CDR评分均高于NC组和aMCI组(P<0.05);aMCI组的DSR评分低于NC组(P<0.01),CDR评分高于NC组(P<0.01),aMCI组与NC组的MMSE、ADL评分比较差异无统计学意义(P>0.05)。见表2。
2.33组差异肠道菌群相对丰度比较 3组受试者的拟杆菌门、拟杆菌纲、拟杆菌目相对丰度比较差异无统计学意义(P>0.05)。3组受试者的厚壁菌门、β变形菌纲、梭菌纲、伯克菌目、梭菌目、产碱杆菌科、梭菌科、萨特菌属相对丰度比较差异有统计学意义(P<0.05)。AD组的β变形菌纲、伯克菌目、产碱杆菌科、萨特菌属相对丰度均高于NC组(P<0.05),厚壁菌门、梭菌纲、梭菌目、梭菌科相对丰度低于NC组(P<0.05);aMCI组的产碱杆菌科、萨特菌属相对丰度高于NC组(P<0.05),厚壁菌门、梭菌纲、梭菌目相对丰度低于NC组(P<0.05),aMCI组与NC组的β变形菌纲、伯克菌目、梭菌科相对丰度比较差异无统计学意义(P>0.05)。AD组与aMCI组的差异肠道菌群相对丰度比较差异均无统计学意义(P>0.05)。见表3。
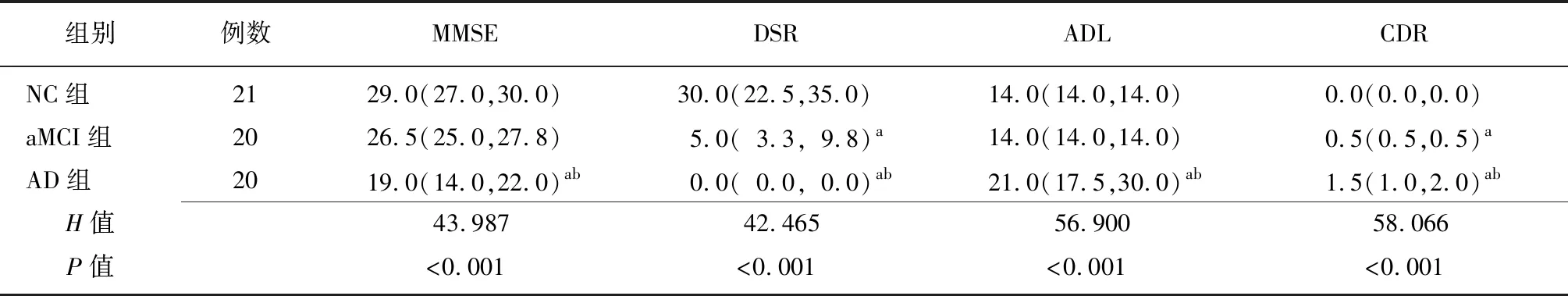
表2 3组受试者的认知功能比较 [分,M(P25,P75)]
2.4差异肠道菌群相对丰度与认知功能的相关性 将上述差异菌群的相对丰度与认知功能测试分数进行相关性分析,结果显示,不同分类水平上厚壁菌门、梭菌纲、梭菌目、梭菌科相对丰度与MMSE评分呈正相关(P<0.05),β变形菌纲、伯克菌目、产碱杆菌科、萨特菌属相对丰度与MMSE评分呈负相关(P<0.05);不同分类水平上厚壁菌门、梭菌纲、梭菌目、梭菌科相对丰度与DSR评分呈正相关(P<0.05),β变形菌纲、伯克菌目、产碱杆菌科、萨特菌属相对丰度与DSR评分呈负相关(P<0.05)。见表4。
3 讨 论
人体内定居着大量的微生物,据估计,人体内存在500~1 000种细菌[19],其中大部分定居在肠道[20]。肠道菌群通过免疫、循环和神经途径调节中枢神经系统的发育和稳态,反过来,中枢神经系统通过应激和内分泌反应塑造肠道微生物群落,这种肠-脑轴的双向作用可能与复杂的中枢神经系统疾病有关[21]。肠道菌群导致AD的机制可能始于肠道微生物群失调、局部和全身炎症的发展以及肠-脑轴的失调,肠上皮屏障通透性的增加导致细菌、病毒及其神经活性产物的侵袭,并引起大脑的神经炎症反应,进而导致AD[22]。但既往对于AD患者肠道菌群与认知功能关系的研究仍不充分。
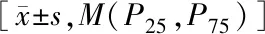
表3 3组受试者的差异肠道菌群相对丰度比较
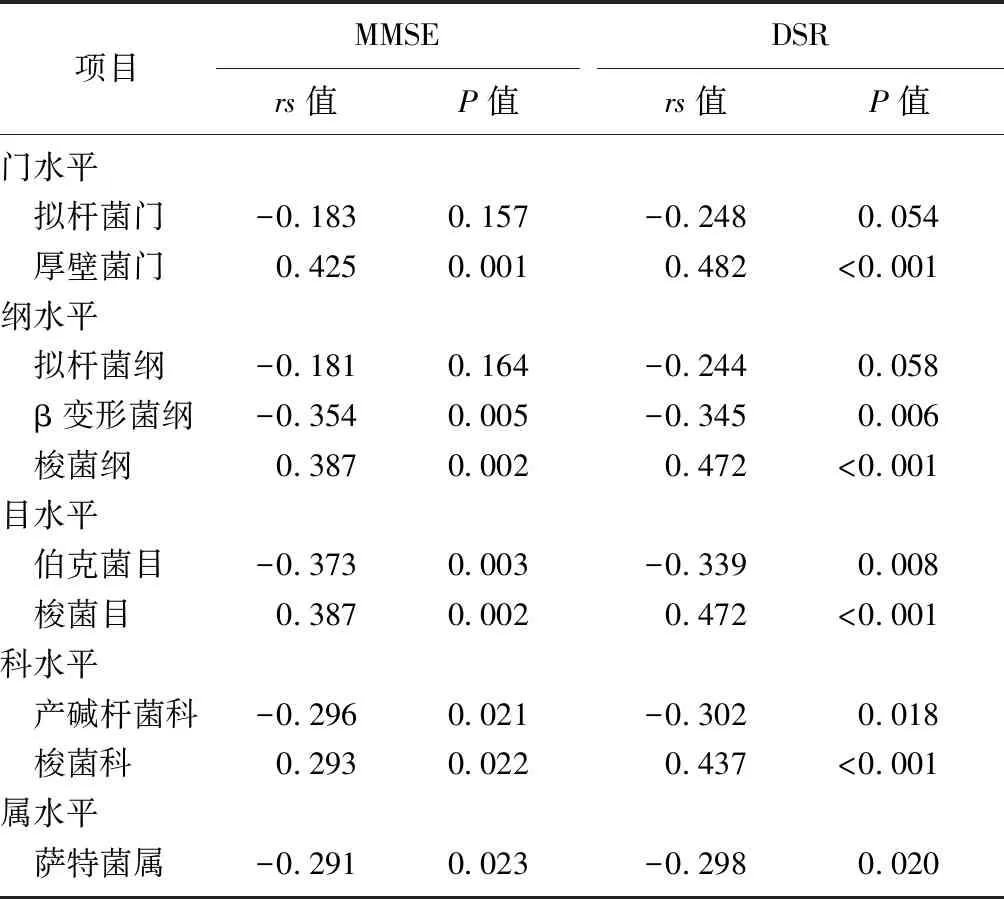
表4 差异肠道菌群相对丰度与认知功能的相关性
拟杆菌门和厚壁菌门是肠道菌群中的两个优势细菌门。本研究结果显示,AD患者拟杆菌门、拟杆菌纲、拟杆菌目增加,aMCI和AD患者的厚壁菌门均减少,且厚壁菌门与MMSE和DSR评分呈正相关,提示人体肠道中拟杆菌门和厚壁菌门菌群的改变可能导致总体认知功能和情景记忆功能的下降,进而促进AD的发生和进展。目前,对于AD患者肠道菌群的研究仍存在争议。Vogt等[23]研究发现,AD患者的肠道菌群中厚壁菌门减少、拟杆菌门增加;也有研究显示,AD患者的肠道菌群中拟杆菌门减少[24]。这些研究的样本量较小,难以得出一致的结论,故需要大样本的研究提供更为可靠的证据。
人体内的肠道菌群通过产生短链脂肪酸对结肠黏膜的结构完整性和代谢功能发挥重要作用,其中乙酸、丙酸和丁酸是肠腔中含量最丰富的短链脂肪酸[7]。拟杆菌主要产生乙酸和丙酸盐,而厚壁菌主要产生丁酸盐。丁酸盐是结肠细胞的主要能量来源,已证明其可增加小鼠的胰岛素敏感性,并有抗炎作用,且有潜在的“抗肥胖”作用[25]。在糖尿病[26]和肥胖[27]人群中厚壁菌门减少,而糖尿病和肥胖是AD发病的危险因素[28-29]。此外,丁酸盐还可能通过诱导抗氧化应激、作为组蛋白去乙酰化酶抑制剂防止神经元死亡[30]。
有研究显示,在Aβ寡聚体诱导的AD小鼠肠道菌群中梭菌显著减少[31]。本研究中AD患者肠道菌群中梭菌纲、梭菌目、梭菌科显著减少,且相关性分析显示梭菌相对丰度的减少与情景记忆功能和总体认知水平下降有关。有学者对2型糖尿病患者肠道菌群进行分析,发现梭菌纲显著降低[26]。也有研究发现,在多发性硬化患者的肠道菌群中梭状芽孢杆菌ⅪVa和Ⅳ明显减少甚至耗竭[32],由于多发性硬化是一种影响大脑和脊髓的自身免疫性疾病,而梭状芽孢杆菌所生产的丁酸能够维持结肠上皮稳态并通过诱导结肠调节性T细胞产生抗炎作用,故研究者推测大量产丁酸梭状芽孢杆菌的缺失与多发性硬化的发病机制有关。因此,作为丁酸的生产者,厚壁菌门及其下属的梭状芽孢杆菌可能通过抗炎、抗氧化应激、增加胰岛素敏感性等对AD相关的认知功能产生积极影响。
拟杆菌门、变形菌门均属于革兰阴性菌,可分泌大量的脂多糖,脂多糖可能作用于白细胞和小胶质细胞Toll样受体4,促进核因子κB介导的细胞因子产生,从而升高Aβ水平,损害少突胶质细胞和髓鞘,同时,Aβ1~42也是Toll样受体4的激动剂,可引起Aβ水平升高,形成恶性循环,加重AD进展[33]。伯克菌目是β变形菌纲中的一个目,产碱杆菌科是伯克菌目中的一个科,萨特菌属是产碱杆菌科的一个属,与其他变形菌一样,均属于革兰阴性菌。本研究结果显示,AD组β变形菌纲、伯克菌目、产检杆菌科、萨特菌属的相对丰度显著升高,且与MMSE评分以及DSR评分呈负相关,这可能与其分泌的脂多糖导致认知损害有关。动物实验显示,口服益生菌(乳双歧杆菌、干酪乳杆菌、双歧杆菌和嗜酸乳杆菌)可显著改善老年SAMP8小鼠的记忆缺陷、脑神经元和突触损伤、胶质细胞活化,并改善肠道和大脑中的菌群组成,同时减轻肠屏障和血脑屏障的破坏,降低血浆和大脑中的脂多糖水平,在信使RNA水平上降低大脑和肠道的炎症因子水平[34]。
综上所述,拟杆菌门、厚壁菌门、梭菌纲、变形菌纲及其部分下属的菌群改变可能导致AD患者认知功能下降,可能促进AD的发生发展。因此,肠道菌群可能成为AD的生物标志物,且可能通过调节肠道菌群来预防和治疗疾病。但本研究属于横断面研究,难以得出肠道菌群变化与AD认知功能变化的因果关系,且样本量较小,可能存在偏倚,需要大样本、前瞻性研究进一步验证。

