抑肺饮抑制肺癌转移的机制研究
汪一帆, 陈观平, 李颖, 应栩华
[1.浙江省立同德医院(浙江省中医药研究院)中西医结合肿瘤研究所,浙江杭州 310012;2.浙江省立同德医院药剂科,浙江杭州 310012]
肺癌是全球死亡率最高的恶性肿瘤,其中小细胞肺癌的5年生存率仅为7%,而非小细胞肺癌为21%,严重危害人类生命健康[1-2]。由于肺癌出现症状比较晚、早期不易被发现,大多数患者发现时已是中晚期,已发生局部或广泛的转移。转移成为导致肺癌患者死亡的主要原因。中药抑肺饮是浙江省立同德医院治疗肺癌的验方,疗效确切,前期研究证实抑肺饮可抑制肺癌细胞的生长,并可下调血管内皮生长因子(VEGF)、核转录因子kappaB(NF-κB)、靶基因B淋巴细胞瘤2(Bcl-2)表达水平[3]。VEGF是作用最强的促血管生长因子之一,可特异性促进内皮细胞分裂与增殖,诱导细胞外基质降解以利于新生血管的生长,促进癌细胞进入血循环而形成转移[4]。有研究显示VEGF促进肿瘤侵袭转移的机制与上皮间质转化(EMT)密切相关[5-6]。NF-κB可以通过调控转录因子JunB的表达激活VEGF的转录[7]。因此,我们推测抑肺饮可能是通过肿瘤坏死因子α(TNF-α)-NF-κB信号通路调控VEGF,进而调节细胞EMT,抑制肺癌转移。本研究中我们以TNF-α-NF-κB信号通路为靶点,从调控EMT的角度对抑肺饮干预肺癌的作用进行探讨,以期为临床上能有效运用抑肺饮治疗肺癌提供基础支持。现将研究结果报道如下。
1 材料与方法
1.1 试剂与仪器E-钙黏蛋白(E-cadherin)单克隆抗体(美国BD Biosciences公司);波形蛋白(Vimentin)单克隆抗体(美国Thermo Scientific公司);磷酸化NF-κB p65(p-NF-κB p65)单克隆抗体(美国Santa Cruz公司);TNF-α(美国Pepro Tech公司);胎牛血清(美国Gemini公司);细胞培养基(美国Hyclone公司);二甲基亚砜(DMSO)、四甲基偶氮唑盐(MTT)(德国Sigma公司);双荧光素酶检测试剂盒(美国Promega公司);第一链cDNA合成试剂盒、转染试剂(瑞士Roche公司)。i3x多功能酶标仪(美国Molecular Devices公司);蛋白电泳仪(美国Bio-Rad公司);LightCycler 480 II荧光定量PCR仪(瑞士Roche公司);DM3000B正置显微镜(德国Leica公司)。
1.2 药物及制备抑肺饮由黄芪、党参、麦冬、半夏、野荞麦根、川芎、蜈蚣等组成,其中药材均购自杭州华东中药饮片有限公司。称取各味药材,加水浸泡过夜,次日加入至10倍药量的水,分2次煎煮,收集、合并2次滤液,最终浓缩成6.5 g/mL的药液,分装灭菌后保存于4℃冰箱备用。顺铂(DDP)(0.02 g/瓶,由齐鲁制药有限公司生产,批号:1WA2A1604021B)。
1.3 体外研究
1.3.1 细胞来源与培养人肺癌细胞A549购自中国科学院上海生命科学研究院细胞资源中心,以含体积分数10%胎牛血清的RPMI 1640培养液,置于37℃恒温、体积分数5%CO2、饱和湿度培养箱中培养。
1.3.2 含药血清的制备40只雄性SD大鼠,体质量(200±20)g,购自浙江省实验动物中心,动物质量合格证号:SCXK(浙)2014-0001。将SD大鼠随机分为抑肺饮高、中、低剂量组和阴性对照组4组,每组各10只。抑肺饮高、中、低剂量组根据成人的临床用药剂量换算成相应大鼠高、中、低剂量(抑肺饮浓缩汤剂1.135 mL分别调整为3、6、12 mL)灌胃抑肺饮,阴性对照组按照3 mL/200 g体质量给予灌胃生理盐水,每日2次,灌胃3 d。第3天在首次给药2 h后,再次给药。末次给药1 h后腹腔注射10%水合氯醛麻醉,腹主动脉采血,于室温静置3 h,以2 500 r/min(最大半径168 mm)、4℃离心25 min,取上清,灭活后微孔滤膜过滤除菌,分装冻存。
1.3.3 MTT法检测A549细胞的增殖情况消化、收集处于对数生长期的A549细胞,调整密度为1×105/mL,接种于96孔培养板中,每孔100μL。培养24 h后分别加入5%、10%和20%的抑肺饮低、中、高剂量含药血清及空白血清,设置4个复孔。继续培养24、48、72 h后吸弃培养液,加入5 mg/mLMTT溶液,每孔10μL,孵育4 h,弃上清,每孔加入DMSO 75μL终止反应。应用酶标仪于490 nm波长处测量吸光度值。调零孔设置:培养基、MTT、DMSO;对照孔设置:细胞、相同浓度的药物溶解介质、培养液、MTT、DMSO。细胞抑制率(%)=(1-实验组吸光度值/对照组吸光度值)×100%。
1.3.4 TNF-α诱导A549细胞EMT模型的建立将A549细胞按5×105个/孔接种于6孔板,培养24 h,使用10 ng/mL浓度的TNF-α处理细胞7 d。观察细胞形态的变化,并通过检测细胞EMT标志物的表达情况,判定是否成功建立细胞EMT模型。
1.3.5 荧光定量PCR法检测细胞EMT标志物E-cadherin和Vimentin的mRNA表达水平用10 ng/mL浓度的TNF-α处理细胞7 d后检测细胞中E-cadherin和Vimentin的mRNA表达水平,判定是否成功诱导细胞EMT模型。另外,为了观察抑肺饮对细胞EMT的作用,在10 ng/mL浓度的TNF-α刺激5 d后,分别加入5%空白血清和5%抑肺饮高剂量含药血清处理48 h。PCR实验步骤:首先根据NCBI搜索获取的目标基因mRNA序列信息设计引物,引物序列见表1。应用TRIzol法提取细胞总RNA,进行反转录。进行PCR反应,扩增条件:95℃10 min预变性,95℃10 s、60℃10 s、72℃10 s,45个循环。结果分析:ΔCt=Ct目的基因-CtGAPDH,ΔΔCt=ΔCt用药组-ΔCt对照组,2-ΔΔCt为用药组目的基因表达相对于对照组的变化倍数。

表1 荧光定量PCR扩增基因引物序列Table 1 Amplified gene primer sequence of fluorescence quantitative PCR
1.3.6 蛋白免疫印迹(Western Blot)法检测E-cadherin、Vimentin、p-NF-κB p65的蛋白表达水平用10 ng/mL浓度的TNF-α处理细胞7 d后检测细胞中E-cadherin和Vimentin的蛋白表达水平,判定是否成功诱导细胞EMT模型。为了观察抑肺饮对细胞EMT和NF-κBp65磷酸化的作用,设置TNF-α+空白血清组和TNF-α+抑肺饮含药血清组,在10 ng/mL浓度的TNF-α刺激5 d后,分别加入5%空白血清和5%抑肺饮高剂量含药血清干预细胞48 h。Western Blot实验步骤:用蛋白裂解液处理收集的细胞,离心后取上清,采用Bradford法进行蛋白定量。所得样品进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白,将蛋白转至聚偏氟乙烯(PVDF)膜,再经50 g/L脱脂奶粉封闭,一抗4℃孵育过夜,次日二抗孵育1 h,电化学发光(ECL)显色等过程,最后应用ImageJ软件分析电泳条带的灰度值,以Actin为内参,计算各组蛋白相对表达含量。
1.3.7 荧光素酶报告基因检测细胞NF-κB信号通路活性将293T细胞(购自中国科学院上海生命科学研究院细胞资源中心,该细胞适用于转染实验)以1.2×104个/孔的浓度接种于24孔板。待细胞生长到50%汇合度时,每孔细胞以100 ng NF-κB启动子报告基因载体(由实验室自行构建,将NF-κB response element克隆至pGL3-Basic载体构建而成)和10 ng海肾萤光素酶质粒pRL-TK(购自美国Promega公司)混合质粒进行共转染。24 h后用10 ng/mL浓度的TNF-α、TNF-α+5%抑肺饮含药血清、TNF-α+5%空白血清分别对细胞进行干预,48 h后以裂解液100μL/孔裂解细胞,使用双荧光素酶检测试剂盒对各组细胞的荧光素酶活性进行测定。
1.3.8 Transwell法观察肺癌细胞侵袭能力细胞侵袭实验在用Matrigel包被的Transwell装置中进行。取24孔板,预先每孔加入500μL培养基(含EGF,实验组含抑肺饮含药血清,对照组含空白血清),置入Transwell,在内室加入经TNF-α诱导的A549细胞(150μL含0.5%血清的培养基),置于37℃培养箱。24 h后取出,用棉签擦去膜靠近内室那一面的细胞,再将Transwell置于甲醇中,室温下固定15 min,结晶紫染色20 min,观察穿孔细胞并进行拍照、计数。
1.3.9 划痕实验观察肺癌细胞迁移能力先用记号笔在6孔板背面标记便于拍照时定位。细胞消化后接种到6孔板,待细胞铺满培养板后,用枪头在培养板底部制造细胞划痕,尽可能保持划痕的宽度一致,洗去划痕时产生的细胞碎片,拍照记录。实验组加入抑肺饮含药血清,对照组加入空白血清,培养48 h后再次拍照。
1.4 体内研究
1.4.1 小鼠肺癌移植瘤模型的建立60只雄性SPF级C57BL/6J小鼠,体质量18~22 g,购自上海斯莱克下属灵畅生物科技有限公司,动物质量合格证号:SCXK(沪)2013-0018。小鼠肺癌细胞LL/2购自中国科学院上海生命科学研究院细胞资源中心,以含体积分数10%胎牛血清的DMEM培养液,置于37℃恒温、体积分数5%CO2、饱和湿度培养箱中培养。取处于对数生长期的小鼠肺癌细胞LL/2,调整细胞密度至1×107个/mL,将细胞接种至小鼠右侧后肢皮下,每只小鼠注射0.2 mL,建立肺癌移植瘤模型。
1.4.2 瘤体生长和肺转移情况将成功构建模型的小鼠随机分为6组,即模型组、顺铂组、抑肺饮联合顺铂组及抑肺饮高、中、低剂量组,每组10只。次日开始给药,根据成人的临床用药剂量换算出相应小鼠的用药剂量,抑肺饮高、中、低剂量分别相当于成人等效剂量的20、10、5倍给药。给药方案:模型组(生理盐水,0.5 mL/只)、顺铂组(3 mg/kg)、抑肺饮联合顺铂组(抑肺饮10 g/kg+顺铂3 mg/kg)、抑肺饮高剂量组(20 g/kg)、抑肺饮中剂量组(10 g/kg)和抑肺饮低剂量组(5 g/kg)。腹腔注射顺铂,隔日1次,共4次;其余灌胃给药,每日1次。每日记录体质量及一般情况。末次给药后24 h处死小鼠,解剖取瘤,称体质量,计算抑瘤率,抑瘤率(%)=(模型组平均瘤质量-治疗组平均瘤质量)/模型组平均瘤质量×100%。取肺及肿瘤组织进行固定,取部分肿瘤组织提取RNA。苏木素-伊红(HE)染色后观察肺部转移灶。
1.4.3 免疫组织化学法检测瘤组织p-NF-κB p65的表达将小鼠皮下移植瘤组织用10%福尔马林溶液固定12 h后,进行常规石蜡包埋切片。脱蜡,水化,热修复抗原,3%过氧化氢清除内源性过氧化酶,封闭,一抗p-NF-κBp65(1∶100稀释)37℃孵育,HRP标记的二抗孵育,DAB显色,苏木素复染,脱水,透明和封片,镜检。
1.4.4 荧光定量PCR法检测瘤组织B细胞淋巴瘤-xL(Bcl-xL)和细胞周期蛋白D1(CyclinD1)mRNA表达水平设置模型组、顺铂组、顺铂+抑肺饮组、抑肺饮高剂量组。PCR操作方法同“1.3.5”项。
1.5 统计方法采用SPSS23.0统计软件进行数据分析,计量资料以均数±标准差(±s)表示,多组比较采用单因素分析,两两比较采用t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 抑肺饮含药血清对肺癌A549细胞增殖的影响MTT实验结果显示:5%和10%浓度的抑肺饮高剂量含药血清组细胞抑制率在用药48 h后最高;在用药24、48 h后,各组中基本都是5%浓度含药血清的细胞抑制率最高。具体结果见表2。因5%高剂量抑肺饮含药血清处理48 h抑制效果最佳,故作为后续实验含药血清的用药剂量。
表2 抑肺饮含药血清对A549细胞增殖的影响Table 2 Effect of Yifei Yin-containing serum on proliferation of A549 cells (±s)

表2 抑肺饮含药血清对A549细胞增殖的影响Table 2 Effect of Yifei Yin-containing serum on proliferation of A549 cells (±s)
①P<0.05,②P<0.01,与阴性对照组比较
组别阴性对照组抑肺饮低剂量组抑肺饮中剂量组抑肺饮高剂量组阴性对照组抑肺饮低剂量组抑肺饮中剂量组抑肺饮高剂量组阴性对照组抑肺饮低剂量组抑肺饮中剂量组抑肺饮高剂量组浓度(%)抑制率(%)0 1.63 2.29 4.87 0 6.20 5.92 5.41 0 6.12 7.78 9.20 5555 10 10 10 10 20 20 20 20 24 h吸光度值0.51±0.02 0.47±0.01①0.45±0.02②0.44±0.02②0.50±0.02 0.49±0.01 0.47±0.01 0.48±0.04 0.43±0.01 0.43±0.06 0.42±0.05 0.42±0.06抑制率(%)0 7.01 11.80 12.84 0 1.97 5.75 3.33 0 1.15 3.00 3.00 48 h吸光度值0.65±0.03 0.64±0.03 0.61±0.04 0.46±0.02②0.68±0.01 0.68±0.04 0.68±0.05 0.64±0.03 0.58±0.10 0.57±0.11 0.53±0.08 0.54±0.12抑制率(%)0 2.82 6.19 30.23 0 0.84 1.17 6.26 0 0.73 7.99 5.92 72 h吸光度值0.77±0.03 0.75±0.03 0.75±0.01 0.73±0.03 0.79±0.10 0.74±0.05 0.74±0.10 0.74±0.04 0.92±0.02 0.86±0.12 0.85±0.09 0.83±0.06
2.2 肺癌细胞EMT模型的建立A549细胞用TNF-α连续刺激7 d后形态发生较为明显变化,细胞由团聚生长状态变为分散状态。收集细胞,应用Western Blot法发现TNF-α诱导后下游信号分子NF-κB p65的磷酸化水平增强,TNF-α-NF-κB信号通路被活化。具体结果见图1。进一步应用荧光定量PCR和Western Blot法检测细胞EMT标志物的表达水平,发现TNF-α刺激后上皮表型标志物E-cadherin mRNA和蛋白表达水平明显下降,间质表型标志物Vimentin mRNA和蛋白表达水平明显升高。具体结果见表3、图1。结果证实成功诱导了细胞EMT模型。

图1 TNF-α诱导对A549细胞EMT标志物蛋白及NF-κB p65的磷酸化表达水平的影响Figure 1 Effect of TNF-αinduction on levels of protein expression of EMT markers and phosphorylation of NF-κB p65 in A549 cells
表3 TNF-α诱导对A549细胞EMT标志物mRNA表达水平的影响Table 3 Effect of TNF-αinduction on mRNA expression levels of EMT markers in lung cancer A549 cells (±s)

表3 TNF-α诱导对A549细胞EMT标志物mRNA表达水平的影响Table 3 Effect of TNF-αinduction on mRNA expression levels of EMT markers in lung cancer A549 cells (±s)
①P<0.01,与对照组比较
组别对照组TNF-α组Vimentin mRNA(fold change)1.00 1.62±0.03①E-cadherin mRNA(%)100.00 33.39±1.42①
2.3 抑肺饮对TNF-α诱导的A549细胞NF-κB信号通路活性的影响通过荧光素酶报告基因检测实验观察抑肺饮对NF-κB信号通路活性的影响。结果显示,TNF-α能提高A549细胞NF-κB p65活性,而加入抑肺饮含药血清后,NF-κBp65相对活性明显低于正常血清组,差异有统计学意义(P<0.01),具体结果见表4。结果表明,抑肺饮对TNF-α诱导的肺癌细胞NF-κB信号通路活化有明显的抑制作用。
表4 抑肺饮对TNF-α诱导的A549细胞NF-κB信号通路活性的影响Table 4 Effectof YifeiYin on activity of NF-κBsignaling pathway in TNF-α-induced A549 cells (±s)

表4 抑肺饮对TNF-α诱导的A549细胞NF-κB信号通路活性的影响Table 4 Effectof YifeiYin on activity of NF-κBsignaling pathway in TNF-α-induced A549 cells (±s)
①P<0.01,与对照组比较;②P<0.01,与TNF-α+空白血清组比较
相对活性(FL/RL)(萤火虫荧光素酶Firefly Luciferase/海肾荧光素酶Renilla Luciferase)1.00 152.60±23.13①115.35±23.39 41.37±14.49②组别对照组TNF-α组TNF-α+空白血清组TNF-α+抑肺饮含药血清组
2.4 抑肺饮对TNF-α诱导的肺癌A549细胞EMT标志物及NF-κBp65磷酸化表达水平的影响在A549细胞EMT模型建立的基础上,用抑肺饮含药血清进行干预,采用荧光定量PCR法观察抑肺饮含药血清是否能够调控NF-κBp65磷酸化和细胞EMT。结果显示,TNF-α+抑肺饮含药血清组的NF-κB p65磷酸化水平与TNF-α+空白血清组比较,呈下降趋势,具体结果见图2。检测EMT标志物发现,TNF-α+抑肺饮含药血清组E-cadherin的表达水平要明显高于TNF-α+空白血清组。相反,Vimentin的mRNA表达水平在TNF-α+空白血清组中要显著高于TNF-α+抑肺饮含药血清组(P<0.01),具体结果见表5。采用Western Blot法检测2组细胞中EMT标志物的蛋白表达水平,检测结果与mRNA的变化趋势一致,具体结果见图2。上述研究结果表明,抑肺饮可能通过抑制TNF-α-NF-κB信号通路的激活来调节肺癌细胞EMT。

图2 抑肺饮对A549细胞EMT标志物蛋白及NF-κB p65的磷酸化表达水平的影响Figure 2 Effects of Yifei Yin on the levels of protein expression of EMT markers and phosphorylation of NF-κB p65 in A549 cells
表5 抑肺饮对TNF-α诱导的A549细胞EMT标志物mRNA表达水平的影响Table 5 Effect of Yifei Yin on the mRNA expression levels of EMT markers in TNF-α-induced A549 cells (±s)

表5 抑肺饮对TNF-α诱导的A549细胞EMT标志物mRNA表达水平的影响Table 5 Effect of Yifei Yin on the mRNA expression levels of EMT markers in TNF-α-induced A549 cells (±s)
①P<0.01,与TNF-α+空白血清组比较
组别TNF-α+空白血清组TNF-α+抑肺饮含药血清组Vimentin mRNA(%)100 58.04±0.57①E-cadherin mRNA(fold change)1.00 2.25±0.10①
2.5 抑肺饮对TNF-α诱导的A549细胞侵袭和迁移能力的影响为观察抑肺饮对肺癌细胞侵袭和迁移能力的影响,在建立TNF-α诱导A549细胞EMT模型的基础上用抑肺饮含药血清进行干预。侵袭实验结果可见,细胞培养48 h后,抑肺饮含药血清组穿过Transwell的细胞数显著少于空白血清组(P<0.05)。具体结果见表6,图3-A。表明抑肺饮具有抑制肺癌细胞侵袭能力的作用。迁移实验结果发现,细胞培养48 h后,空白血清组的细胞划痕间隙与抑肺饮含药血清组相比,明显变窄。具体结果见表6,图3-B。结果表明,抑肺饮具有抑制肺癌细胞迁移能力的作用。

图3 A549细胞的侵袭实验(A)(×100)和迁移实验(B)(×100)结果Figure 3 Results of A549 cell invasion assay(A)(×100)and migration assay(B)(×100)
表6 抑肺饮对TNF-α诱导的A549细胞侵袭和迁移能力的影响Table 6 Effects of Yifei Yin on invasion and migration of TNF-α-induced A549 cells (±s)

表6 抑肺饮对TNF-α诱导的A549细胞侵袭和迁移能力的影响Table 6 Effects of Yifei Yin on invasion and migration of TNF-α-induced A549 cells (±s)
①P<0.01,与TNF-α+空白血清组比较
组别TNF-α+空白血清组TNF-α+抑肺饮含药血清组迁移距离(%)100 36.31±2.55①侵袭细胞数(%)100 87.22±1.34①
2.6 动物模型的建立取60只C57BL/6小鼠,均成功建立Lewis肺癌移植瘤模型。从第7天起,各组小鼠右侧后肢处开始陆续出现皮下结节。第9天起,结节生长速度明显加快,以模型组最为明显。抑肺饮联合顺铂组移植瘤生长速度最慢,顺铂组仅次于抑肺饮联合顺铂组。除顺铂及联合用药组外,其他各组小鼠体质量基本逐渐增加,具体结果见图4。表明各剂量抑肺饮对小鼠无明显的毒副作用,顺铂对小鼠的毒副作用较为明显。

图4 各组小鼠体质量变化趋势Figure 4 Variation trend of body mass in mice
2.7 抑肺饮对Lewis肺癌移植瘤小鼠瘤体生长和肺转移的影响各组小鼠瘤质量的测量结果显示,与模型组相比,抑肺饮高剂量组、顺铂组和联合用药组的瘤质量均下降,且具有显著性差异(P<0.01);抑肺饮低、中剂量组的瘤质量与模型组比较,差异无统计学意义(P>0.05)。抑肺饮联合顺铂组的抑瘤率明显高于顺铂组及单用抑肺饮各组。具体结果见表7。表明抑肺饮对顺铂具有较好的增效作用。
模型组观察到较多明显的肿瘤转移灶,出血明显;抑肺饮用药组和顺铂组观察到零星转移灶,肺泡结构不完整,其中抑肺饮高剂量组和顺铂组情况优于抑肺饮中、低剂量组;抑肺饮联合顺铂组未观察到转移灶,肺泡未见收缩,肺泡结构清晰。具体结果见表7、图5。表明抑肺饮对肺癌移植瘤小鼠肺部组织的病理损伤具有缓解作用,能够抑制肺转移灶的形成,并在联合顺铂使用时效果更佳。
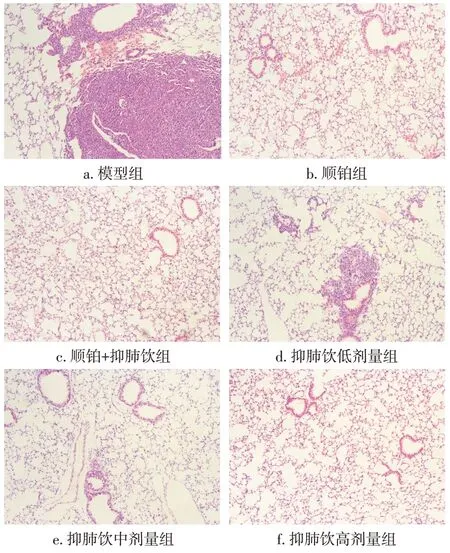
图5 各组小鼠肺组织病理表现比较(HE染色法,×100)Figure 5 Comparison of pathological manifestations of mouse lung tissue in various groups(by HE staining method,×100)
表7 各组Lewis肺癌移植瘤小鼠瘤质量、抑瘤率和转移率比较Table 7 Comparison of tumor mass,tumor-inhibiting rate and metastasis rate in various groups of mice bearing Lewis lung cancer xenografts (±s)

表7 各组Lewis肺癌移植瘤小鼠瘤质量、抑瘤率和转移率比较Table 7 Comparison of tumor mass,tumor-inhibiting rate and metastasis rate in various groups of mice bearing Lewis lung cancer xenografts (±s)
①P<0.01,与模型组比较
组别模型组顺铂组顺铂+抑肺饮组抑肺饮低剂量组抑肺饮中剂量组抑肺饮高剂量组转移率(%)77.8 55.6 0 66.7 57.1 50.0鼠数(只)999978平均瘤质量(g)2.64±0.74 1.80±0.64①1.65±0.68①2.61±0.71 2.06±0.37 1.80±0.53①抑瘤率(%)—31.79 37.58 1.25 21.81 31.71
2.8 抑肺饮对Lewis肺癌移植瘤小鼠瘤组织磷酸化NF-κB p65表达水平的影响上述研究结果显示,高剂量的抑肺饮或是抑肺饮联合顺铂使用对于小鼠肺癌生长和转移的抑制效果要明显优于中、低剂量抑肺饮的使用效果。基于此,我们进一步检测模型组、顺铂组、抑肺饮高剂量组以及顺铂+抑肺饮组肿瘤组织中磷酸化NF-κBp65的表达水平,研究抑肺饮的体内作用机制。免疫组织化学结果显示,模型组p-NF-κB p65有大量表达在细胞核中,抑肺饮高剂量组其表达明显被抑制,而在抑肺饮联合顺铂组中p-NF-κB p65的表达进一步降低。具体结果见图6。表明抑肺饮对肺癌细胞p-NF-κB p65的表达具有抑制作用,尤其是在联合顺铂使用时效果明显。
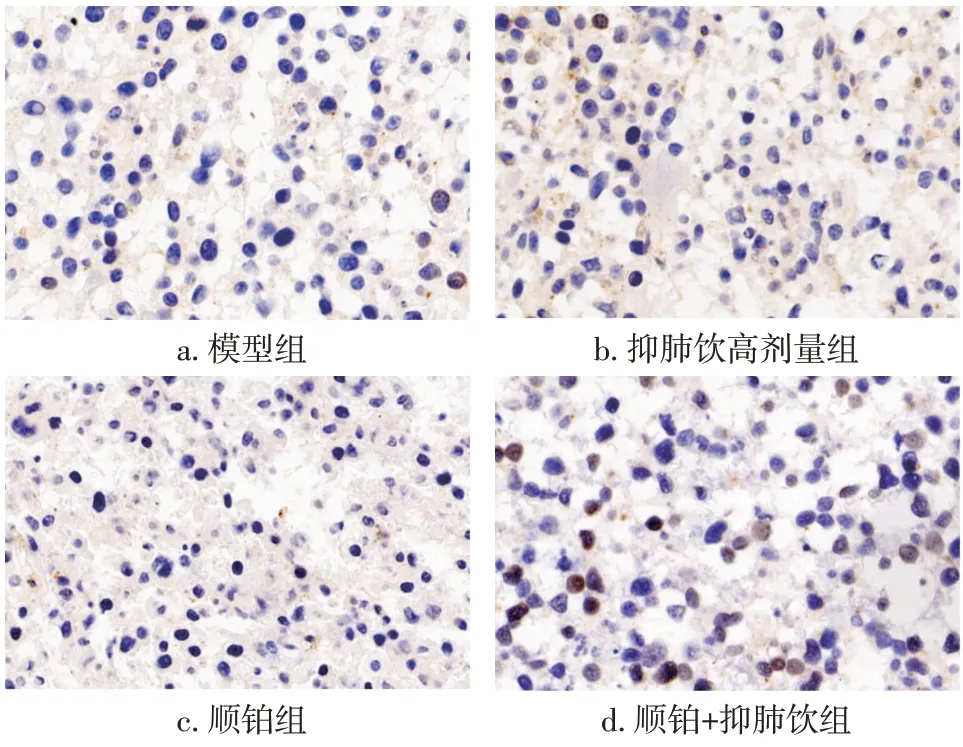
图6 抑肺饮对肿瘤组织中p-NF-κB p65表达的影响(免疫组织化学法,×400)Figure 6 Effect of Yifei Yin on the expression of p-NF-κB p65 in tumor tissue(by immunohistochemistry,×400)
2.9 抑肺饮对Lewis肺癌移植瘤小鼠瘤组织Bcl-xL和CyclinD1 mRNA表达的影响为了进一步明确NF-κB信号通路在抑肺饮调控干预肺癌进展中的作用,本研究对模型组、顺铂组、抑肺饮高剂量组以及顺铂+抑肺饮组小鼠的肿瘤组织中NF-κB的靶基因Bcl-xL和CyclinD1的mRNA表达水平进行检测,结果显示,与模型组相比,抑肺饮高剂量组Bcl-xL和CyclinD1的mRNA表达水平显著下降(P<0.01)。具体结果见表8。说明抑肺饮对移植瘤组织Bcl-xL和CyclinD1的表达具有一定抑制作用。此外,抑肺饮与顺铂联合使用时Bcl-xL和CyclinD1的表达水平进一步降低。Bcl-xL和CyclinD1分别为凋亡抑制基因和细胞周期调控基因,其表达的下调表明抑肺饮可以通过抑制NF-κB信号通路的激活,抑制肺癌细胞周期进展,促进肺癌细胞凋亡,从而干预肺癌进展。
表8 抑肺饮对肿瘤组织Bcl-xL和CyclinD1 mRNA表达的影响Table 8 Effect of Yifei Yin on mRNA expression of Bcl-xL and CyclinD1 in tumor tissue (±s)
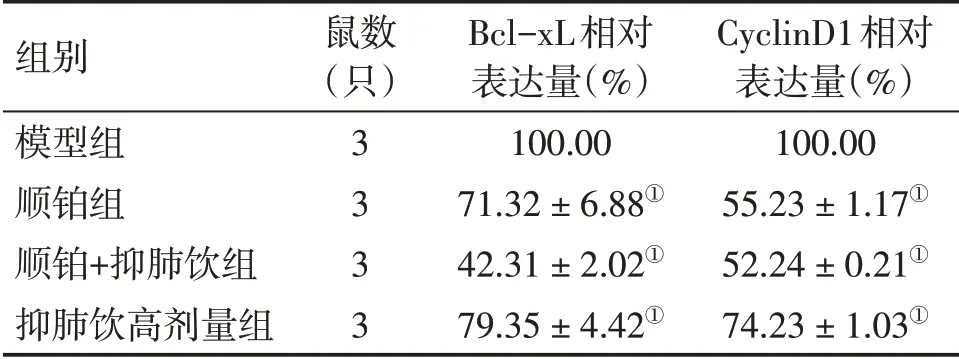
表8 抑肺饮对肿瘤组织Bcl-xL和CyclinD1 mRNA表达的影响Table 8 Effect of Yifei Yin on mRNA expression of Bcl-xL and CyclinD1 in tumor tissue (±s)
①P<0.01,与模型组比较
组别模型组顺铂组顺铂+抑肺饮组抑肺饮高剂量组CyclinD1相对表达量(%)100.00 55.23±1.17①52.24±0.21①74.23±1.03①鼠数(只)3333 Bcl-xL相对表达量(%)100.00 71.32±6.88①42.31±2.02①79.35±4.42①
3 讨论
肺癌属于中医学“肺积”的范畴。中医认为,肺癌的发生、发展主要是由于正气虚损、阴阳失衡、脏腑功能失调,致使气滞血瘀、痰凝毒聚,蕴结为癌瘤,癌瘤的生长又会反过来耗损正气,如此反复便成了癌。中药抑肺饮是我院根据肺癌的病因病机,结合临床经验,着眼于扶正、祛邪两方面拟定的,由黄芪、党参、麦冬、半夏、野荞麦根、川芎、蜈蚣等组成,其中,黄芪、党参补脾肺之气,麦冬养阴生津,半夏、野荞麦根豁痰解毒,川芎、蜈蚣祛瘀散结,全方攻补兼施,祛邪不伤正,补虚不留邪。
转移是恶性肿瘤特有的生物学特性,有效控制肿瘤转移是恶性肿瘤治疗的关键因素。肿瘤的转移是一个多因素参与、多步骤的复杂过程,其中EMT是肿瘤转移起始步骤中最重要的机制[8]。通过EMT上皮细胞获得成纤维细胞样特性,细胞间粘附下降,细胞活动性增强,使肿瘤细胞具有向周围组织或远处器官侵袭及转移的能力。该过程伴随着E-cadherin、N-cadherin和Vimentin等标志物的变化。已有报道,E-cadherin的缺失与肿瘤恶性程度密切相关,Vimentin的表达与肺腺癌的病理分级以及TNM分期呈正相关[9-10]。
EMT是一种细胞去分化程序,使肿瘤细胞具有可塑性和适应性,在多种癌症的浸润转移中起关键作用[11]。处于侵犯前沿的肿瘤细胞被成纤维细胞、巨噬细胞、血细胞、中性细胞等所包围,促炎症细胞产生诸多促炎症因子,诱导EMT和肿瘤转移[12]。在联系炎症与EMT的大量分子信号通路中,NF-κB是参与炎症诱导转移的核心分子[13]。TNF-α在低浓度、长时间作用下可以促进肿瘤的发展,该效应主要通过激活NF-κB发挥作用。TNF-α可通过其受体将炎症信号传入细胞内,经过肿瘤坏死因子受体相关死亡结构域(TRADD)、肿瘤坏死因子受体相关因子2(TRAF2)等激活NF-κB抑制因子激酶(IKK),IKK再将NF-κB抑制蛋白(I-κB)磷酸化,使其被泛素化、降解,并释放p65入核,从而激活NF-κB通路[14]。p65/RelA的磷酸化促进其与DNA中特定序列结合,触发NF-κB调控基因的转录激活,包括VEGF、抗凋亡基因Bcl-2和Bcl-xL、细胞周期调节基因CyclinD1等[15]。我们的研究发现,在TNF-α诱导的A549细胞EMT模型中,抑肺饮具有抑制A549细胞侵袭和迁移的作用。采用荧光定量PCR和Western Blot实验分别对EMT标志物的mRNA和蛋白表达水平进行检测,发现抑肺饮作用后E-cadherin表达上调,Vimentin表达下调,这提示抑肺饮可能通过调控EMT抑制肺癌细胞侵袭和迁移。进一步通过Western Blot实验和荧光素酶报告基因检测实验探讨抑肺饮调控肺癌细胞EMT的机制,结果显示,抑肺饮干预后NF-κB p65磷酸化水平和NF-κB启动子活性被抑制,提示抑肺饮抗肺癌作用的机制可能是通过干预TNF-α-NF-κB信号通路调节了细胞EMT。体内研究结果显示,抑肺饮对小鼠Lewis肺癌移植瘤具有不同程度的抑制作用,其中,抑肺饮联合顺铂组的抑瘤率最高,顺铂组、抑肺饮高剂量组次之。此外,抑肺饮具有抑制肺癌转移的作用,尤其是在联合顺铂时抑制转移的效果最为显著,并且能够下调瘤组织中NF-κB p65的磷酸化水平以及靶基因Bcl-xL、CyclinD1的mRNA表达水平,表明抑肺饮在体内可能通过干预NF-κB信号通路发挥抗肺癌作用。
综上所述,抑肺饮具有抑制肺癌细胞生长和转移的作用,其抑制可能与干预TNF-α-NF-κB信号通路从而调节EMT相关。

