柚皮苷/柠檬苦素微胶囊的制备、结构分析及特性研究
张亚杰,徐金帅,邹 波,李思含,李春美,
(1.华中农业大学食品科学技术学院,教育部环境食品学重点实验室,湖北武汉 430070;2.广东省农业科学院蚕业与农产品加工研究所,广东广州 510000)
柚皮苷(Naringin)和柠檬苦素(Limonin)广泛存在于柚皮中,是最主要的黄酮和三萜类物质。近年来,众多研究表明柚皮苷和柠檬苦素具有广泛的生物活性,如抗炎、抗肿瘤、抑菌、抗氧化、心血管疾病预防、干预骨质疏松等活性[1−6],在食品、医药以及化妆品等领域具有巨大的发展潜力。但其化学性质很不稳定,在加工处理过程中结构容易发生变化,甚至失去活性。有研究报道柚皮苷溶液在放置5 h后吸光值发生显著的变化[7]。而柠檬苦素在不同的pH、温度、与光照和氧气接触的时长都会发生不同程度的变化[8]。在45~90 ℃之间,降解速率会加快;在外界环境中暴露时间越久,生物活性越弱。不仅如此,柚皮苷和柠檬苦素是柚皮中最主要的苦味成分,其中柚皮苷和柠檬苦素的苦味阈值分别为20 mg/L[9]和6 mg/L[10],导致其很难被人们接受,限制了在食品中的应用。
微胶囊技术一般采用天然或合成的高分子作为包囊材料,通过各种不同的成膜反应形成一种连续的薄膜,将一些分散成细小的、具有反应活性、敏感或易挥发的固体小颗粒、小液滴、甚至气体小分子包覆起来,形成一种具有半透性或密封性的囊形结构,即微胶囊[11]。在众多的微胶囊制备方法中,锐孔造粒法因其良好的包埋率、载药率及操作简便而受到广泛的应用及研究[12]。黄酮类和三萜类物质吸收和代谢的场所主要是在小肠[13−14],这意味着柚皮苷和柠檬苦素必须减少在胃中的释放,因此,具有pH敏感性的海藻酸凝胶微粒在控制芯材的释放中发挥了不可或缺的作用。现今在微胶囊技术领域研究最多也是最成熟的微胶囊体系是以海藻酸钠和聚赖氨酸为壁材的微胶囊,但其制备工艺复杂,选用材料中聚赖氨酸成本高且难获取,大大局限了该种微胶囊的推广及应用。有研究发现,海藻酸盐和壳聚糖之间的结合比聚赖氨酸和海藻酸盐之间的结合显著增强,而且壳聚糖与聚赖氨酸化学结构较为相近,同时壳聚糖生物相容性好和易获取,被认为是聚赖氨酸的理想替代材料[15]。
因此,微胶囊技术具有保护芯材,控制芯材释放的同时降低或掩盖不良味道及延长保质期等优势[16−18]。且目前对柚皮苷和柠檬苦素微胶囊的研究鲜有报道。本文拟分别用海藻酸钠-壳聚糖-氯化钙作为微胶囊壁材对柚皮苷和柠檬苦素同时进行包埋,通过傅里叶红外光谱仪(FT-IR)和扫描电镜(SEM)分析、体外模拟胃肠消化试验,发现微胶囊化的柚皮苷和柠檬苦素可有效避开胃酸的侵害,在小肠内充分释放,有利于发挥其生理功能,提高生物利用率和转化率,以期为开发降糖、降脂食品提供一定的理论依据。
1 材料与方法
1.1 材料与仪器
柚皮苷和柠檬苦素 纯度≥99%,上海源叶生物科技有限公司;海藻酸钠和壳聚糖 食品级,上海麦克林生化科技有限公司;胃蛋白酶(纯度为1:15000)、胰酶(纯度为1:4000) 上海源叶生物科技有限公司。
Multiskan FC多功能酶标仪 赛默飞世尔科技公司;85-2磁力搅拌器 常州朗越仪器制造有限公司;pH计 上海捷莱科化工科技有限公司;Nicolet Nexus 470傅里叶红外光谱仪 美国Nicolet公司;扫描电镜(JSM-6390LV) 日本NTC公司。
1.2 实验方法
1.2.1 柚皮苷标准曲线的绘制 参照先前的方法[19],用70%乙醇配制2 mg/mL柚皮苷标准品溶液。分别吸取0.8、0.6、0.4、0.2、0.1和0.05 mL标准液至6个4 mL EP管,再分别加入0.2、0.4、0.6、0.8、0.9和0.95 mL 70%乙醇,配制成1.6、1.2、0.8、0.4、0.2和0.1 mg/mL的柚皮苷标准液。各取0.2 mL标准液,5 mL 90%一缩二乙二醇溶液,0.1 mL 4 mol/L NaOH溶液,4.7 mL去离子水,漩涡振荡5 s后置于40 ℃水浴中保温10 min,420 nm下测其吸光值,每个浓度重复测定三次并绘制标准曲线,得柚皮苷的回归方程y=0.1487x−0.003111,R2=0.9996。
1.2.2 柠檬苦素标准曲线的绘制 用无水乙醇配制0.2 mg/mL柠檬苦素标准品溶液;显示剂A液:125 mg对二甲氨基苯甲醛溶于100 mL的硫酸和乙醇混合液中(硫酸:无水乙醇=65:35(V:V)),放冷使用;显示剂B液:准确称取FeCl30.9 g,蒸馏水溶解并定容至10 mL;使用时向A液中加入0.5 mL B液;
分别吸取标准液0.125、0.25、0.5、1和2 mL柠檬苦素溶液,无水乙醇定容至2 mL,最后加入5 mL显色剂,振荡2 s,静置,30 min后490 nm下测其吸光度值,每个浓度重复测定3次并绘制标准曲线,得柠檬苦素的回归方程y=4.421x−0.04549,R2=0.9954。
1.2.3 微胶囊的制备 锐孔法制备柚皮苷/柠檬苦素微胶囊的具体操作步骤:称取一定量海藻酸钠60 ℃下加入去离子水边搅拌边溶解;向搅拌均匀的海藻酸钠溶液中加入一定量的柚皮苷和柠檬苦素,继续用磁力搅拌器搅拌均匀;将一定量的壳聚糖溶解于1%冰醋酸溶液,再加一定量氯化钙溶液,并用20% NaOH调pH,搅拌均匀;最后将柚皮苷与海藻酸钠混悬液用一定规格的注射器以一定速率加入到壳聚糖-氯化钙溶液中(300 r/min)搅拌,固化15 min,待微胶囊成形;抽滤收集,将制备成形的微胶囊置于冻干机中冷冻干燥,得到微胶囊成品。
1.2.4 微胶囊包埋率的测定 取1.2.3制备的湿囊,加入100 mL 70%乙醇均质10 min,抽滤,准确定容至100 mL,分别对柚皮苷和柠檬苦素进行检测,以测得的柠檬苦素和柚皮苷的总含量(mg/mL)为被包埋芯材的含量,再按照公式得出此微胶囊对包埋率。

1.2.5 确定适合的柠檬苦素与柚皮苷的比例 固定氯化钙质量分数1.5%,壳聚糖质量分数0.6%,海藻酸钠质量分数1.5%,pH为5.5,芯壁材比为1:2;设置柠檬苦素和柚皮苷的比例分别为1:1、1:2、2:5、1:5和1:10,总含量为0.15 g,然后测定包埋率。
1.2.6 确定适合的pH 固定柠檬苦素与柚皮苷的比例为1:5,氯化钙质量分数1.5%,壳聚糖质量分数0.6%,海藻酸钠质量分数1.5%,芯壁材比为1:2;柚皮苷和柠檬苦素0.15 g,设置不同的pH为:3、4、5、6和7,然后测定包埋率。
1.2.7 单因素实验
1.2.7.1 不同壁芯材比对柚皮苷和柠檬苦素包埋率的影响 固定柠檬苦素与柚皮苷的比例为1:5,氯化钙质量分数1.5%,壳聚糖质量分数0.6%,pH为6;柚皮苷和柠檬苦素0.15 g,设置不同海藻酸钠质量分数0.5%、1%、1.5%、2%和2.5%,即壁芯材比为2:3、4:3、2:1、8:3和10:3,然后测定包埋率。
1.2.7.2 不同壳聚糖质量分数对柚皮苷和柠檬苦素包埋率的影响 固定柠檬苦素与柚皮苷的比例为1:5,海藻酸钠质量分数为1.5%,氯化钙质量分数1.5%,pH为6,芯壁材比为1:2,柚皮苷和柠檬苦素0.15 g,设置不同的壳聚糖质量分数为0.3%、0.6%、0.9%、1.2%和1.5%,然后测定包埋率。
1.2.7.3 不同氯化钙质量分数对柚皮苷和柠檬苦素包埋率的影响 固定柠檬苦素与柚皮苷的比例为1:5,海藻酸钠质量分数为1.5%,壳聚糖质量分数0.6%,pH为6,芯壁材比为1:2,柚皮苷和柠檬苦素0.15 g,设置不同的氯化钙质量分数为1%、2%、3%、4%和5%,然后测定包埋率。
1.2.8 响应面法试验优化微胶囊制备的工艺条件在1.2.7单因素实验基础上,选取对包埋率影响较大的芯壁材比、壳聚糖质量分数、氯化钙分数进行响应面试验,利用Design-Expert-8.0.6软件中的响应面设计(Box-Behnken Design,BBD)进行3因素3水平试验(见表1)。
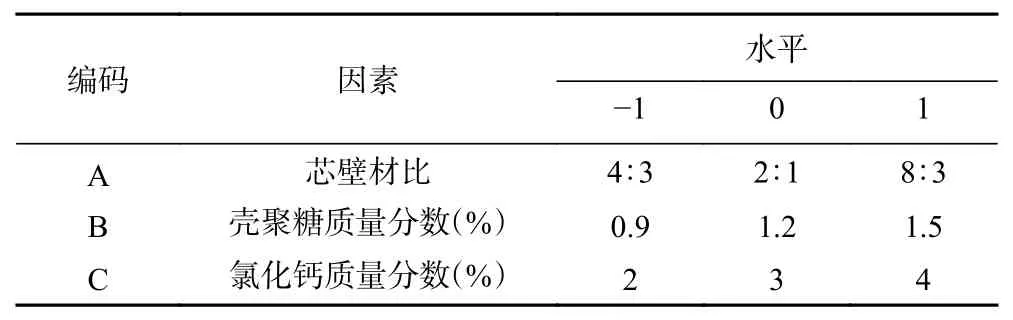
表 1 响应面试验因素及水平Table 1 Response surface factors and levels
1.2.9 FT-IR分析 将空微胶囊、载柚皮苷和柠檬苦素微胶囊粉末压片,采用傅立叶红外光谱仪(FT-IR)分别对这两种微胶囊的化学结构进行表征。扫描范围在4000~400 cm−1,记录样品的红外光谱图。
1.2.10 表面形态与内部结构观察 采用电子扫描显微镜(SEM)观察柚皮苷/柠檬苦素微胶囊表面形态及内部结构。先在样品台上贴上一层导电胶,将整个微胶囊和切成剖面的微胶囊轻轻粘在上面,然后在样品上喷金,供SEM观察微胶囊产品表面形态,加速电压为20 kV。
1.2.11 微胶囊热稳定性的研究 取5份等量的柚皮苷/柠檬苦素标准品和柚皮苷/柠檬苦素微胶囊,分别置于90 ℃下1、2、4、8和12 h,定时取样测定包埋前后柚皮苷/柠檬苦素微胶囊的保留率,考察温度等对柚皮苷/柠檬苦素稳定性的影响。
1.2.12 苦味强度测定 采用ASTREE电子舌仪器的Alphasoft软件进行分析,该系统含有7个脂膜传感器,分别是酸味(AHS)、通用(PKS)、咸味(CTS)、鲜味(NMS)、咸味(CTS)、甜味(ANS)和苦味(SCS)传感器,可以客观评价样品的苦味等强度值。以柚皮苷/柠檬苦素纯品和柚皮苷/柠檬苦素微胶囊为样品,配制10和20 mg/L的柚皮苷/柠檬苦素(柚皮苷和柠檬苦素之比为5:1)以及相对应的10和20 mg/L的柚皮苷/柠檬苦素微胶囊,取100 mL于电子舌专用测试烧杯中进行测试。平行测定4次,从苦味传感器测得相应的数据。
1.2.13 柚皮苷和柠檬苦素微胶囊在体外累计释放率的测定 人工模拟胃液的配制:取9 mL的浓盐酸,加约800 mL蒸馏水稀释,调pH约为1.2,然后再加胃蛋白酶10 g,混匀后待用;人工模拟肠液的配制:取磷酸二氢钾6.8 g,加水500 mL溶解,用0.4 mol/L的氢氧化钠溶液调pH至6.8,然后另取胰酶10 g加适量水溶解,最后将两液混合,定容至1000 mL即得人工肠液,备用。
准确称取1 g柚皮苷和柠檬苦素微胶囊2份,分别用人工模拟胃液和模拟肠液定容至20 mL,37 °C水浴,搅拌速度为100 r/min。每隔15 min取1 mL上清液,同时用等量同温的胃液和肠液补充,用70%乙醇定容至10 mL,用1.2.1和1.2.2中的方法测定吸光度A,代入柚皮苷回归方程y=0.1487x−0.003111和柠檬苦素回归方程y=4.421x−0.04549得到药物质量浓度C,计算出累计释放百分率,绘制释放曲线。
1.3 数据处理与分析试验
数据均以平均值±标准差表示,采用Prism 8软件进行处理以及用one-way ANOVA(P<0.05)进行分析。
2 结果与分析
2.1 柚皮苦味成分微胶囊工艺的研究
2.1.1 柚皮苷与柠檬苦素比例的确定 柚皮苷和柠檬苦素是柚皮中主要的黄酮和三萜类物质,都具有很强的生物活性,但这两类化合物也是柚皮苦味的主要成分,同时稳定性欠佳,严重影响了其产品的开发,因此将柚皮苷和柠檬苦素进行微胶囊化有助于解决这些问题,实现柚皮苷和柠檬苦素的产品化。前期的研究表明,柚皮苷和柠檬苦素均具有调节糖脂代谢的活性,复合使用效果更佳。柚皮苷在水中溶解性较好,而柠檬苦素微溶于水,因此我们首先需确定柚皮苷与柠檬苦素的比例。从图1中看出,随着柚皮苷比例的增加,包埋率也随之增加,可能因为柚皮苷的高水溶性导致芯材更好的分散在海藻酸钠溶液中。在柠檬苦素的质量过低时,溶液黏稠度下降,芯材无法被完全包埋,出现了包埋率轻微降低的现象。因此,选择柠檬苦素与柚皮苷质量之比为1:5来进行下一步的试验。
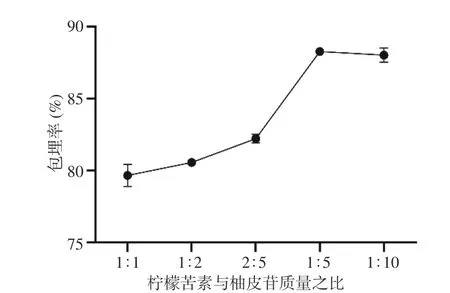
图 1 不同的柠檬苦素与柚皮苷质量之比对微胶囊包埋率的影响Fig.1 Effects of different mass ratios of limonin to naringin on embedding rate of microcapsules
2.1.2 pH对微胶囊的影响 pH的变化对壳聚糖和海藻酸钠所带电荷、空间构象均有一定影响。从图2中看出,包埋率随着pH的增加先增加后减少,这是因为壳聚糖的pKa为6.3,海藻酸钠中古洛糖醛酸的pKa为3.5,甘露糖醛酸的pKa是4.0[20],在低pH时,海藻酸盐中的-COO−基团随着pH的增加而增加,而壳聚糖中的-NH3+也随之减少,表面带电的数量更多,吸附的壳聚糖量也更多,因而成膜反应程度也加深,表现为微胶囊膜厚增加。当pH=6时,包埋率达到峰值,此时壳聚糖分子几乎不带电,电荷密度较低,分子空间伸展也较小,分子扩散系数较高,能更深入地扩散到海藻酸钙凝胶中,发生的聚电解质络合的强度高,膜较为致密,对芯材的扩散限制作用也更强,因此包埋率较高[21]。当pH=7时,包埋率降低,这是由于壳聚糖分子远离等电点,其空间结构改变的程度较小,因此与海藻酸钙凝胶网络孔径的匹配程度也变弱,膜稍微变薄。因此,我们选择pH=6来进行下一步试验。
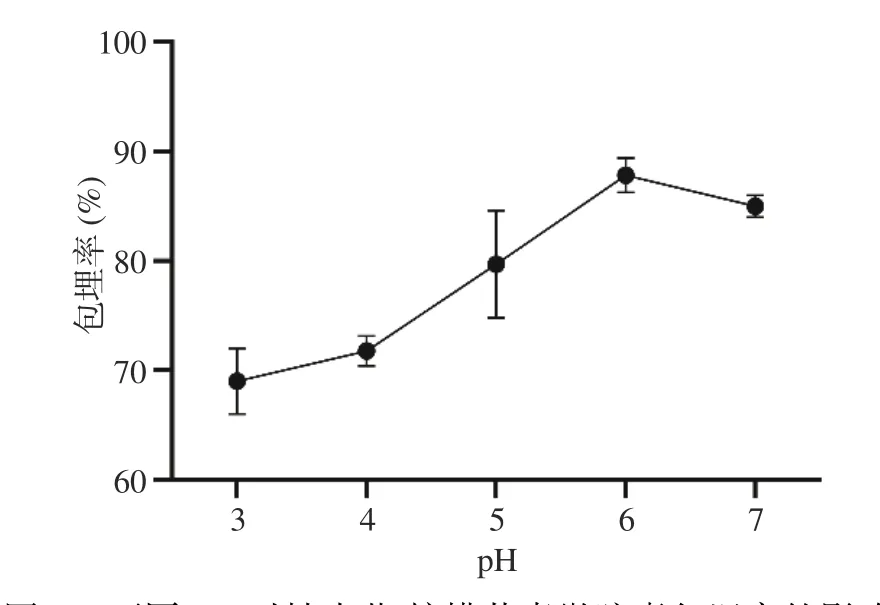
图 2 不同pH对柚皮苷/柠檬苦素微胶囊包埋率的影响Fig.2 Effects of different pH on embedding rate of naringin/limonin microcapsules
2.1.3 单因素实验
2.1.3.1 壁芯材比对微胶囊的影响 壁材和芯材是微胶囊化产品中最主要的物质材料,因此壁芯材比是影响其包埋率的一个重要因素。从图3中可以看出,包埋率随着壁芯材比的增加而增加,在壁芯材比2:1时包埋效果最好。当壁芯材比较低时,制得的微胶囊质地柔软而易变形,芯材容易外露,最终导致破裂,这可能是因为海藻酸钠质量分数低,海藻酸钠-壳聚糖聚电解质膜过薄,形成的微胶囊机械强度过低,导致囊壁不硬实,故不能进行有效的包埋;而当壁芯材比较高时,海藻酸钠与芯材溶液黏度过大,针孔堵塞,挤出比较困难,产生严重的拖尾现象[22],使包埋率降低,药物利用率也降低。因此选择壁芯材比4:3、2:1和8:3来进行下一步优化。
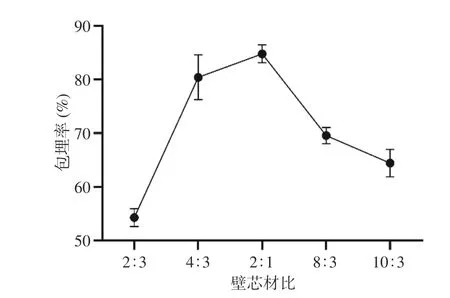
图 3 不同壁芯材比对柚皮苷/柠檬苦素微胶囊包埋率的影响Fig.3 Effects of different wall-to-core ratios on the embedding rate of naringin/limonin microcapsules
2.1.3.2 壳聚糖质量分数对微胶囊的影响 壳聚糖是自然界中少见的直链阳离子聚合物,在微胶囊囊壁的形成过程中扮演着不可缺少的角色。从图4中可知,在0.3%~1.2%范围内,随着壳聚糖质量分数的增大,微胶囊的成形效果更好,包埋率更高,这是因为随着壁材中壳聚糖含量增加,壁材包覆更加完全,囊壁变硬、不易破裂,因此包埋率随之上升。在1.2%质量分数包埋率达到最大值之后,囊壁逐渐增厚,机械强度也随之提高,但过厚的囊壁会使表面不平滑,出现一定凹陷,导致芯材外露,降低包埋率。因此选用壳聚糖质量分数0.9%、1.2%和1.5%来进行制备工艺的优化实验。

图 4 不同壳聚糖质量分数比对柚皮苷/柠檬苦素微胶囊包埋率的影响Fig.4 Effects of different mass ratio of chitosan on embedding rate of naringin/limonin microcapsules
2.1.3.3 氯化钙质量分数对微胶囊的影响 氯化钙在微胶囊的形成过程中为反应提供Ca2+,并且发挥固化剂的作用。从图5中可以看出,包埋率随氯化钙质量分数的增大先增大后减小,在3%质量分数处达到最大值。当氯化钙质量分数较低时,海藻酸钠与氯化钙的结合不充分,凝胶珠外层的固化膜较薄且结构不够坚硬,使得在制备过程中随着转子的转动而破裂,导致包埋率的降低。氯化钙质量分数过高时,外层迅速固化,微胶囊囊壁较厚,但是阻碍了凝胶珠内部固化,减少了壁材和芯材的相互接触,使芯材的附着性能下降,同样不利于微胶囊包埋率的提高。因此选用氯化钙质量分数2%、3%和4%来进行制备工艺的优化实验。

图 5 不同氯化钙质量分数比对柚皮苷/柠檬苦素微胶囊包埋率的影响Fig.5 Effects of different calcium chloride mass fraction ratio on the embedding rate of naringin/limonin microcapsules
2.1.4 响应面法试验结果
2.1.4.1 响应面法设计与结果分析 根据2.1.2和2.1.3实验的结果,确定柚皮苷与柠檬苦素的比例为5:1和pH=6来进行试验。将壁芯材比(A)、壳聚糖质量分数(B)和氯化钙质量分数(C)作为自变量,对这3个因素进行响应面法试验,柚皮苷/柠檬苦素微胶囊包埋率(Y)作为响应值。共有17个析因点,其中5个为中心点,其目的是估计实验的纯误差。试验结果如表2所示。
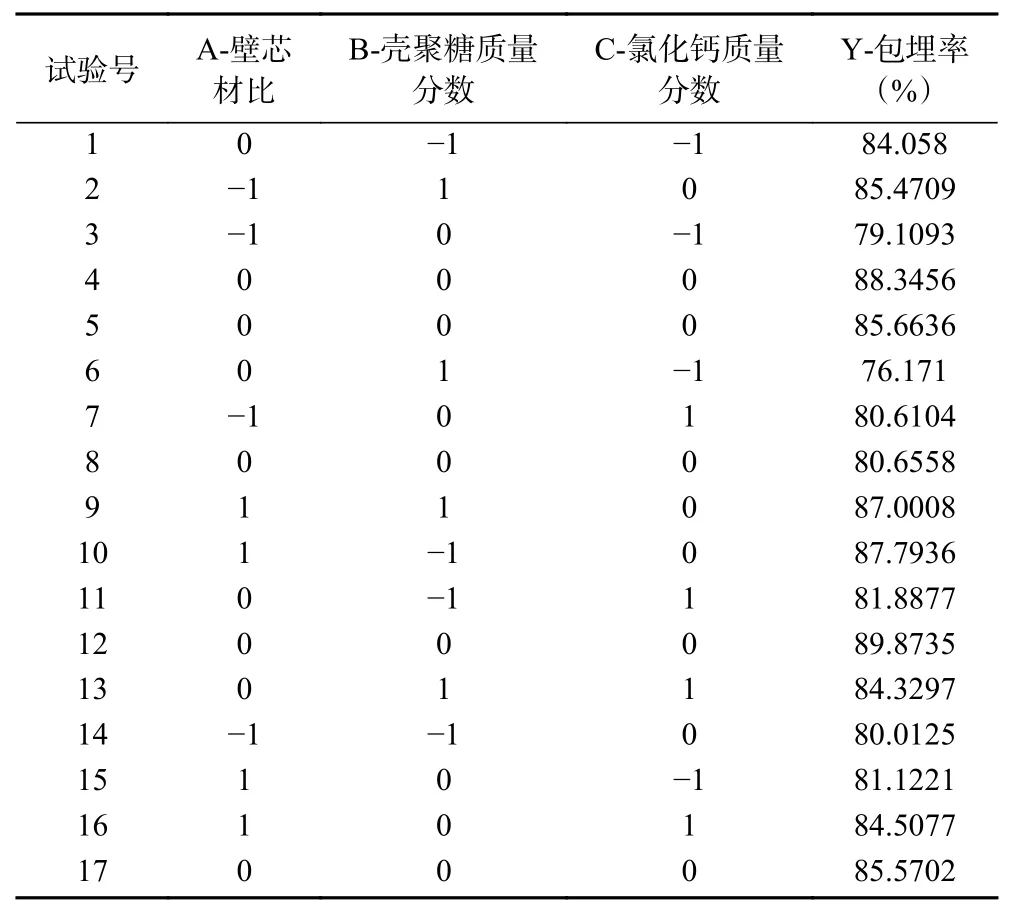
表 2 Box-Behnken设计及结果Table 2 Design and results of Box-Behnken
2.1.4.2 回归方程的建立与显著性分析 通过BBD设计Analysis中的ANOVA分析,可得包埋率(Y)与壁芯材比(A)、壳聚糖质量分数(B)、氯化钙质量分数(C)二次多元回归方程为:

由表3可以看出,该模型显示为显著(P<0.05),失拟项不显著(P>0.05)。R2=0.9587,进一步说明模型实际值与方程预测值之间有较好的相关性。根据BBD设计Optimization中的Numerical得出最优试验方案为壁芯材比2.67、壳聚糖质量分数为0.9%,氯化钙质量分数2.92%,微胶囊包埋率可达88.68%。
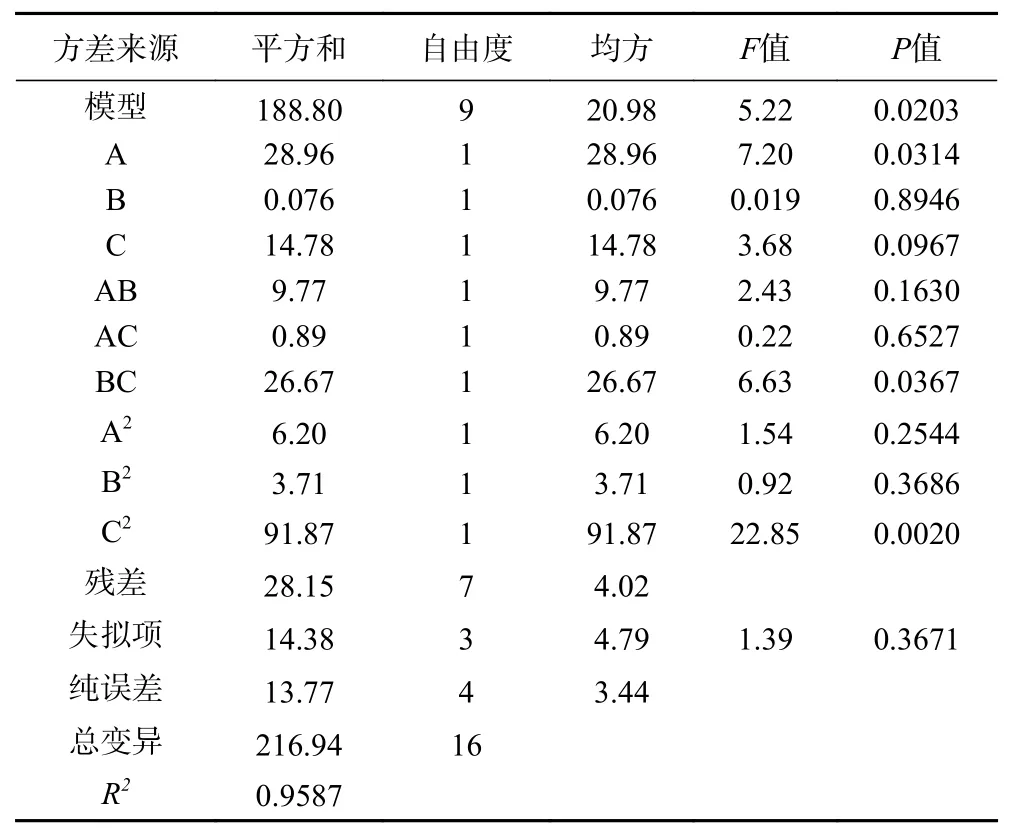
表 3 回归方程系数及显著性分析Table 3 Regression equation coefficient and significance analysis
2.1.4.3 柚皮苷/柠檬苦素微胶囊制备工艺验证 综合上述试验结果,通过单因素实验得到壁芯材比2:1,壳聚糖质量分数1.2%,氯化钙质量分数3%,包埋率达到最大,使用响应面试验设计综合考虑这3个因素,以柚皮苷/柠檬苦素微胶囊的包埋率最大值为目标值,经过响应曲面试验,对构建的二次回归方程进行优化后得到当壁芯材比8:3、壳聚糖质量分数为0.9%和氯化钙质量分数3%时,柚皮苷/柠檬苦素微胶囊包埋率约为88.2%,与理论值相对误差小于5%。说明该工艺准确可靠,可以用于柚皮苷/柠檬苦素微胶囊的生产加工。
2.2 柚皮苷/柠檬苦素微胶囊的结构、性质表征和体外释放特性
2.2.1 柚皮苷/柠檬苦素微胶囊的FT-IR 分析柚皮苷和柠檬苦素在4000~400 cm−1内有明显的特征峰,柚皮苷的特征峰有:3545、3478、2919、1648、1607、1520、1445、1357、1301、1227、1206、1183、1133、1096、1070 cm−1,柠檬苦素的特征峰有:1756、1710、1602、1505、1387、1370、1352、1285、1263、1210、1187、1122、1020、875、647 cm−1[23]。从图6可以看出,载柚皮苷和柠檬苦素微胶囊的吸收峰中均出现了柚皮苷和柠檬苦素的特征峰,以上都能有效证明微胶囊中成功载入柚皮苷和柠檬苦素药物。我们还可以从光谱中看出载药微胶囊和空微胶囊的基团保持一致,充分说明了在包埋过程中未改变原有微胶囊的分子结构。
2.2.2 微胶囊的结构形态特征 微胶囊的结构形态特征影响着微胶囊的性质,比如芯材的缓释速率、微胶囊产品的流动特性等。微胶囊表面完整性和内部的结构特征影响着芯材的释放,同时微胶囊颗粒外部表面形态与微胶囊产品的流动性密切相关,因此有必要研究微胶囊产品的表面以及内部结构。从图7a和7b中可以看出,微胶囊主要分为三层:最外层为壳聚糖覆膜,没有芯材;中间层为混合芯材的海藻酸钠-壳聚糖聚电解质膜;而中心为含有芯材的海藻酸钙囊芯。这与之前证明海藻酸钙是以“蛋盒”结构形式存在,药物镶嵌在这种“蛋盒”中,从而实现包埋的结果相一致[24]。相比于空微胶囊,载柚皮苷和柠檬苦素微胶囊在中间层和中心更为饱满,分布比较均匀,说明柚皮苷和柠檬苦素已被完全包覆。从图7c中可以看出,微胶囊表面结构完整,形态较为均一,表面有皱褶,未见裂缝、孔洞和凹陷现象,表明有较高的微胶囊化效率。其表面的典型皱褶是因锐孔法而存在的,微胶囊干燥后,水分脱去而发生缩聚,体积与湿微胶囊相比显著减少,从而导致表面出现皱褶。因此,以上结果表明,柚皮苷/柠檬苦素微胶囊的表面结构和内部结构可较好地保护芯材,解决柚皮苷和柠檬苦素的不稳定性等问题。
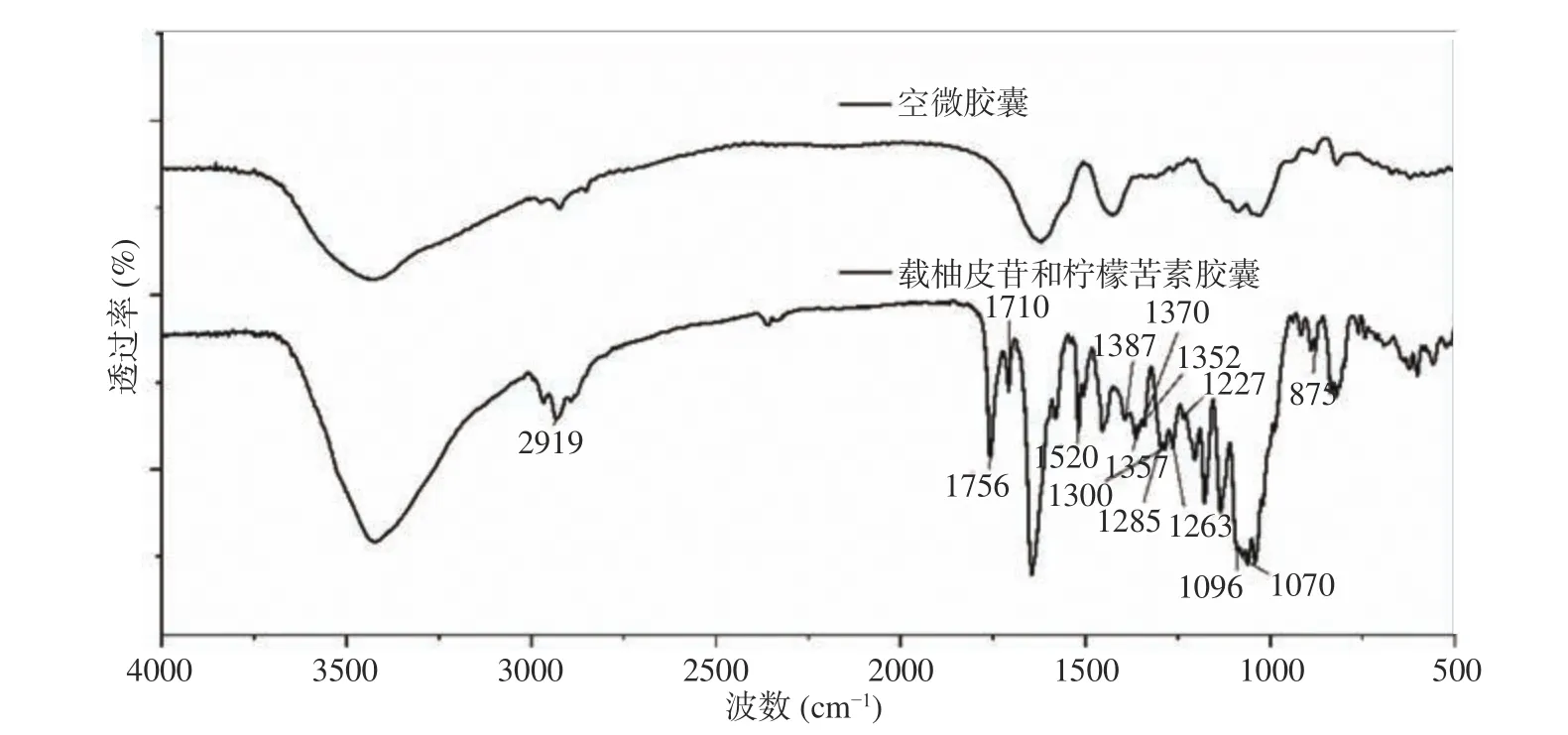
图 6 载柚皮苷和柠檬苦素/空微胶囊的红外光谱图Fig.6 Infrared spectra of naringin and limonin/empty microcapsules

图 7 扫描电镜下干微胶囊的内部结构和表面形态图Fig.7 Internal structure and surface morphology of the dry microcapsule under the scanning electron microscope
2.2.3 包埋前后柚皮苷/柠檬苦素微胶囊热稳定性为了验证柚皮苷/柠檬苦素微胶囊的热稳定性,测定了包埋前后柚皮苷/柠檬苦素微胶囊的保留率,由图8可见,柚皮苷和柠檬苦素具有热不稳定性,样品加热12 h后,柚皮苷和柠檬苦素保留率降为28.5%,而将其制成微胶囊产品,则在相同的热环境下,其保留率高达86.7%,这表明柚皮苷/柠檬苦素微胶囊在高温条件下的稳定性明显高于柚皮苷/柠檬苦素纯品,证实微胶囊化的产品可以改善柚皮苷和柠檬苦素的热不稳定性,与廖霞等[25]研究的海藻酸钠-壳聚糖制备的微胶囊可提高槲皮素稳定性的结果一致。
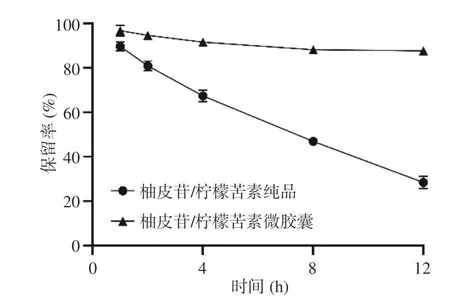
图 8 加热对柚皮苷/柠檬苦素微胶囊的影响Fig.8 Effects of heating on naringin/limonin microcapsules
2.2.4 包埋前后柚皮苷/柠檬苦素的苦味对比 柚皮苷和柠檬苦素经过微胶囊化,与壁材间存在包埋或者聚合作用,降低了与舌根或软颚的接触能力。为了验证微胶囊化降低了柚皮苷和柠檬苦素的苦味,电子舌检验结果见表4,相比于柚皮苷/柠檬苦素纯品,柚皮苷/柠檬苦素微胶囊在10和20 mg/L的苦味强度都显著(P<0.05)降低,可见微胶囊化可有效降低柚皮苷和柠檬苦素的苦味。

表 4 含相同浓度的柚皮苷/柠檬苦素溶液和微胶囊溶液苦味的电子舌测定值Table 4 The relations of sensory value on biterness of Nar/Lim and microcapsule (contain the equal Lim/NAr)
2.2.5 柚皮苷/柠檬苦素微胶囊的体外释放特性 从图9(A)中可以看出,柚皮苷/柠檬苦素微胶囊在模拟胃液中的释放不呈线性关系,在0~90 min,微胶囊内柚皮苷和柠檬苦素的释放较为缓慢;90~200 min柚皮苷和柠檬苦素的释放较快。说明在模拟胃液中90 min后,壁材开始逐渐溶解,控制速率的障碍轻微减少,因此柚皮苷和柠檬苦素穿过囊壁向外扩散的速率稍微增大。而在图9(B)中,可以发现在45 min时微胶囊在人工模拟肠液中的累计释放率已经超过75%。总体来看,微胶囊在人工模拟胃液中释放非常缓慢,经过6 h后总体释放率才达31%左右,而在人工模拟肠液中的释放迅速。这可能是由于微胶囊囊壁的构成与pH有很大的相关性[26]:在pH约为1.2的模拟胃液中,最外层的壳聚糖与H+结合成聚阳离子,从而开始溶解;而囊壁内层的海藻酸凝胶结构稳定,几乎不发生溶胀,阻止了芯材的释放;在pH较高、偏碱性的模拟肠液中,海藻酸凝胶发生溶胀,随着时间的延长,坚固的海藻酸钙溶胀破裂,释放出芯材[27]。此外,黄酮类和三萜类物质吸收和代谢的场所主要是在小肠[28−29],这就意味着柚皮苷和柠檬苦素必须减少在胃中的释放,增加在肠道中的释放才能提高其生物利用率,因此具有pH敏感性的海藻酸凝胶微粒在芯材的释放中发挥了不可或缺的作用。
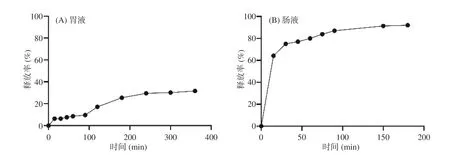
图 9 柚皮苷/柠檬苦素微胶囊在模拟胃液(A)和肠液(B)的释放速率Fig.9 Release rate of naringin/limonin microcapsules in simulated gastric juice(A)and intestinal juice(B)
3 结论
通过单因素实验及响应面试验优化制备柚皮苷/柠檬苦素微胶囊工艺,确定最优工艺参数为:壁芯材比:2.67、壳聚糖质量分数:0.9%,氯化钙质量分数:2.92%,此时包埋率可达88.68%。对构建的二次回归方程进行优化后得到,当壁芯材比8:3、壳聚糖质量分数为0.9%和氯化钙质量分数3%时,柚皮苷/柠檬苦素微胶囊包埋率为88.2%,与理论值相对误差小于5%,说明该工艺准确可靠,可以用于柚皮苷/柠檬苦素微胶囊的生产加工。热稳定性和电子舌结果显示经过海藻酸钠-壳聚糖-氯化钙微胶囊包埋后,柚皮苷/柠檬苦素苦味强度得到有效降低,且显著提高了其稳定性。SEM结果可以直观观察到柚皮苷/柠檬苦素被完整有效的包裹在微胶囊中,FTIR从分子结构上验证了这一结果。此外,微胶囊化的柚皮苷/柠檬苦素有效减少其在胃液中的破坏,提高其在肠液中的缓释能力,促进其在肠道内的生物转化与吸收。表现为在模拟胃液中消化6 h后总体释放率才达31%左右,在模拟肠液中消化45 min时累计释放率已经超过75%。以上研究结论为柚皮苷/柠檬苦素的高值化利用以及在相关食品加工中的稳定性与生物利用提供了理论基础。

