核桃粕多肽的制备及其抗氧化活性研究
弘子姗 解静 张宝娟 代晶晶 陶亮 田洋
摘要以云南大理漾濞核桃粕為原料,提取核桃蛋白,采用7种蛋白酶对核桃蛋白进行单酶水解,以抗氧化能力为指标,对不同酶解产物的抗氧化活性进行酶的优选。在单因素试验的基础上,通过四因素三水平正交试验对酶解工艺进行优化,并验证其酶解产物抗氧化活性。碱性蛋白酶为酶解核桃蛋白的最优选择;核桃蛋白的最佳酶解工艺为加酶量300 U/mL、pH 10、酶解温度50℃、酶解时间3.5 h,在此条件下,多肽得率为80.34%,制备出的多肽具有较强的抗氧化活性。核桃多肽作为良好的天然抗氧化剂有进一步开发利用的潜力,本研究为提升核桃副产物的开发利用提供数据支撑和理论依据。
关键词核桃蛋白;多肽;碱性蛋白酶;工艺优化;抗氧化活性
中图分类号 S664.1 文献标识码 A DOI:10.12008/j.issn.1009-2196.2021.12.008
Preparation of Polypeptides from Walnut Dregs and Their Antioxidant Activity
HONG Zishan1 ,2) XIE Jing2 ,3 ,4) ZHANG Baojuan1) DAI Jingjing1 ,2)TAO Liang1 ,2 ,3 ,4) TIAN Yang1 ,2 ,3 ,4)
(1 College of Food Science and Technology, Yunnan Agricultural University, Kunming, Yunnan 650201, China;
2 National Research Center for Moringa Processing Technology, Kunming, Yunnan 650201, China;
3 Engineering Center for Development and Utilization of Edible and Medicinal Resources, Ministry of Education, Kunming, Yunnan 650201, China;
4 Yunnan Engineering Research Center for Development of Functional Food from Edible and Medicinal Resources, Kunming, Yunnan 650201, China)
Abstract Walnut proteins were extracted from walnut dregs, and hydrolyzed by 7 proteases to select an optimum protease based on the antioxidant activity of different enzymatic hydrolysates with the antioxidant capacity as an indicator. Single factor test was followed by four-factor three-level orthogonal test to optimize the enzymatic hydrolysis process, and the antioxidant activities of the enzymatic hydrolyzed products were then verified. The results showed that alcalase is the best protease for enzymatic hydrolysis of walnut protein. The optimal enzymatic hydrolysis conditions for walnut protein are 300 U·mL-1 , pH value 10, enzymatic hydrolysis temperature 50°C, and enzymatic hydrolysis time 3.5 h. Under these conditions the yield of the polypeptides is 80.34%, and the polypeptides shows strong antioxidant activity. As a natural antioxidant, walnut polypeptides have great potential for furtherdevelopment and utilization. This study provides data and theoretical support for improving the development and utilization of walnut by-products.
Keywords walnut protein ; peptide ; alcalase ; technology optimization ; antioxidant activity
核桃(Juglans regiaL.)又名胡桃、羌桃,為胡桃科胡桃属植物,与扁桃、开心果、榛子并列为世界著名四大干果[1-2],是世界上最古老的坚果,原产于东亚、东南欧和北美[3-4]。核桃有“长寿果”和“养生之宝”的美誉[5],被列入药食同源名单,含有丰富的蛋白质、脂肪、多种氨基酸、糖类物质和微量元素,以及对人体有效的活性物质[6-7],深受消费者青睐。核桃是一种优质的植物蛋白来源[8]。核桃蛋白肽含有较高的营养价值,而且核桃蛋白酶解物还呈现较高的活性,包括抗衰老、预防神经退变、强身补脑、增强记忆力[9]、抗氧化[10]、抗肿瘤[11]、抗炎[12]、降低胆固醇[13-14]、降血压和降低心血管疾病风险[15]等。因此,核桃作为食源性原料具有较高的药用价值和开发前景。
目前,核桃深加工产品主要以生食和粗加工的产品为主,粗加工产品主要以核桃油为主[16],而在核桃油的生产过程中产生大量的下脚料核桃粕,其蛋白质含量较高,品质较优,氨基酸的种类齐全,具有较高的营养价值和相关产品开发的潜力。然而,目前对核桃加工之后产生的副产物资源利用尚不够充分,很多核桃加工企业把核桃粕作为肥料和饲料或丢弃[17]。因此,加强核桃和核桃副产物的深度开发研究对核桃产业的健康可持续发展具有重要意义。
本文以核桃粕为原料,提取核桃蛋白,采用7种蛋白酶对核桃蛋白进行单酶水解,以 ABTS 自由基清除能力、铁离子还原能力( FARP)、 DPPH 自由基清除能力、羟基自由基清除能力为指标,对不同酶解产物的抗氧化活性进行酶的优选。在单因素试验的基础上,以酶解温度、酶解时间、酶添加量、pH 为自变量,通过四因素三水平正交试验对酶解工艺进行优化,制备高抗氧化活性核桃多肽,以期为提升核桃粕的深度开发提供理论依据。
1材料与方法
1.1材料
1.1.1试材
核桃粕,大理云上普瑞农业有限责任公司;碱性蛋白酶(20万 U/g)、胰蛋白酶(25万 U/g)、胃蛋白酶(30万 U/g)、木瓜蛋白酶(8万 U/g)、风味蛋白酶(3万 U/g)、糜蛋白酶(10万 U/g)、中性蛋白酶(5万 U/g),索莱宝科技有限公司; DPPH,索莱宝科技有限公司;TPTZ,阿拉丁试剂有限公司; ABTS,美国 Sigma公司;无水乙醇、过硫酸钾、乙酸钠、氢氧化钠、盐酸、三氯化铁等均为分析纯。
1.1.2仪器与设备
DFT-100型手提式高速中药粉碎机,温岭市林大机械有限公司; TDL-5-A型离心机,上海安亭科学仪器厂;FD-1A-50型冷冻干燥机,上海比朗仪器制造有限公司;80-2型离心机,上海安亭科学仪器厂;UV-1800型紫外可见分光光度计,上海翱艺仪器有限公司;Bio-Tek Synergy H4全功能酶标仪,美国伯腾仪器。
1.2方法
1.2.1核桃蛋白的提取
取500 g核桃粕通过粉碎机磨碎,加入1 L石油醚浸泡脱脂,3 000 r/min 离心10 min,回收石油醚,将脱脂核桃蛋白粉放通风橱中干燥。将脱脂蛋白粉以1∶15( W/V)的比例分散在 NaOH 溶液(pH 9.0)中,并在45℃搅拌1 h 萃取。用1 mol/L 的 HCl 调节上清液 pH 至4.5后, 4000 r/min 离心20 min获得沉淀物冷冻干燥,并保存在-20℃中。
1.2.2酶法制备核桃多肽
1.2.2.1蛋白酶筛选
将核桃蛋白以5%的浓度溶于蒸馏水中,100℃沸水浴15 min,用 NaOH、HCl调节最适 pH,加入酶在最适温度水解4 h,根据表1不同蛋白酶最适条件进行酶解。然后在100℃的沸水浴中加热15 min 使酶失活,上清液调至中性,将样品以4000 r/min 离心15 min,然后将上清液冷冻干燥,测定抗氧化活性。
1.2.2.2单因素试验
选择抗氧化活性最优的蛋白酶进行优化,以多肽得率为评价指标,考察加酶量(200、250、300、350、400 U/mL)、酶解 pH (7.0、8.0、9.0、10、11)、酶解温度(45、50、55、60、65℃)、酶解时间(2、3、4、5、6 h)对多肽得率的影响,固定底物浓度为1 mg/mL,确定核桃多肽水解的最佳因素水平。
1.2.2.3正交设计
根据单因素实验结果确定各因素的合理水平,详见表2。选用 L9(34)正交表安排实验。
1.2.3多肽得率的测定
采用比色法[18-19]测定多肽得率,用 10%的三氯乙酸( TCA)依次配制0.0、0.2、0.4、0.8、1.0、1.2、1.4 mg/mL 的Gly-Gly-Tyr-Arg 四肽标准溶液,然后分别取2 mL 标准溶液、加入8 mL 双缩脲试剂,混合均匀,静置30 min,取上清液于540 nm 下测定 OD值。以肽浓度为横坐标 X(mg/mL), OD值为纵坐标 Y,制作标准曲线。标准曲线为 y=0.0346 x+0.0012,R?=0.9923。
取2 mL 样品溶液,加入2 mL 10%( W/V)的三氯乙酸( TCA)溶液,混匀静置30 min 后,再于4000 r/min离心15 min,取上清液2 mL,加入双缩脲试剂8 mL,室温下静置30min,于540 nm 下测定OD值,对照标准曲线求得样品溶液中的多肽浓度 c (mg/mL),可求得样品中多肽含量。
1.2.4抗氧化活性测定
对样品溶液进行 DPPH 自由基清除能力[20]、 ABTS 自由基清除能力[21]、FRAP测定[22]、羟基自由基清除能力[23]进行测定以评价其抗氧化活性。
1.2.5数据处理
利用 Excel 2010对数据进行整理分析,采用正交助手3.1进行正交分析,利用 SPSS 19.0进行方差显著性分析,利用Graghpad Prism 6.0进行做图。所有实验重复3次以上,计算平均值,结果以(平均值±标准误)表示。
2结果与分析
2.1最适蛋白酶的选择
常用的核桃蛋白水解酶有胃蛋白酶[24]、胰蛋白酶[25]、碱性蛋白酶[26]、木瓜蛋白酶[27]、中性蛋白酶[28]、糜蛋白酶[29]、风味蛋白酶等。酶作为具有生理活性的特殊蛋白,具有不同的活化中心和水解特异性。同一种蛋白质可以选择不同的蛋白酶进行水解,水解效果不同,所制备出来的多肽抗氧化能力强弱也不同。以 ABTS 自由基清除能力、铁离子还原能力( FARP)、 DPPH 自由基清除能力、羟基自由基清除能力为指标,对不同酶解产物的抗氧化活性进行酶的优选。
7种蛋白酶酶解物的抗氧化能力如图1所示。在同等浓度下,碱性蛋白酶、木瓜蛋白酶和胰蛋白酶 DPPH 自由基清除能力最强(p<0.05),其次为糜蛋白酶、中性蛋白酶和胃蛋白酶,风味蛋白酶最弱。碱性蛋白酶 ABTS 自由基清除能力最强(p <0.05),不同酶解物 ABTS 自由基清除能力强弱依次为碱性蛋白酶>糜蛋白酶>木瓜蛋白酶>中性蛋白酶>胰蛋白酶>胃蛋白酶>风味蛋白酶。木瓜蛋白酶和碱性蛋白酶铁离子还原能力最强(p<0.05),其次为糜蛋白酶,中性蛋白酶最弱。不同酶解物羟基自由基清除能力为胰蛋白酶>碱性蛋白酶>木瓜蛋白酶>糜蛋白酶>中性蛋白酶>胃蛋白酶>风味蛋白酶。总体来看,胰蛋白酶和碱性蛋白酶羟基自由基清除能力较强,显著高于其他蛋白酶(p<0.05)。
总体而言,碱性蛋白酶表现出较强的抗氧化能力。因此,选择碱性蛋白酶作为后续酶解的蛋白酶。
2.2酶解工艺优化
2.2.1加酶量对多肽得率的影响
由图2可知,多肽得率随着酶添加量的增加呈现先急剧上升后趋于平缓的趋势。当加酶量达到300 U/mL 时,多肽得率达到(74.95±1.24)%,而后继续增加蛋白酶量,多肽得率变化差异不显著。原因可能是当加酶量达到300 U/mL 时,蛋白底物已充分被酶水解,此时再增加相应蛋白酶,多肽得率不变。考虑酶解消耗成本等因素,确定加酶量为300 U/mL。
2.2.2 pH 对多肽得率的影响
如图3所示,随着酶解 pH 的增加,多肽得率呈现出先上升后下降的趋势。当酶解 pH 达到10时,核桃蛋白的多肽得率达到最大值,为(75.64±1.73)%,差异显著;当酶解 pH继续上升至11时,多肽得率反而下降。因此,选用 pH 为10为碱性蛋白酶水解核桃蛋白最优的酶解 pH。
2.2.3酶解时间对多肽得率的影响
由图4可知,多肽得率随着酶解时间的增长,整体上呈先急剧上升后平缓上升的趋势。当酶解时间为4 h 时,多肽得率达到(75.93±0.79)%,继续延长酶解时间,多肽得率虽呈增加趋势,但差异不显著。因此,酶解4 h 为碱性蛋白酶水解核桃蛋白最优的酶解时间。
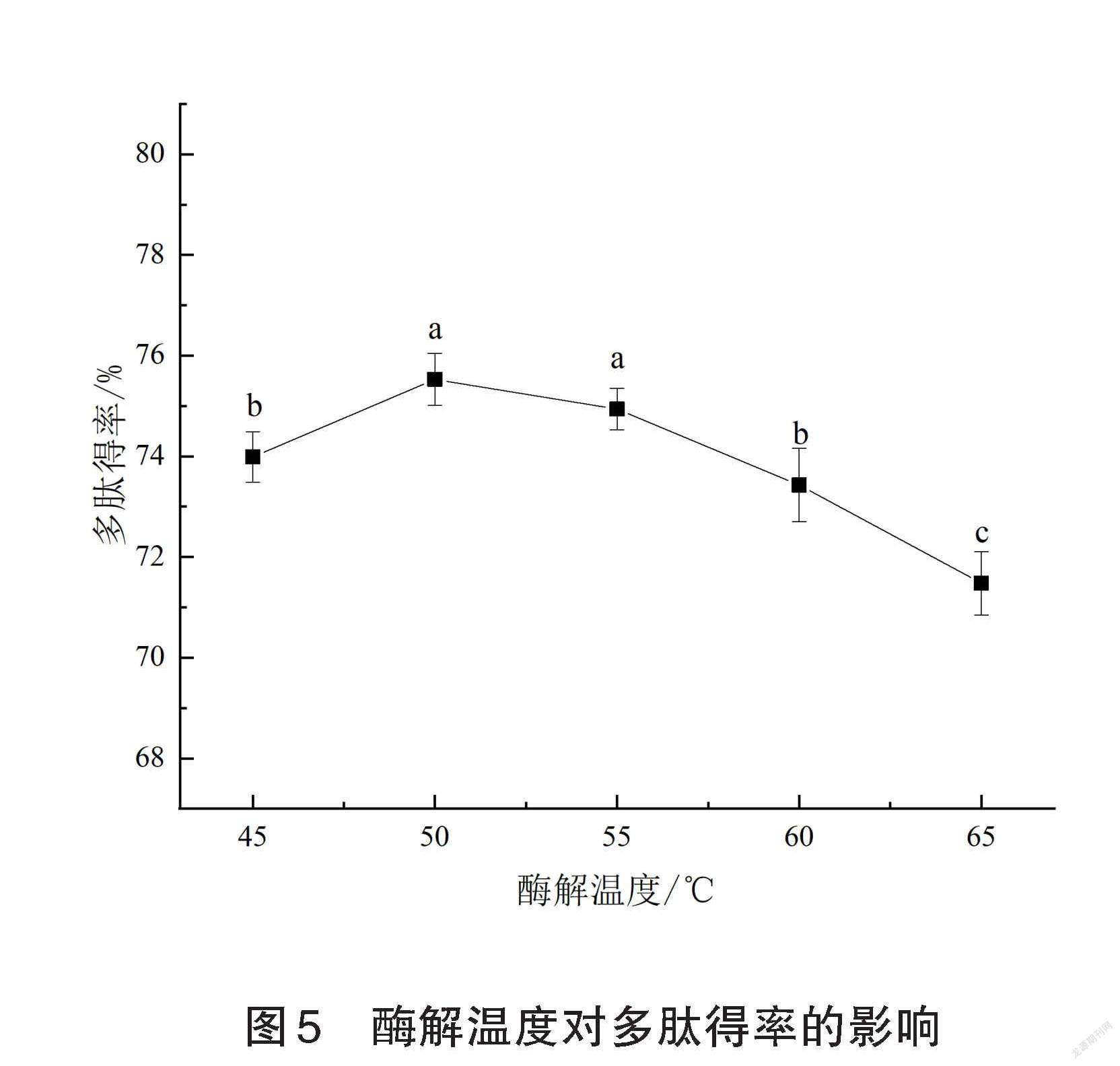
2.2.4酶解温度对多肽得率的影响
由图5可知,随着酶解温度的升高,核桃蛋白的多肽得率呈先上升后下降的趋势,且当酶解温度为50℃时,多肽得率达到了最大值(75.53±0.52)%,此后,随着温度的升高,多肽得率反而下降。因此,选擇酶解温度为50℃。
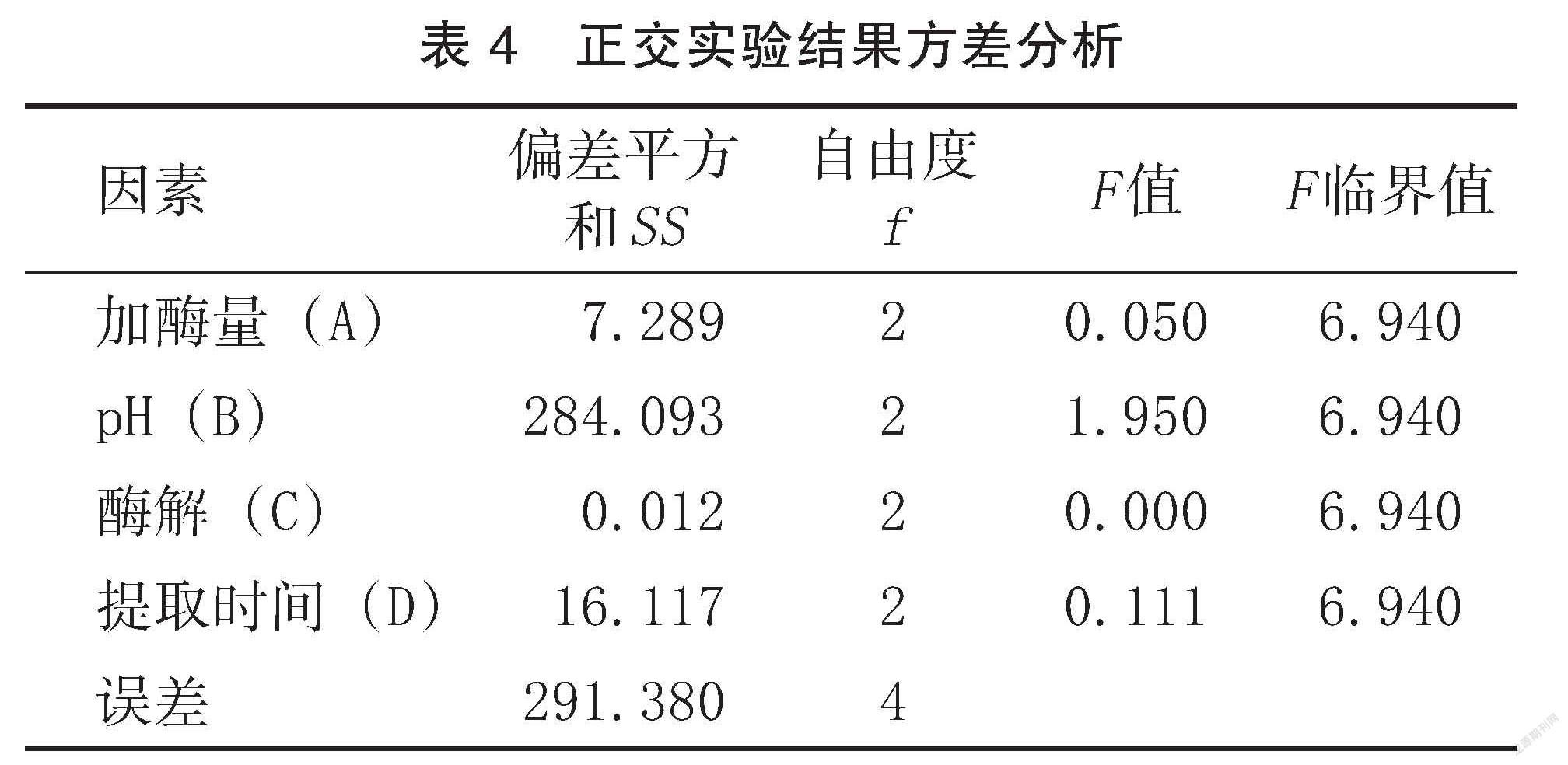
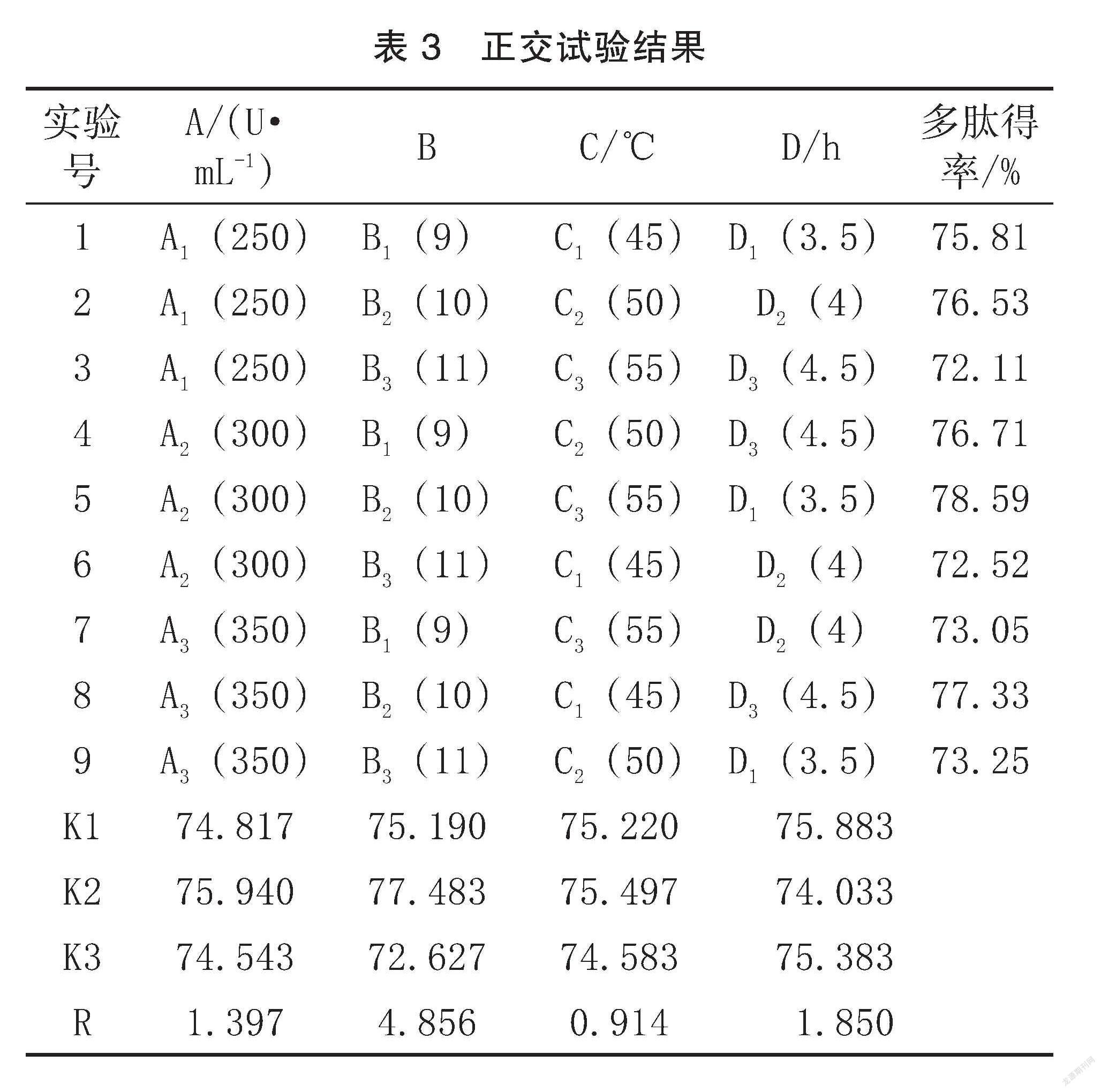
2.3正交实验分析结果
根据单因素实验结果,以多肽得率为优化指标,选取加酶量( A)、 pH ( B)、酶解温度(C)和酶解时间(D)进行四因素三水平 L9(34)正交优化试验来确定最佳提取参数,结果见表3,并对多肽得率进行方差分析和显著性检验,结果如表4所示。
由表3可知,各实验因素对多肽得率的影响表现出一定的差异性。影响多肽得率的因素主次为 B >D>A>C,即 pH 为本实验的主要影响因素,酶解时间次之,加酶量对多肽得率的影响相对较少,酶解温度的影响最小。最终得出,核桃多肽提取的最佳工艺条件为 A2B2C3D1,即加酶量300 U/mL、pH 10、酶解温度55℃、酶解时间3.5 h,在此条件下进行3次验证实验。结果多肽的得率为(80.34±1.36)%,与优化前的多肽得率相比有明显的提高,说明该组参数为最优的工艺条件。
2.4核桃抗氧化肽的抗氧化活性评价
2.4.1核桃抗氧化肽 DPPH 自由基清除能力
由图6可知,样品表现出一定的 DPPH 自由基清除活性,且活性随着样品浓度水平的提高而显著上升。当样品质量浓度达到0.5 g/mL 时,核桃抗氧化肽的 DPPH 自由基清除能力达到(87.21±2.07)%,在相同浓度下,阳性对照抗坏血酸的清除率达(94.11±1.36)%。
2.4.2核桃抗氧化肽 ABTS 自由基清除能力
以抗坏血酸作阳性对照,样品浓度与核桃抗氧化肽 ABTS 自由基清除能力的变化情况如图7。由图7可知,抗坏血酸和核桃抗氧化肽的 DPPH 自由基清除能力随着样品浓度的增加而上升,且差异显著,当样品浓度达到0.5 g/mL 时,抗坏血酸 ABTS 自由基清除能力为(97.33±1.84)%;核桃抗氧化肽的 ABTS 自由基清除能力为( 84.2±1.31)%。
2.4.3核桃抗氧化肽羟基自由基清除能力
以抗坏血酸作阳性对照,样品浓度与核桃抗氧化肽羟基自由基清除能力的变化情况如图8。由图8可知,抗坏血酸和核桃抗氧化肽的羟基自由基清除能力随着样品浓度的增加而上升,当样品浓度达到0.5 g/mL 时,抗坏血酸羟基自由基清除能力为(98±2.5)%;核桃抗氧化肽的羟基自由基清除能力为(82.2±2.2)%。
2.4.4核桃抗氧化肽 Fe3+還原能力
样品浓度与核桃抗氧化肽 Fe3+还原能力的变化情况如图9。由图9可知,抗坏血酸和核桃抗氧化肽的 Fe3+还原能力随着样品浓度的增加而上升,当样品浓度达到0.5 g/mL 时,抗坏血酸 Fe3+还原能力为( 53.18±3.26)%;核桃抗氧化肽的 Fe3+还原能力为(44.74±4.24)%。
3结论
本实验利用酶解法提取核桃多肽,探索其多肽的抗氧化活性,筛选出碱性蛋白酶为最适工具酶,通过单因素正交试验确定核桃蛋白最佳酶解条件为:加酶量300 U/mL、pH 10、酶解温度50℃、酶解时间3.5 h,在此条件下多肽的得率为80.34%,制备出的多肽 DPPH、ABTS、羟基自由基清除率、铁离子还原能力达( 87.21±2.07)%、(84.20±1.31)%、(82.20±2.20)%、(44.74±4.24)%,表明核桃多肽抗氧化效果显著,具有较高的开发潜力。
参考文献
[1] Marcela L M,Labuckas D O,Lamarque A L, et al. Walnut (Juglans regia L.): genetic resources, chemistry, by-products.[J]. Journal of the ence of Food & Agriculture, 2010, 90(12):1959-1967.
[2] José A P, Oliveira I, Sousa A, et al. Bioactive properties and chemical composition of six walnut (Juglans regia L.) cultivars [J]. Food & Chem ‐ical Toxicology, 2008, 46(6):2103-2111.
[3] María I T,Juan R S M,Jesús G P ,et al. Compara‐tive study of the nutritional and bioactive com ‐ pounds content of four walnut (Juglans regia L.) cultivars [J]. Journal of Food Composition and Analysis,2013,31(2):321-325.
[4] Labuckas D O,Damián M Maestri, Milton P, et al. Phenolics from walnut (Juglans regia L.) kernels: Antioxidant activity and interactions with proteins [J]. Food Chemistry, 2008, 107(2):607-612.
[5] Bhargava U C, Westfall B A. Antitumor activity of Juglans nigra (black walnut) extractives [J]. Journal of Pharmaceutical ences, 2010, 57(10):1674-1677.
[6]潘学军,张文娥,李琴琴,等.核桃感官和营养品质的主成分及聚类分析[J].食品科学, 2013, 34(8):195-198.
[7] Politi A,Durdagi S,Moutevelis-Minakakis P, et al. Application of 3D QSAR CoMFA/CoMSIA and in silico docking studies on novel renin inhibitors against cardiovascular diseases [J]. European Journal of Medicinal Chemistry, 2009, 44(9):3703-3711.
[8] Masako I, Masao S, Misaki K, et al. Walnuts lower serum cholesterol in Japanese men and women.[J]. Journal of Nutrition, 130(2):171-176.
[9] Tapsell L C, Gillen L J, Patch C S, et al. In ‐cluding walnuts in a low-fat/modified-fat diet improves HDL cholesterol-to-total cholesterol ratios in patients with type 2 diabetess [J]. Diabetes Care., 2004, 27(12):2777-2783.
[10] Kris-Etherton P M Walnuts decrease risk of car ‐diovascular disease: a summary of efficacy and biologic mechanisms.[J]. Journal of Nutri ‐tion, 2014, 144(4):547S.
[11] Rabadán, Adrián, Pardo J E, R Gómez, et al. Evaluation of physical parameters of walnut and walnut products obtained by cold pressing [J]. LWT, 2018:308-314.
[12] Gu M , Chen H P , Zhao M M, et al. Identifica‐tion of antioxidant peptides released from de ‐ fatted walnut (Juglans Sigillata Dode) meal proteins with pancreatin [J]. LWT - Food Sci ‐ence and Technology, 2015, 60(1):213-220.
[13] Kar Wai Clara Sze ㏕ao, Sathe S K . Walnuts (Juglans regia L): proximate composition, protein solubility, protein amino acid compo ‐sition and protein in vitro digestibility [J]. Journal of the science of Food and Agriculture,2000, 80(9):1393–1401.
[14] Consultation J W E . Protein and amino acid re ‐quirements in human nutrition.[J]. World Health Organization Technical Report, 2007(935):1.
[15]张有林,原双进,王小纪,等.基于中国核桃发展战略的核桃加工业的分析与思考[J].农业工程学报,2015,31(21):1-8.
[16]代佳和,田洋,杨舒雯,等.云南省核桃产业发展现状及对策[J].农产品加工,2019(2):78-82+85.[17]沈大战,黄均,周荣清.全细胞固态发酵制备蚕蛹多肽工艺及抗氧化性研究[J].食品研究与开发,2021,42(12):157-162.
[18] Bo-Bae, Koh,Eun-Jung, et al. Characteriza‐tion of bovine serum albumin hydrolysates pre ‐ pared by subcritical water processing.[J]. FOOD CHEMISTRY, 2019.
[19] Brand-Williams W,Cuvelier M E,Berset C. Use of a free radical method to evaluate antioxidant activity [J]. LWT-Food science and Technolo‐gy, 1995, 28(1): 25-30.
[20] Arnao M B, Cano A, Acosta M. The hydrophilic and lipophilic contribution to total antioxi‐dant activity [J]. Food Chemistry, 2001, 73(2):239-244.
[21] Ou B, Huang D,Hampsch-Woodill M, et al. Analysis of antioxidant activities of common vegetables employing oxygen radical absorbance capacity ( ORAC) and ferric reducing antioxi‐dant power ( FRAP) assays: a comparative study [J]. Journal of agricultural and food chemis‐ try, 2002, 50(11): 3122-3128.
[22] Yaz S Z . Optimization of all extraction process for phenolic compounds with maximum antioxidant activity from extract of Taraxacum assemanii by statistical strategies [J]. Journal of Food Measurement and Characterization,2021:1-15.
[23] Li T,Wu C, Liao J, et al. Application of Protein Hydrolysates from defatted walnut meal in high-Gravity brewing to improve fermentation performance of lager yeast [J]. Applied Bio ‐ chemistry and Biotechnology,2020,190(1).
[24] Fei Z,Daofang Z,Xiangyang L, et al. High- Pressure Homogenization Pretreatment before En‐zymolysis of Soy Protein Isolate: the Effect of Pressure Level on Aggregation and Structural Conformations of the Protein [J]. Molecules,2018, 23(7):1775.
[25] Huicui, Zhang, Lina, et al. Optimization of a microwave-Coupled ynzymaticyigestion process to prepare peanut peptides [J]. Molecules,2012, 17(5):5661.
[26] Fang S,Ruan G, Hao J, et al. Characteriza‐tion and antioxidant properties of manchurian walnut meal hydrolysates after calcium chelation[J]. LWT,2020, 130:109632.
[27] Ren D, Zhao F, Liu C, et al. Antioxidant hy‐drolyzed peptides from Manchurian walnut (Jug ‐lansmandshurica Maxim.) attenuate scopolamine‐ induced memory impairment in mice [J]. Jour ‐nal of the Ence of Food and Agriculture, 2018,98:5142-5152.
[28]楊玉蓉,李安平,钟政昌,等.桃仁多肽螯合亚铁的抑菌活性及结构表征[J].食品科学, 2019, 40(5):57-62.
(编辑排版:龙娅丽)

