塞尼卡病毒A在BHK-21细胞中培养条件探索
陈丽萍 兆丰华生物科技(福州)有限公司 福州 350014
塞尼卡病毒A(Senecavirus A,SVA),原名塞尼卡谷病毒(Seneca valley virus,SVV)是引发猪原发性水疱病(PIVD)的主要原因,可导致感染猪的鼻吻、蹄冠部出现水疱性病变,新生仔猪死亡。近年来,SVA已经波及美国、加拿大、巴西、泰国、中国等,危害养猪业健康发展[1-6]。目前,国内外仍没有可以推广使用的商品化SVA疫苗,疫苗制备方法的报道最早出自中国农业科学院兰州兽医研究所[7]。本文通过试验从接种方法、细胞浓度、血清含量及收毒时间等因素对SVA在BHK-21细胞中培养的影响,从而了解SVA在BHK-21细胞中增殖的最适条件,为疫苗生产提供数据参考。
1 试验材料
1.1 仪器设备 细胞培养瓶,CO2培养箱,倒置显微镜,恒温水浴锅,96孔板。
1.2 试验试剂MEM培养基(购自Gibco),新生牛血清(购自润生生物),BHK-21细胞,SVA(公司自主分离毒株),胰酶-EDTA溶液(自配)。
2 试验方法
2.1 两种接种方法对比试验 用MEM培养基(含8%新生牛血清)作为BHK-21细胞的营养液,按常规方法培养细胞[8]。将长满致密单层的BHK-21细胞用胰酶-EDTA消化传代(比例为1:3),随机将细胞分成2组,一组同步接种1% SVA;另一组待细胞生长约90%时,弃去营养液,异步接种1% SVA,加入MEM维持液(含2%新生牛血清);设健康细胞作对照。接毒后细胞放37℃、5% CO2培养箱中培养。培养12 h后每3 h观察一次,18 h后每3 h、每组随机收获2瓶,直至30 h,收获后反复冻融2次,测定TCID50。
2.2 不同细胞浓度培养同时收获对比试验 将长满致密单层的BHK-21细胞消化后,按1:2、1:3、1:4和1:5的比例稀释传代,待细胞生长至90%时,弃去营养液,加入MEM维持液,接种1%SVA;设健康细胞作对照。接毒24 h后同时收获细胞,反复冻融2次后测定TCID50。
2.3 不同细胞浓度相同病变程度收获病毒对比试验 按2.2中的条件培养SVA,当CPE达80%以上时收获细胞,反复冻融2次后测定TCID50。
2.4 不同时间收获对SVA增殖的影响 将长满致密单层的BHK-21细胞消化后,按1:3、1:4比例传代,每组18瓶,待细胞生长约90%时,弃去营养液,加入MEM维持液,接种1%SVA;设健康细胞作对照。从15 h起每3 h、每组随机收获2瓶观察病变情况,观察至39 h。反复冻融2次,测定TCID50。
2.5 不同血清含量培养的细胞接种SVA比较试验将长满致密单层的BHK-21细胞消化后,按1:3、1:4比例传代,分别用血清含量为5%、8%、10%的MEM培养,细胞生长至90%时,弃去营养液,加入MEM维持液,接种1%SVA;设健康细胞作对照。当CPE达80%以上收获病毒,反复冻融2次后测定TCID50。
2.6病毒TCID50测定 将BHK-21细胞按一定比例消化后铺于96孔板中,0.1 mL/孔,放CO2培养箱中培养24 h后接毒。将待检病毒液进行10倍倍比稀释,取10-7、10-8、10-9三个稀释度分别接种到培养板,每个稀释度6孔,0.1 mL/孔;设6孔无病毒空白对照,加入MEM维持液,0.1 mL/孔,置于37℃、5%CO2培养箱中培养,每天观察并记录每孔细胞的CPE,采用Reed-Muench法计算TCID50。
3 结 果
3.1 两种接种方法对SVA的影响 从病变来看,异步接毒在接毒15 h病变较轻,18 h病变明显,24 h病变达80%以上;同步接毒在接毒15 h病变已经很明显,18 h大量细胞已经脱落,病变达80%以上。可见,异步接毒收获病毒液的TCID50明显比同步接种的高(见图1)。

图1 两种接种方法对比试验结果
3.2 不同细胞浓度同时收获对SVA增殖的影响细胞接种SVA后,培养24 h同时收获病毒。由图2可见,1:2、1:3比例传代时,收获病毒液的TCID50都相对较高;1:4、1:5比例传代时,收获病毒液的TCID50都相对较低。1:3比例传代细胞培养的病毒液的TCID50最高。
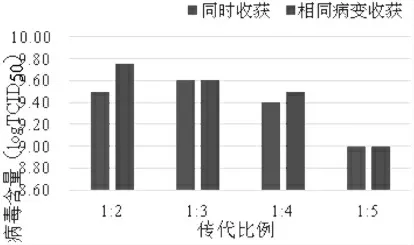
图2 不同细胞浓度对SVA增殖的影响
3.3 不同细胞浓度相同病变收获对SVA增殖的影响 细胞以不同比例传代后接种病毒,从CPE来看,1:5比例传代时最早出现病变,接种后18 h CPE已达80%以上;1:4比例传代时,接种后21 h CPE已达80%以上;1:3比例传代时,则在接种后24 h CPE达80%以上;1:2比例传代时,30 h CPE达到80%以上。从图2可见,1:5比例传代时,收获病毒液的TCID50都相对较低,1:2、1:3、1:4比例传代细胞培养的病毒液的TCID50都比较高。
3.4 不同时间收获对SVA增殖的影响 从CPE来看,1:4传代时,接毒后15 h已经出现明显病变,21 h、24 h CPE达80%以上,33 h细胞大部分都已脱落;1:3传代时,接毒后18 h出现明显病变,24 h、27 h CPE达80%以上,36 h细胞大部分都已脱落。由图3可见,1:4传代时,在CPE达80%以上且TCID50最高的时间段为21~27 h;1:3传 代 时,CPE达80%以上且TCID50最高的时间段为24~30 h。
图3 不同收获时间对SVA增殖的影响
3.5 不同血清含量培养的细胞对SVA增殖的影响从图4可知,传代比例为1:4时,8%血清培养病毒液的TCID50最高;传代比例为1:3时,8%、10%血清培养病毒液的TCID50都比较高,血清含量增加收获病毒液的TCID50也增加。总的来说,培养液的营养水平与收获病毒液的TCID50呈正相关。

图4 不同血清含量比对试验
4 讨 论
体外培养细胞增殖病毒时,接种时间是病毒增殖效果的重要因素[8-9]。本试验将SVA以不同接种方法接种BHK-21细胞,结果表明异步接毒收获病毒液的TCID50高于同步接毒收获病毒液。细胞浓度会影响病毒的繁殖,从而影响收获病毒的TCID50。以1:5传代的细胞,培养病毒的含量较低,而细胞传代比例为1:2~1:4的,培养病毒的含量较高,而1:2传代影响生产效率且成本高,整体来看,1:3比例传代培养SVA病毒,效价较高。
营养液中的血清含量不仅是培养液营养水平的重要体现,还对细胞生长、病毒增殖至关重要。营养水平会影响细胞的长速、周期、状态,从而影响病毒增殖。试验结果显示,采用5%血清培养,病毒含量都偏低,用8%、10%血清培养,TCID50都比较高,但考虑到血清成本较高,用8%血清含量比较适宜。
病毒的收获时间是病毒液能否在TCID50高点收获的关键因素,直接影响病毒的效价。试验结果显示,同等条件下,CPE达80%以上时收获病毒液的TCID50高于接种病毒后24 h同时收获病毒液的TCID50。
因此,根据对SVA培养试验结果,SVA在BHK-21细胞上的适宜培养条件为细胞1:3比例传代、添加8%新生牛血清培养,待细胞生长至90%比例时接种SVA,接种后培养至CPE达到80%以上收获病毒。

