树突状细胞介导心肌梗死大鼠特异性细胞免疫对心室功能改善的作用
王永杰,方小丽,刘仕强,王杰,陈旭,汪华,何文武
急性心肌梗死(AMI)是因冠状动脉(冠脉)供血急剧减少或中断,使相应心肌严重而持久缺血导致心肌坏死的一类心血管系统疾病。该病常并发心律失常、休克或心力衰竭(心衰),直接危及生命。近年来再灌注及尖端疗法水平进一步提高,但据统计AMI后心衰所致死亡率呈逐年上升趋势[1]。研究指出,其原因主要为AMI发病后心室功能受损引起心室重塑,心脏大小、形状及功能均发生改建[2]。临床证实,心室重塑发病机制较复杂,可能与AMI诱导的炎症反应、免疫机制等有关[3]。相关动物实验对AMI大鼠体内获得性免疫细胞CD4+T细胞和CD8+T细胞进行研究发现,其在AMI大鼠心脏中呈高表达,且与心肌细胞损伤密切相关[4]。另相关临床病例指出,AMI患者体内可检测到各种心肌抗原及抗体,其中树突状细胞(DC)对介导心肌损伤和患者预后价值最高,提示AMI后机体产生的特异性免疫应答在维持免疫应答稳态上有重要价值[5]。以上研究验证了DC对AMI后心脏重塑及功能有一定影响,但参考文献发现目前仍未明确其对炎症及心室重塑的作用机制。因此,本研究深入观察DC对AMI大鼠炎症反应、心室重塑及功能的影响及作用机制,旨在为AMI后改善心室重塑提供具有临床价值的信息。
1 材料与方法
1.1 一般材料购自北京医疗器械检验所(动物实验中心)清洁级雄性大鼠24只,构建AMI手术模型;动物使用和处理符合中华人民共和国国家卫生研究院实验动物保护法和使用指导要求,且通过医学动物伦理委员会批准。所有大鼠体重2.40~3.20 kg,平均(2.62±0.33)kg;饲养3~5个月,平均(4.18±0.10)个月;单笼饲养7 d;常规全面心脏检查排除心血管其他疾患。随机将建模成功后的大鼠随机分成A、B、C组,每组各8只,A组为假手术大鼠、B组为AMI大鼠、C组为接受DC干预的AMI大鼠。每组4只用于DC、血流动力学、和炎性因子检测,另四只用于HE染色检测细胞炎性浸润、细胞凋亡及心肌梗死情况。入选病例的随机化分组方法:①编号,按体重由轻到重顺序编为:01、02、03、04……19、20、21、22、23、24;②抄随机数,从随机数表第一行第一个数字开始,横向依次抄录24个随机数并依次除以3写下余数;③随机数编号,按余数0、1、2从小到大编秩;④归组,秩次为0编入A组(空白对照健康大鼠);秩次为1编入B组(AMI大鼠),2编入C组(接受DC干预的AMI大鼠)。
1.2 方法建模:检查心脏情况排除心血管其他疾患,注射盐酸戊巴比妥钠(湖北鸿运隆生物科技有限公司)麻醉大鼠,剂量为30 mg/kg;做好辅助通气,连接心电监护;胸骨左侧3~4肋间处剪开皮肤,逐层钝性分离暴露心脏,无齿小镊剥离心包,暴露左室前壁;用6~0带线缝和针结扎左冠状动脉前降支走形处,以ST段弓背上抬心电图为AMI;逐层缝合胸腔,待恢复自主呼吸撤离呼吸机;术后青霉素抗感染治疗3 d,剂量10万U/kg·d。A组(假手术大鼠)其他步骤与B、C组一样,但未接受冠状动脉左前降支结扎。过程中死亡大鼠用无差异的存活大鼠补充,确保三组各8只大鼠。给药:建模成功后30 min分别给A组大鼠经腹股沟淋巴结附近皮下注射PBS溶液2 μl,B组大鼠注射1×106个的成熟树突状细胞(mDC)溶液2 μl,C组注射含1×106个DC溶液2 μl。溶液均购自迈瑞生物科技有限公司,配制和使用由五年临床经验的专科医师参考说明书严格执行。术后:其中四只采用VINNO动物超声心动仪(美国GE生物科技有限公司)检测血流动力学指标,评估心室扩张及功能;另外四只大鼠给药24 h后以80 mg/kg剂量的戊巴比妥钠深度麻醉大鼠,断头处死并获取心脏,行常规HE染色和免疫组织化学染色,采用流式细胞术分析DC表达水平,免疫组化法检测DC浸润情况。
1.3 免疫组化法选择大小适宜的蜡块,蜡块取出后放在冰袋上冷敷0.5 h后连续切片5张,厚度为4 μm,贴于玻片60℃烘烤1 h,使组织紧贴与玻片,置于4℃冰箱保存备用;随机选择4个正常组织蜡块连续切片4张进行预实验,确定抗体工作浓度。将切片取出后经二甲苯溶液脱蜡,分别在100%(Ⅰ)、100%(Ⅱ)、95%(Ⅰ)、95%(Ⅱ)、80%、70%乙醇溶液中水化,1×PBS溶液冲洗3次,每次5 min;置于3%过氧化氢溶液中浸泡0.5 h,以达到灭活内源性过氧化物酶的作用,蒸馏水冲洗5 min,1×PBS溶液冲洗3次,5 min/次;将切片置于耐高温染色架上,放入含200 ml DC抗原修复液的容器中,高压锅加热,记录开始时间为加热至喷气时,2 min后移开高压锅,冷水冲洗直至恢复室温,1×PBS溶液冲洗3次,5 min/次;用滤纸吸去玻片上残留的PBS溶液,将10%正常血清滴加在玻片上,置于湿盒中室温反应30 min,中和非特异性反应;弃去多余血清,将DC一抗和1×PBS溶液以200:1比例混合后滴加至玻片上,置于湿盒中4℃过夜;将玻片取出室温下复温30 min,1×PBS溶液冲洗3次,5 min/次;用滤纸吸去玻片上残留的PBS溶液,滴加生物素化二抗,湿盒中孵育20 min,1×PBS溶液冲洗3次,5 min/次;加入辣根酶标记链霉卵白素,湿盒中孵育20 min,1×PBS溶液冲洗3次,5 min/次;将配制好的DAB底物工作液滴加至玻片上,室温下显微镜观察显色情况,以自来水终止显色反应;利用苏木素溶液复染3 min,自来水冲洗5 min,1%盐酸酒精分化5 s,自来水冲洗5 min;分别在80%、95%(Ⅰ)、95%(Ⅱ)、100%(Ⅰ)、100%(Ⅱ)乙醇溶液中脱水,利用二甲苯溶液透明,中性树胶固定;将已知的阳性切片作为阳性对照,与待检组织切片结果对比,排除假阳性;0.01 mmol/L的PBS溶液代替试验中一抗作为阴性对照,增加试验结果的可靠性;显微镜下观察染色情况,每张切片400×视野下随机选取5个视野,计算总阳性细胞比例计分。
染色标准:①切片完整,厚度4~6 μm,厚薄均匀,无皱褶无刀痕;②染色核浆分明,红蓝适度,透明洁净,封裱美观。由两位5年以上从事HE染色实验的临床专业医师在对临床病理资料不知情情况下进行判断常规HE染色下各细胞阳性表达情况。
染色判定标准:依据阳性细胞染色程度和所占比例进行评分:无色:0分,浅色:1分,正常:2分,深色:3分;阴性(-):细胞结构清晰无显色,弱阳性(+):染色1-2分,阳性(++):染色2-3分,强阳性(+++):≥4分。
1.4 观察指标①DC表达水平:采用MACSTM分离器(美国GE公司)分离组织中细胞,密度梯度离心法进一步分离白细胞,流式细胞术分析DC表达水平。②血流动力学指标:分别记录各组心率(HR)、左心室(LV)、左室收缩末期压力(LVSP)、左室舒张末期压力(LVEDP)、左室压力最大上升速率(LV+Dp/dtmax)、左室压力最小下降速率(LV-Dp/dtmin)、左室舒张末期内径(LVEDD)、左室收缩末期内径(LVESD)、分数缩短率(FS)。③炎性因子:眼眶采取大鼠静脉血1 ml,3000 r/min离心15 min并保存,采用酶联免疫吸附法(ELISA)检测白细胞介素-8(IL-8)、IL-10、IL-1β;免疫比浊法检测肿瘤坏死因子-α(TNF-α)、转化生长因子-β(TGF-β);试剂盒购自上海江莱生物科技有限公司,操作方法严格按说明书执行。④心室重塑情况:HE染色下比较各组心肌梗塞面积,梗死区呈蓝色;胶原体积分数(CVF);采用蛋白免疫组化染色法检测大鼠脑皮层基质金属蛋白酶(MMP-2)阳性表达率。⑤心肌细胞凋亡情况:采用全自动UMNSAH/DF-1细胞系(上海宾穗生物科技有限公司)统计细胞凋亡数,操作方法参考说明书,且由专科医师操作;凋亡细胞为胞核固缩、有棕黄色颗粒或团块。⑥炎性细胞浸润情况:采用免疫组化染色法检测大鼠心肌炎性细胞浸润情况。
1.5 统计学处理采用SPSS 21.0软件进行统计分析,计量资料采用(±s)表示,多组间比较采用单因素方差分析,两两比较采用Snk-q检验;以P<0.05为差异有统计学意义。
2 结果
2.1 各组DC表达水平比较实验期间大鼠生存率见图1。DC体外诱导免疫应答是其特征性标志,AMI心脏局部可见大量DC表面相关标志物CD11c、CD14、CD40、CD80、CD86、MHCⅠ、MHCⅡ。AMI后第3 d可检出DC相关标志物,第7 d达高峰,第14 d后下降。C组CD40、CD80、CD86、MHCⅠ、MHCⅡ表达水平高于A、B组(图2~3)。流式分析结果显示,DC可获取CD4+CD25+纯度>90%,且可有效诱导Treg细胞群(图4)。Treg在大鼠心脏和淋巴结中均有表达,且C组表达水平高于A、B组(图5)。
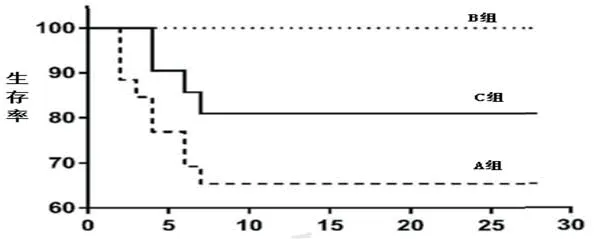
图1 各组生存曲线图
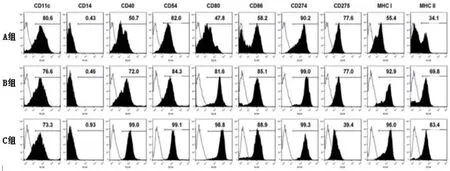
图2 各组DC表达情况

图4 各组共培养实验结果图
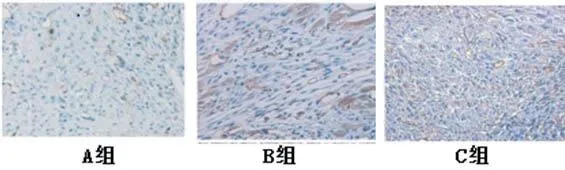
图5 各组心脏和淋巴结中Treg表达水平(标尺20 mm)
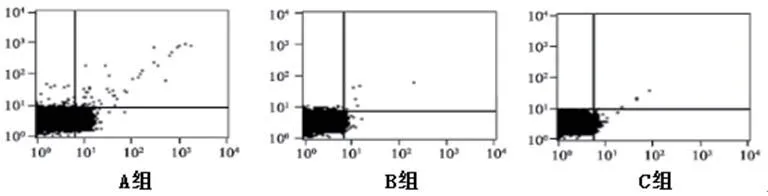
图5 各组心肌细胞凋亡图
2.2 各组血流动力学指标比较与A组比较,B组、C组LVEDP、LVEDD、LVESD降低(P<0.05),LV+Dp/dtmax、LV-Dp/dtmin、FS升高(P<0.05);与B组比较,C组LVEDP、LVEDD、LVESD降低(P<0.05),LV+Dp/dtmax、LV-Dp/dtmin、FS升高(P<0.05),表1。

表1 各组血流动力学指标比较
2.3 各组炎症因子表达情况与A组比较,B组、C组TNF-α、IL-1β、TGF-β、IL-12、IL-8水平降低(P<0.05);与B组比较,C组TNF-α、IL-1β、TGF-β、IL-12、IL-8水平降低(P<0.05),表2。

表2 各组炎症因子表达情况
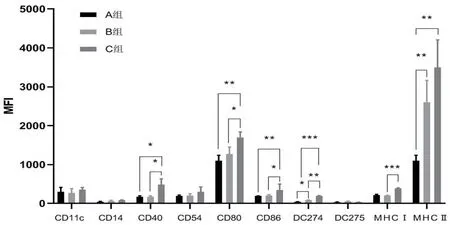
图3 各组DC表达情况
2.4 各组心室重塑情况比较与A组比较,B组、C组心肌梗塞面积、CVF值降低(P<0.05),MMP-2活性升高(P<0.05);与B组比较,C组心肌梗塞面积、CVF水平降低(P<0.05),MMP-2活性升高(P<0.05);表3。染色下心肌梗死情况见图7。
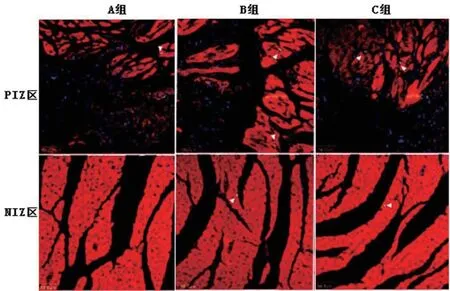
图7 各组心肌梗死面积图

表3 各组心室重塑情况比较
2.5 各组心肌细胞凋亡及炎性细胞浸润比较A组心肌细胞凋亡率(10.57±0.52)%、B组(8.33±0.47)%、C组(0.65±0.12)%(图8),三组比较差异显著(F=642.30,P<0.001),C组心肌细胞凋亡率依次小于A、B组(P<0.05)。与A组比较,B组、C组炎性细胞个数减少(P<0.05);与B组比较,C组炎性细胞个数减少(P<0.05),表4。

表4 各组炎性细胞浸润比较
3 讨论
本研究中AMI大鼠过继转输DC后DC表面标志物CD40、CD80、CD86、MHCⅠ、MHCⅡ表达水平显著增高,提示DC迁移增强可活化T细胞介导的适应性免疫过程。为进一步探究其作用机制,本研究分析DC体内含有大量的Treg细胞诱导剂,对AMI后心肌炎症调节作用具有重要价值,提示其具有抗心室重塑作用。本研究在心梗后的第4周进行超声心动图和血流动力学检测,结果提示,AMI大鼠过继转输DC后,心室扩张和心功能不全明显改善,相关炎症因子表达显著下调。为了排除细胞过继对心肌梗死后的非特异性影响,我们通过给AMI大鼠过继的同等数量的mDC细胞,发现其对大鼠的心室扩张和心功能无明显作用,进一步支持了DC对改善心功能的特异性效用。另注射DC后Treg细胞出现更早,随后7 d内发现其达峰值,但14 d后下降,进一步说明DC可参与炎性反应。综合炎性细胞计数和细胞凋亡情况,说明DC可修复炎性细胞和改善伤口愈合,预防AMI小鼠心力衰竭的发生。
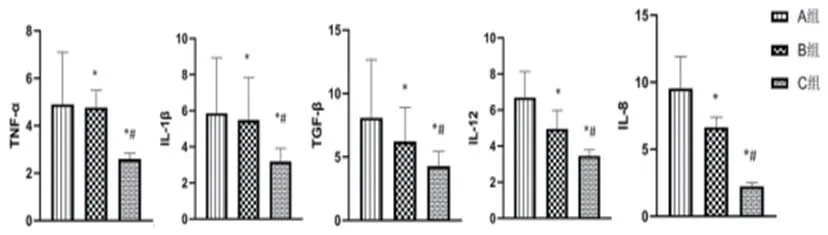
图6 各组炎性因子表达情况
既往研究表明,Treg可趋化至机体炎症反应的部位包括肺部及皮肤病变部位[6]、肿瘤组织[7]甚至炎性小鼠结肠粘膜[8],在局部发挥免疫调节作用。我们实验明确了Treg做为机体免疫系统的组成细胞参与心肌梗死局部的炎症反应,结合Chen等[9]报道结果,交界区选择性表达的DC表面蛋白具有限制炎症细胞由梗死区向非梗死区浸润进而导致不良心室重塑的作用,我们推测Treg在交界区的选择性浸润作为一种内源性保护机制参与抑制AMI诱导过度的炎症反应。目前已有学者提出干细胞诱导再生潜能、抗炎疗法等可改善AMI后心肌重塑[10,11],但其效果尚不显著。炎症机制对心室重塑的重要机制已得到证实,主要与炎症反应可诱导趋化因子异常表达有关。炎症介质包括TNF-α、IL-1β、TGF-β、IL-12、IL-8可作为判断炎症状态敏感性指标。TNF-α由单核细胞和巨噬细胞产生,为促炎性细胞类因子,并参与炎症免疫反应,在心血管重症类疾病患者的血液中均可发现大量TNF-α。IL-10为急性炎症反应蛋白,郝瑞等[12]指出,重症炎症患者血清IL相关因子水平显著高于轻度炎症患者,提示其对疾病发展有较高预测价值。余帮兴等报道,IL-8具有促血管生成作用,提示其对伤口愈合有重要价值。各炎症因子呈协同作用,近年来更是广泛应用于危急病症风险评估,因这些炎症指标与机体病症严重程度呈正相关,而不受年龄、药物的影响。心功能分级诊断指南中,认为炎症因子水平的升高与降低与DC关系较大。DC是目前体内最强大的专职抗原递呈细胞,其表明含有丰富的抗原捕获分子、抗原递呈分子、免疫共刺激分子。DC被激活后向淋巴结迁移,启动、激发CD4+、CD8+T细胞免疫应答,特异性杀灭肿瘤细胞;且可分泌多种细胞因子,参与机体非特异应答。有学者指出DC对免疫机制有调控作用,可通过DNA、非编码RNA等参与机体病理生理过程。DC迁移紊乱可导致组织过度炎症,与常见炎性因子呈协同作用加重炎性疾病症。Luo等[15]指出,抑制DC糖酵解过程后,细胞体内迁移及参与炎性疾病发生发展的进程受到了影响。最新研究结果显示,DC表面特异性抗体可增强T细胞免疫效应,且研究明确了DC可去除死亡组织并抑制细胞凋亡。该作用机制包括两方面:一是使T细胞携带能和肿瘤抗原紧紧结合的受体,二是阻断T细胞上的抑制性调控分子。
综上,DC具有介导特异性细胞免疫系统作用,可修复炎性细胞,改善心室重塑及功能,值得临床推广应用。但梗死后炎症应答的调节机制中包括多种介质之间的相关作用,且AMI后创伤愈合的空间时间特点存在差异,仍需进一步扩大研究样本和延长研究时间来明确最佳作用靶点,为获得更好的抗炎和心室重塑治疗效果而努力。

