miR-661靶向SCARB1调控冠状动脉内皮细胞胞吞LDL的机制研究
马君,张珺,王思雯,刘景隆
【关键字】miR-661;清除剂受体B类成员1;冠状动脉内皮细胞;低密度脂蛋白
动脉粥样硬化是动脉中发生的疾病过程,是心血管疾病发展的基础[1]。低密度脂蛋白(LDL)和残余脂蛋白水平升高已被确定为动脉粥样硬化的主要危险因素[2-4]。被困在动脉中的脂蛋白中的氧化磷脂促进单核细胞的活化和浸润,随后分化为促炎性巨噬细胞,使泡沫细胞形成和动脉粥样硬化发展[5]。进入动脉壁的LDL是动脉粥样硬化的关键驱动力,通过与肝细胞中的清除剂受体B类成员1(SCARB1)结合,高密度脂蛋白颗粒(HDL)介导胆固醇逆向转运到肝脏进行胆汁处置,从而具有抗动脉粥样硬化作用[6]。此外,在经由SCARB1及其衔接子的内皮细胞中,HDL刺激了内皮一氧化氮合酶,内皮修复和抗炎过程,这些过程也可能有抗动脉粥样硬化作用[6]。研究表明[7],内皮细胞SCARB1敲除小鼠的动脉粥样硬化明显减少。但SCARB1的表达水平如何被调控的仍然未知,是否被miRNA调控值得探讨。由于循环氧化的LDL(oxLDL)和天然LDL(nLDL)均能促进动脉粥样硬化的形成[8],本研究旨在使用荧光标记的oxLDL和nLDL为研究对象探讨miRNA如何介导SCARB1调控冠脉内皮细胞胞吞LDL。
1 材料与方法
1.1 材料人冠状动脉(冠脉)内皮细胞购自Procell公司(货号:CP-H087)。胎牛血清购自广州市左克生物科技发展有限公司(货号:HQ30071)。人冠脉内皮细胞完全培养基购自procell公司(货号:CM-H087)。第一链cDNA合成试剂盒购自北京兰博利德商贸有限公司(货号:C1802)。青链霉素混合液(100×)购自上海亿言生物科技有限公司(货号:SL6040-100 ml)。pCDNA3.1载体购自广州市齐云生物技术有限公司(货号:VT1001)。PCR扩增人冠脉内皮细胞的cDNA后插入pCDNA3.1载体构建pCDNA3.1-SCARB1表达质粒(pCDNA3.1-SCARB1)。miR-328-5p,miR-661,miR-4306,miR-4650-5p,miR-5586-3p,miR-6885-5p的miRNA mimics、miR-661 inhibitor和qPCR引物均由北京擎科合成。GAPDH Antibody购自南京沃博生物科技有限公司(货号:T40004XS)。SCARB1 antibody购自上海群己生物科技有限公司(货号:Abnova-PAB16753)。HiPerFect Transfection Reagent购自QIAGEN公司(货号:301705)。Luciferase Reporter Assay试剂盒购自广州威佳科技有限公司(货号:68-LucifR-S200(200 assays))。Native human LDL protein购自柏奥易杰(北京)科技有限公司(货号:ab91115-1 mg)。oxidized LDL购自上海源叶生物科技有限公司(货号:S24879-2 mg)。
1.2 方法
1.2.1 细胞培养、nLDL和oxLDL处理和转染人冠脉内皮细胞使用添加了10%FBS和1%P/S的人冠脉内皮细胞完全培养基培养,置于37℃、5%CO2的细胞培养箱中。使用50 μg/ml的nLDL和oxLDL处理人冠脉内皮细胞,对照为相应的DMSO。miR-328-5p,miR-661,miR-4306,miR-4650-5p,miR-5586-3p,miR-6885-5p的miRNA mimics、miR-661 inhibitor、pCDNA3.1-SCARB1与转染试剂HiPerFect Transfection Reagent以1:3的比例混合,在室温静止15 min后缓缓滴入人冠脉内皮细胞。
1.2.2 免疫印迹使用RIPA缓冲液裂解细胞。提取的蛋白质在聚丙烯酰胺-SDS凝胶上分离,然后电转移到PVDF膜上。分别用针对SCARB1或GAPDH的抗体探测印迹。使用ECF蛋白质印迹系统检测免疫反应性条带,AlphaImager 2200分析软件对其进行定量。
1.2.3 RNA抽取与实时荧光定量PCR使用RNA提取试剂盒从人冠脉内皮细胞中提取总RNA,并根据制造商的规程用反转录引物(RT-primers)反转录为cDNA。为了评估SCARB1,GAPDH和相应的miRNA的表达水平,使用SYBR-Green PCR试剂盒以20 μl的总体积进行qRT-PCR分析。1 μl cDNA,0.5 μl每个引物,0.3 μl SYBR-Green和7.7 μl ddH2O。 反应条件如下:94℃下5 min,94℃下10 s,60℃下20 s,72℃下30 s,随后的40个循环2 min和在72℃下30 s,在40℃下30 s,每1℃在60~94℃熔化,在25℃下1 s和1~2 min。人类U6小核RNA或GAPDH被用作内部参考基因。
1.2.4 nLDL和oxLDL的检测将相应处理的人冠脉内皮细胞种于96孔板中。过夜后,nLDL和oxLDL处理人冠脉内皮细胞4 h后,收获人冠脉内皮细胞。用PBS洗涤细胞3次,并裂解以通过荧光计测量荧光强度。
1.2.5 荧光素酶报告实验将SCARB1的3端非编码区克隆至pmir-glo utr1载体上,作为pmir-glo utr1-SCARB1-WT。将SCARB1的3端非编码区做G→C突变后,克隆至pmir-glo utr1载体上,作为pmir-glo utr1-SCARB1-MT。将人冠脉内皮细胞与pmir-glo utr1-SCARB1-MT(800 μng)、pmir-glo utr1-SCARB1-WT(800 μng)、对照载体(800 μng)、的TK Renilla报告基因(8 ng)根据试剂盒说明,使用Lipofectamine 3000进行转染。转染48 h后,裂解了总细胞蛋白,并使用双重荧光素酶测定系统检测了荧光素酶活性(萤火虫和海肾)。
1.3 统计学分析使用Python panda package进行统计分析。计量资料以均数±标准差表示。所有结果均采用单因素方差分析(ANOVA)行统计分析,Bonferroni进行事后检验。所有统计分析均使用SPSS软件20.0版(IBM,NY)。P<0.05为差异有统计学意义。
2 结果
2.1 SCARB1调控冠脉内皮细胞胞吞LDL通过siRNA敲低SCARB1后,发现冠脉内皮细胞胞内的nLDL和oxLDL均减少(P<0.05)。通过过表达载体过表达SCARB1后,发现冠脉内皮细胞胞内的nLDL和oxLDL均升高(P<0.05),图1。
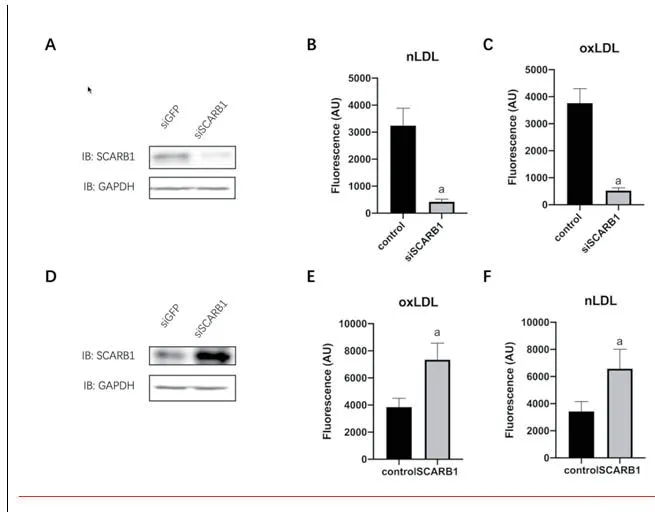
图1 SCARB1调控冠脉内皮细胞胞吞LDL(注:与对照组相比,aP<0.05)
2.2 miR-661靶向SCARB1将miRDB和HumanTargetScan数据库中预测的SCARB1的miRNA和McCall等[9]通过高通量测序得到的冠脉内皮细胞的总miRNA表达谱做交集后,发现有6个miRNA在三者中均存在,分别是miR-328-5p,miR-661,miR-4306,miR-4650-5p,miR-5586-3p,miR-6885-5p,图2。通过miRNA mimics过表达相应的miRNA后,发现仅在过表达miR-661时冠脉内皮细胞中SCARB1的表达水平降低(P<0.05)。使用miR-661 inhibitor敲低miR-661后,发现冠脉内皮细胞中SCARB1的表达水平升高(P<0.05)。通过荧光素酶报告系统,发现miR-661靶向SCARB1的3端非编码区(P<0.05),图3。
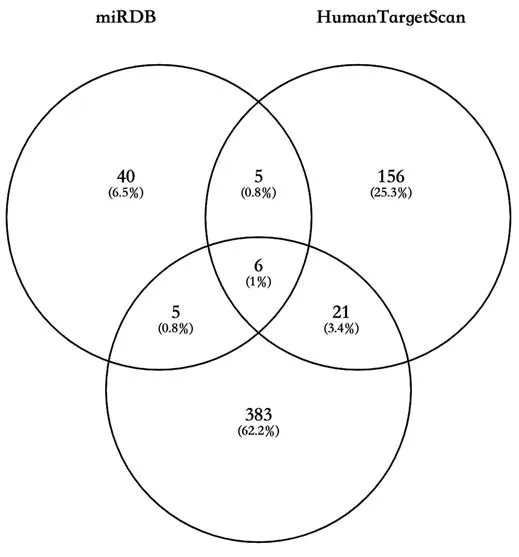
图2 miRDB,HumanTargetScan,EndothelialmiRNA交集情况
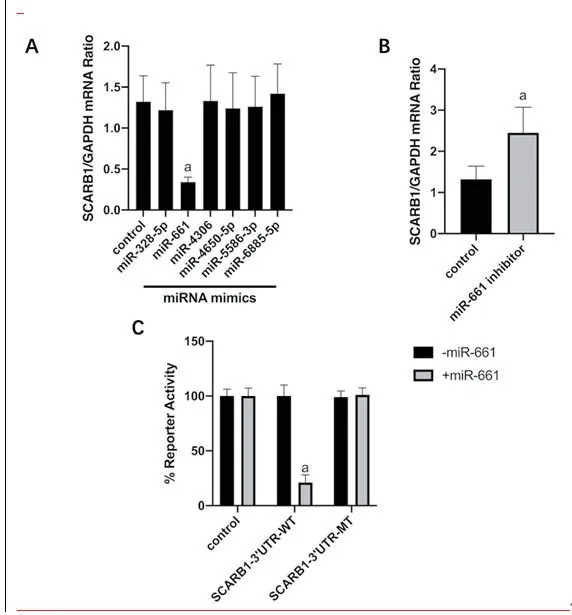
图3 miR-661靶向SCARB1(注:与对照组相比,aP<0.05)
2.3 miR-661靶向SCARB1调控冠脉内皮细胞胞吞LDL使用miR-661 mimics过表达miR-661后,冠脉内皮细胞nLDL和oxLDL的水平均降低(P<0.05),而使用miR-661 inhibitor敲低miR-661后,冠脉内皮细胞nLDL和oxLDL的水平均升高(P<0.05)。同时过表达miR-661和SCARB1后,冠脉内皮细胞nLDL和oxLDL的水平无明显变化(P>0.05),图4。
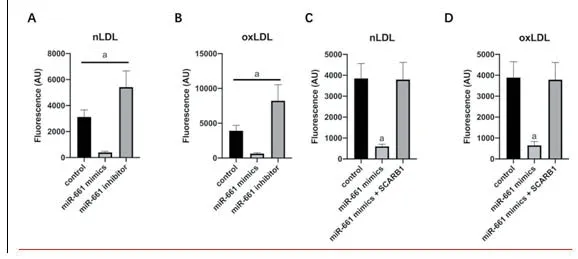
图4 miR-661靶向SCARB1调控冠脉内皮细胞胞吞LDL(注:与对照组相比,aP<0.05)
3 讨论
动脉粥样硬化是一种进行性炎性疾病,其特征是脂质在动脉血管壁中蓄积,这是从生命的早期开始的[10]。疾病进展导致动脉粥样硬化斑块积聚,导致动脉管腔变窄[11]。动脉粥样硬化斑块通常可保持稳定多年,但会迅速变得不稳定,破裂并触发血栓形成[12]。因此,除了限制血管腔外,动脉粥样硬化斑块的存在还与急性心血管事件如心肌梗塞和中风的风险增加有关[13]。
长期以来,人们一直认为,LDL向动脉壁的输送会引发动脉粥样硬化,使其在病变易发部位通过受损的内皮屏障而被动运动,这表现出较高的内皮衰老和凋亡率,并降低了增殖储备和修复能力[14]。但最近研究揭示了由SCARB1在内皮中主动跨细胞LDL转运驱动动脉粥样硬化[7]。本研究发现敲低SCARB1后,冠脉内皮细胞胞内的nLDL和oxLDL均减少。过表达SCARB1后,冠脉内皮细胞胞内的nLDL和oxLDL均升高。OxLDL是一个通用术语,涵盖了LDL脂质部分和载脂蛋白B(ApoB),(LDL颗粒的主要蛋白)的异质氧化变化[15]。这些改变包括通过磷脂酰胆碱(PC)暴露使磷脂壳重组,以及将醛类如丙二醛(MDA)加到ApoB上[16]。OxLDL和LDL衍生的氧化磷脂可刺激巨噬细胞,血管平滑肌细胞和附近其他细胞的炎症激活,就像“病原相关分子模式”(PAMPs)一样,起到“危险相关分子模式”(DAMPs)的作用[17]。此外,LDL诱导SCARB1与细胞分裂指标蛋白4(DOCK4)的偶联显着增加,而SCARB1与DOCK4的偶联能够促进细胞胞吞LDL[18]。同时研究表明[19],人动脉粥样硬化动脉中SCARB1和DOCK4的表达高于正常动脉。因此,抑制LDL通过SCARB1胞吞进入细胞这一过程能够在一定程度上治疗动脉粥样硬化。
本研究发现,过表达miR-661时冠脉内皮细胞中SCARB1的表达水平降低。敲低miR-661后,冠脉内皮细胞中SCARB1的表达水平升高。此外,miR-661靶向SCARB1的3端非编码区。过表达miR-661后,冠脉内皮细胞nLDL和oxLDL的水平均降低,而敲低miR-661后,冠脉内皮细胞nLDL和oxLDL的水平均升高。同时过表达miR-661和SCARB1后,冠脉内皮细胞nLDL和oxLDL的水平无明显变化。自发现miRNA以来,在很短的时间内,操纵它们的治疗方法已从实验台发展到了床边,进行了一些成功的Ⅰ期试验和正在进行的Ⅱ期试验。LNA miravirsen是最早进入临床开发的基于miRNA的分子之一,它是一种15核苷酸的反义RNA寡核苷酸,与miR-122的5'端具有互补性,用于治疗HCV,目前已经进入了临床Ⅱ期[20]。因此,miR-661是一个潜在的治疗动脉粥样硬化的miRNA分子,相关的动物实验值得开展。
综上所述,miR-661通过靶向SCARB1 mRNA的3端非编码区降解SCARB1 mRNA后减少了SCARB1的翻译,最终抑制冠状动脉内皮细胞胞吞LDL。

