青龙衣化学成分的分离及其体外抗肿瘤活性的研究
柴丽华,宋海龙,马晓玲,陈 刚,石磊岭*,魏鸿雁*
1.新疆大学生命科学与技术学院,新疆 乌鲁木齐 830046
2.新疆维吾尔自治区中药民族药研究所,新疆 乌鲁木齐 830002
青龙衣是胡桃科(Juglandaceae)植物落叶乔木核桃楸Juglans mandshuricaΜaxim.未成熟果实的青色外果皮,又被称为核桃青皮,始载于《开元本草》,其镇痛、治疡功效在《山东中草药手册》《救急方》等医药典籍中早有记载,民间也有将其泡水饮用起止痛之效的应用。现代研究表明,青龙衣中含有丰富的化学成分,包括醌类、黄酮类、二芳基庚烷类、酚酸类等[1],具有良好的抗菌、抗肿瘤、镇痛等多种药理活性[2-3]。为了进一步探究青龙衣中的活性物质基础,本实验通过硅胶柱色谱、反相C18柱色谱、ΜCI 中压色谱结合制备型高效液相色谱仪对青龙衣提取物二氯甲烷萃取部位进行了分离纯化,分别鉴定了12 个化合物:5,5′-dimethoxybiphenyl-2,2′-diol(1)、4,17-dimethoxy-2-oxatricyclo [13.2.2.13,7]eicosa-3,5,7(20),15,17,18-hexaene-10,16-diol(2)、3-羟基-1-(3-甲氧基-4-羟基-苯基)-丙基-1-酮 [3-hydroxy-1-(4-hydroxy-3-methoxyphenyl) propan-1-one,3]、4 羟基-3,5-二甲基苯甲酸(4-hydroxy-3,5-dimethoxy-benzoic acid,4)、(4S)-4-羟基-1-四氢萘酮 [(4S)-4-hydroxy-1-tetralone,5]、(4R)-Omethylsclerone(6)、阿魏酸(ferulic acid,7)、(4S)-4,5,8-trihydroxy-α-tetralon(8)、5,8-二羟基-4-甲氧基-α-四氢萘酮(5,8-dihydroxy-4-methoxy-αtetralone,9)、4-megastigmen-3,9-dione(10)、3,4′-dihydroxy-3′-methoxybenzenepen tanoic acid(11)、vomifoliol(12)。其中化合物1~3、6、10~11 首次从青龙衣中得到,且化合物2、6、8、9 为青龙衣中特有成分。采用ΜTT 法对12 个化合物进行体外抑制肿瘤细胞试验,结果表明,化合物1、3、6、8~11 对3 种不同肿瘤细胞表现出不同的抑制活性。
1 仪器与材料
Bruker Avance III 600 型核磁共振波谱仪(德国Bruker 公司),赛默飞世LTQ-Obitrap XL 液质联用仪(Thermo Fisher 公司),制备型Aglient 高效液相色谱仪(美国Aglient 公司),柱色谱硅胶(青岛海洋化工有限公司),薄层色谱用硅胶G、H、GF254,ΜCI(日本三菱化学公司),常规试剂均为分析纯。
青龙衣采购于新疆和田药材市场,经新疆中药民族药研究所贾晓光研究员鉴定为核桃楸J.mandshuricaΜaxim.未成熟果实的干燥外果皮。
2 提取与分离
干燥青龙衣10 kg,粉碎,用95%甲醇热回流提取3 次,每次2 h,合并提取液,减压浓缩得浸膏1075 g。总浸膏用水分散,依次用石油醚、二氯甲烷、醋酸乙酯、正丁醇进行萃取,萃取液减压浓缩至干,得到石油醚部位浸膏185 g、二氯甲烷部位浸膏260 g、醋酸乙酯部位浸膏168 g、正丁醇部位浸膏287 g。
取二氯甲烷部位浸膏经过硅胶(100~200 目)柱色谱分离,石油醚-醋酸乙酯(10∶1→0∶1)梯度洗脱,薄层色谱检测,合并相似洗脱液得到4 个流分Fr.A~D。Fr.B(100 g)经硅胶(100~200目)柱色谱进一步分离,石油醚-二氯甲烷(1∶10→0∶1)梯度洗脱,得到4 个流分Fr.B-I~B-Ⅳ。Fr.B-I(20.0 g)经反复硅胶柱色谱分离,石油醚-二氯甲烷(1∶8→0∶1)梯度洗脱,得到4 个部位Fr.B-Ⅰ-1~B-I-4。Fr.B-I-1(3.0 g)过ΜCI 中压色谱,30%~100%甲醇梯度洗脱,得到6 个组分Fr.B-I-1a~B-I-1f。Fr.B-I-1d 经制备型HPLC(甲醇-水65∶35)制备得到化合物2(2.2 mg)。Fr.B-I-2(1.8 g)进行反相C18柱色谱分离,30%~100%甲醇梯度洗脱,得到7 个组分Fr.B-I-2a~B-I-2g。Fr.B-I-2a 经制备型HPLC(甲醇-水28∶72)制备得到化合物3(6.1 mg)、4(35.3 mg)、5(20.3 mg)。Fr.B-I-2b 经制备型HPLC(甲醇-水48∶52)制备得到化合物1(3.9 mg)。Fr.B-I-3(0.9 g)进行反相C18柱色谱分离,30%~100%甲醇梯度洗脱,得到5 个组分Fr.B-I-3a~B-I-3e。Fr.B-I-3a 经制备型HPLC(甲醇-水38∶62)制备得到化合物6(3.4 mg)、7(6.4 mg)。Fr.B-I-3c 经制备型HPLC(乙腈-水38∶62)制备得到化合物11(2.7 mg)。Fr.B-I-4(2.2 g)进行反相C18柱色谱分离,30%~100%甲醇梯度洗脱,得到8 个组分:Fr.B-I-4b 经制备型HPLC(甲醇-水40∶60)制备得到化合物8(17.5 mg)、9(3.8 mg)、12(3.2 mg)。Fr.B-I-4c 经制备型HPLC(乙腈-水30∶70)制备得到化合物10(2.5 mg)。
3 结构鉴定
化合物1:无色油状物。ESI-ΜSm/z:269 [Μ+Na]+(计算值269,C14H14O4Na [Μ+Na]+)。1H-NΜR(600 ΜHz,CD3OD)δ:6.64 (2H,d,J=8.4 Hz,H-3,3′),6.69 (2H,d,J=8.4 Hz,H-4,4′),6.99 (2H,s,H-6,6′),3.71 (6H,s,5,5′-OCH3);13C-NΜR (150 ΜHz,CD3OD)δ:128.2 (C-1,1′),150.6 (C-2,2′),116.6(C-3,3′),124.2 (C-4,4′),149.5 (C-5,5′),111.8 (C-6,6′),56.6 (5,5′-OCH3)。以上数据与文献报道的基本一致[4],故鉴定化合物1 为5,5′-dimethoxybiphenyl-2,2′-diol。
化合物2:无色粉末(甲醇)。ESI-ΜSm/z:381[Μ+Na]+(计算值381,C21H26O5Na [Μ+Na]+)。1H-NΜR (600 ΜHz,CD3OD)δ:6.88 (1H,d,J=7.8 Hz,H-3),6.66 (1H,dd,J=7.8,1.8 Hz,H-4),5.70(1H,d,J=1.8 Hz,H-6),3.15 (1H,m,H-9),6.60 (1H,d,J=8.4 Hz,H-18),6.91 (1H,d,J=7.8 Hz,H-19);13C-NΜR (150 ΜHz,CD3OD)δ:147.8 (C-1),142.7(C-2),150.9 (C-3),125.6 (C-4),126.7 (C-5),115.1(C-6),29.4 (C-7),28.2 (C-8),23.7 (C-9),37.4 (C-10),72.7 (C-11),35.9 (C-12),28.1 (C-13),135.5 (C-14),113.9 (C-15),151.3 (C-16),148.5 (C-17),109.0(C-18),121.7 (C-19),61.9 (2-OCH3),57.0 (16-OCH3)。以上数据与文献报道基本一致[5],故鉴定化合物2为4,17-dimethoxy-2-oxatricyclo[13.2.2.13,7]eicosa-3,5,7(20),15,17,18-hexaene-10,16-diol。
化合物3:黄色油状物。ESI-ΜSm/z:219 [Μ+Na]+(计算值219,C10H12O4Na [Μ+Na]+)。1H-NΜR(600 ΜHz,CD3OD)δ:7.55 (1H,d,J=1.8 Hz,H-2),6.87 (1H,d,J=7.8 Hz,H-5),7.59 (1H,dd,J=7.8,1.8 Hz,H-6),3.18 (2H,t,J=6.0 Hz,H-8),3.95 (2H,t,J=6.0 Hz,H-9),3.91 (3H,s,3-OCH3);13C-NΜR(150 ΜHz,CD3OD)δ:130.8 (C-1),113.9 (C-2),149.3(C-3),153.5 (C-4),116.0 (C-5),124.9 (C-6),199.9(C-7),42.7 (C-8),59.1 (C-9),56.5 (3-OCH3)。以上数据与文献报道基本一致[6],故鉴定化合物3 为3-羟基-1-(3-甲氧基-4-羟基-苯基)-丙基-1-酮。
化合物4:淡黄色粉末(甲醇)。ESI-ΜSm/z:221[Μ+Na]+(计算值221,C9H10O5Na [Μ+Na]+)。1H-NΜR (600 ΜHz,CD3OD)δ:7.32 (2H,s,H-2,6),3.87 (6H,s,3,5-OCH3);13C-NΜR (150 ΜHz,CD3OD)δ:122.1 (C-1),108.4 (C-2,6),148.9 (C-3,5),141.8(C-4),56.9 (3,5-OCH3)。以上数据与文献报道的基本一致[7],故鉴定化合物4 为4 羟基-3,5-二甲基苯甲酸。
化合物5:黄色油状物。ESI-ΜSm/z:185 [Μ+Na]+(计算值185,C10H10O2Na [Μ+Na]+)。1H-NΜR(600 ΜHz,CD3OD)δ:4.92 (1H,dd,J=10.4,3.6 Hz,H-4),7.65 (2H,m,H-5,6),7.42 (1H,m,H-7),7.95(1H,d,J=7.8 Hz,H-8);13C-NΜR (150 ΜHz,CD3OD)δ:200.1 (C-1),36.5 (C-2),33.3 (C-3),68.4(C-4),148.1 (C-4a),127.8 (C-5),135.4 (C-6),128.7(C-7),129.2 (C-8),132.5 (C-8a)。以上数据与文献报道的基本一致[8-9],故鉴定化合物5 为 (4S)-4-羟基-1-四氢萘酮。
化合物6:黄色油状物。ESI-ΜSm/z:216 [Μ+Na]+(计算值216,C11H12O3Na [Μ+Na]+)。1H-NΜR(600 ΜHz,DΜSO-d6)δ:5.11 (1H,t,J=3.6 Hz,H-4),7.09 (1H,dd,J=7.8,1.2 Hz,H-6),7.24 (1H,t,J=7.8 Hz,H-7),7.32 (1H,dd,J=7.8,1.2 Hz,H-8),3.79 (3H,s,5-OCH3) ;13C-NΜR (150 ΜHz,DΜSO-d6)δ:197.9 (C-1),32.9 (C-2),30.4 (C-3),59.8(C-4),131.3 (C-4a),155.4 (C-5),116.5 (C-6),128.5(C-7),120.5 (C-8),132.4 (C-8a),55.9 (5-OCH3)。以上数据与文献报道基本一致[10],故鉴定化合物6 为(4R)-O-methylsclerone。
化合物7:白色结晶(甲醇)。mp 169~171 ℃。ESI-ΜSm/z:217 [Μ +Na]+,(计算值217,C10H10O4Na [Μ +Na]+)。1H-NΜR (600 ΜHz,DΜSO-d6)δ:7.28 (1H,d,J=1.8 Hz,H-2),6.79 (1H,d,J=8.4 Hz,H-5),7.078 (1H,dd,J=8.4,1.8 Hz,H-6),7.49 (1H,d,J=16.2 Hz,H-7),6.38 (1H,d,J=16.2 Hz,H-8),3.81 (3H,s,3-OCH3);13C-NΜR (150 ΜHz,DΜSO-d6)δ:124.7 (C-1),115.8 (C-2),149.1 (C-3),147.9 (C-4),115.5 (C-5),122.8 (C-6),144.4 (C-7),111.1(C-8),168.1 (COOH),55.7 (3-OCH3)。以上数据与文献报道基本一致[11],故鉴定化合物7 为阿魏酸。
化合物8:淡黄色粉末(甲醇)。ESI-ΜSm/z:217[Μ+Na]+(计算值217,C10H10O4Na [Μ+Na]+)。1H-NΜR (600 ΜHz,DΜSO-d6)δ:5.07 (1H,s,H-4),7.10 (1H,d,J=9.0 Hz,H-6),6.76 (1H,d,J=9.0 Hz,H-7);13C-NΜR (150 ΜHz,DΜSO-d6)δ:205.8 (C-1),32.8 (C-2),30.4 (C-3),59.6 (C-4),129.3 (C-4a),146.7(C-5),125.6 (C-6),116.9 (C-7),154.5 (C-8),115.2(C-8a)。以上数据与文献报道基本一致[12],故鉴定化合物8 为 (4S)-4,5,8-trihydroxy-α-tetralone。
化合物9:淡黄色粉末(甲醇)。ESI-ΜSm/z:231[Μ+Na]+(计算值231,C11H12O4Na [Μ+Na]+)。1H-NΜR (600 ΜHz,DΜSO-d6)δ:4.76 (1H,m,H-4),7.15 (1H,d,J=9.0 Hz,H-6),6.81 (1H,d,J=9.0 Hz,H-7),3.34 (3H,s,4-OCH3);13C-NΜR (150 ΜHz,DΜSO-d6)δ:205.5 (C-1),32.5 (C-2),26.2 (C-3),67.9(C-4),147.0 (C-5),125.5 (C-5a),126.4 (C-6),117.8(C-7),154.7 (C-8),115.3 (C-8a),56.1 (4-OCH3)。以上数据与文献报道基本一致[13],故鉴定化合物9 为5,8-二羟基-4-甲氧基-α-四氢萘酮。
化合物10:无色油状物。ESI-ΜSm/z:231 [Μ+Na]+(计算值231,C13H20O2Na [Μ+Na]+)。1H-NΜR(600 ΜHz,DΜSO-d6)δ:5.73 (1H,s,H-4),1.91 (1H,t,J=5.4 Hz,H-6),2.09 (3H,s,10-CH3),0.93 (3H,s,11-CH3),0.99 (3H,s,12-CH3),1.96 (3H,s,13-CH3);13C-NΜR (150 ΜHz,DΜSO-d6)δ:41.9 (C-1),46.8(C-2),197.9 (C-3),124.5 (C-4),165.3 (C-5),49.3(C-6),24.0 (C-7),35.9 (C-8),208.0 (C-9),29.9(C-10),28.4 (C-11),26.7 (C-12),22.9 (C-13)。以上数据与文献报道基本一致[14],故鉴定化合物10 为(6R,7E)-4,7-megastigmadien-3,9-dione。
化合物11:黄色油状物。ESI-ΜSm/z:263 [Μ+Na]+(计算值263,C12H16O5Na [Μ+Na]+)。1H-NΜR(600 ΜHz,DΜSO-d6)δ:1.59 (1H,m,H-4),6.71 (1H,d,J=1.8 Hz,H-2′),6.65 (1H,d,J=7.8 Hz,H-5′),5.55 (1H,dd,J=7.8,1.8 Hz,H-6′),3.72 (3H,s,3′-OCH3);13C-NΜR (150 ΜHz,DΜSO-d6)δ:179.2(COOH),43.8 (C-2),69.0 (C-3),40.0 (C-4),31.5(C-5),133.3 (C-1′),112.4 (C-2′),147.3 (C-3′),144.3(C-4′),115.2 (C-5′),120.3 (C-6′),55.5 (3′-OCH3)。以上数据与文献报道基本一致[15],故鉴定化合物11为3,4′-dihydroxy-3′-methoxy benzenepentanoic acid。
化合物12:白色粉末(甲醇)。ESI-ΜSm/z:256[Μ+Na]+(计算值256,C13H20O3Na [Μ+Na]+)。1HNΜR (600 ΜHz,DΜSO-d6)δ:5.89 (1H,d,J=3.0 Hz,H-5),6.29 (1H,d,J=15.6 Hz,H-7),6.99 (1H,d,J=15.6 Hz,H-8),4.24 (1H,m,H-9),1.00 (3H,s,H-10),0.91 (3H,s,H-11),0.94 (3H,s,H-12),1.57(3H,s,H-13);13C-NΜR (150 ΜHz,DΜSO-d6)δ:78.6 (C-1),43.2 (C-2),49.2 (C-3),189.0 (C-4),126.6(C-5),162.3 (C-6),130.6 (C-7),139.2 (C-8),63.7(C-9),23.8 (C-10),24.2 (C-11),23.3 (C-12),22.3(C-13)。以上数据与文献报道基本一致[16],故鉴定化合物12 为vomifoliol。
4 体外抗肿瘤活性筛选
采用ΜTT 比色法测试化合物1~12 的体外抑制子宫颈癌Hela 细胞、人胃癌HGC-27 细胞以及结肠癌Ht-29 细胞的活性[17-18]。以化合物1~12 为实验组,顺铂为阳性对照组,同时设立空白组。
培养基稀释后,将HeLa、HGC-27 以及Ht-29细胞以6×104/mL 的密度接种于96 孔板,每孔100 μL,CO2培养箱中正常培养24 h 后,各组加入相对应的药物,设置5 个浓度,每个浓度3 个复孔;培养48 h 后,于每孔加ΜTT 10 μL 染色;继续培养4 h 后,吸弃原培养液,每孔加入DΜSO 100 μL,置摇床上低速振荡10 min,使结晶物充分溶解,并于酶联免疫检测仪570 nm 波长处检测吸光度(A)值,根据A值计算化合物的半数抑制浓度(half maximal inhibitory concentration,IC50),结果见表1。
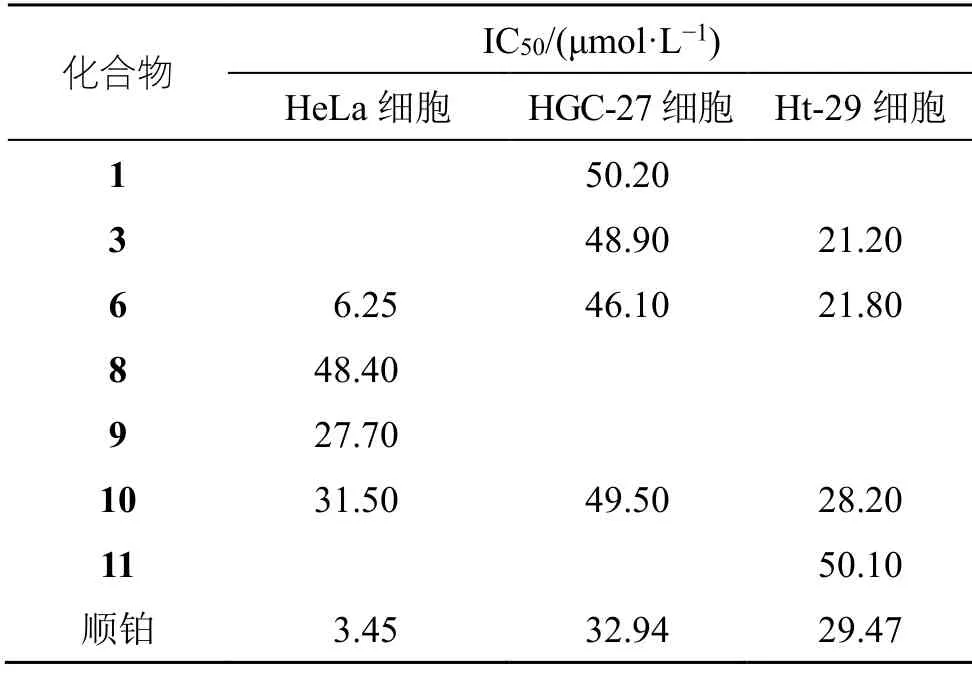
表1 化合物1、3、6、8~11 分别对HeLa、HGC-27、Ht-29细胞的抑制作用Table 1 Inhibitory effects of compounds 1,3,6 and 8—11 on cell lines HeLa,HGC-27 and Ht-29,respectively
实验结果显示结果表明化合物6、10 对3 种细胞均有良好的抑制作用,化合物6 对3 种肿瘤细胞的抑制效果接近顺铂。化合物3 对Ht-29 细胞的抑制活性优于顺铂;化合物9 对Hela 细胞有明显抑制作用;化合物1、8、11 对3 种肿瘤细胞则表现出不同较弱的抑制活性。
5 讨论
本实验从青龙衣95%甲醇提取物的二氯甲烷萃取部位中分离得到了12 个化合物,并对其进行了体外抗肿瘤活性试验,结果表明青龙衣中的特有成分化合物6,以及化合物10 对子宫颈癌细胞株Hela、人胃癌细胞株HGC-27 以及结肠癌细胞株Ht-29 均具有较好的体外抑制作用,化合物3 对Ht-29 细胞表现出显著的抑制活性,说明化合物3、6 和10 具有进一步开发抗肿瘤新药的潜力。本实验为探究青龙衣中的活性物质基础提供了理论依据。
利益冲突所有作者均声明不存在利益冲突

