杜松烷型倍半萜及其药理活性研究进展
梁 旭,杨新洲,江 姗,邓巧玉,陈兴广,贾学恭,邓富声,袁经权*
1.广西中医药大学 科学实验中心,广西 南宁 530200
2.中南民族大学药学院,湖北 武汉 430074
倍半萜基本骨架是由3 个异戊二烯基构成的焦磷酸金合欢酯(farnesyl pyrophosphate,FPP),在生物体内经过一系列复杂的转换形成,虽然倍半萜碳骨架只有15 个碳原子,但结构骨架类型和数目是萜类成分中最多的一类,也正因为如此,倍半萜类成分的研究一直是天然药物化学中非常重要和活跃的领域。
杜松烷(cadinane)型倍半萜属双环倍半萜基本骨架中的 1 种。生源上认为是由没药烷(bisabloane)碳正离子的C-1 和C-10 位碳环合成骨架。骨架A、B 的顺反异构、活性官能团的数目和位置的变化等使其在自然界中存在的数量较多,其在菊科飞蓬属、泽兰属、旋覆花属、蒿属、橐吾属、一枝黄花属、姜科姜黄属、唇形科薄荷属、杉科柳杉属、柏科柏木属及苔藓植物中等都有分布,在海藻和软珊瑚中也有发现[1-2]。并且某些该类化合物具有抗菌、抗炎、抗肿瘤、抗氧化、抗疟疾及保护神经细胞等活性。特别值得一提的是,我国科学家屠呦呦等从黄花蒿中分离得到的青蒿素(C15H22O5),是一种具有过氧键的杜松烷型倍半萜内酯,为治疗疟疾耐药性效果最好的药物,并因此荣获2015年度诺贝尔医学奖,提示该类成分具有重要的地位和广阔的前景。本文主要对2010年以来杜松烷型倍半萜的新颖结构和药理活性研究进展进行分类和总结,并对所有化合物根据天然化合物命名和翻译原则[3-7]进行了中文命名和翻译,以期为杜松烷型倍半萜类成分的研究、交流和开发提供参考。
1 化学成分
杜松烷型倍半萜的基本骨架如图1所示,根据其A/B 环稠合的方式以及C-7 位上的异丙基构型的不同,杜松烷型倍半萜主要划分为杜松烷类(cadinanes)、木萝烷类(muurolanes)、阿摩芬烷类(amorphanes)、布尔加烷类(bulgaranes)4 个类型[2,8],在此基础上,根据杜松烷型倍半萜存在多种官能团和取代基,以及复杂次生代谢产物等状况[2,9],进一步还分为含苯环、环氧及过氧基、羰基、羧基、二聚体、苷类等类型的杜松烷型倍半萜类成分。

图1 杜松烷型倍半萜基本骨架Fig.1 Basic skeleton of cadinane-type sesquiterpenoids
1.1 杜松烷型
杜松烷型倍半萜的基本骨架为 (1S,6R,7S)-7-异丙基-4,10-二甲基双环 [4.0.4]癸烷,或其对映异构体。在自然界中,杜松烷型倍半萜是4 种类型中分布最多的1 类。此类型倍半萜在近10年中共分离得到11 个化合物(1~11),其结构如图2所示。
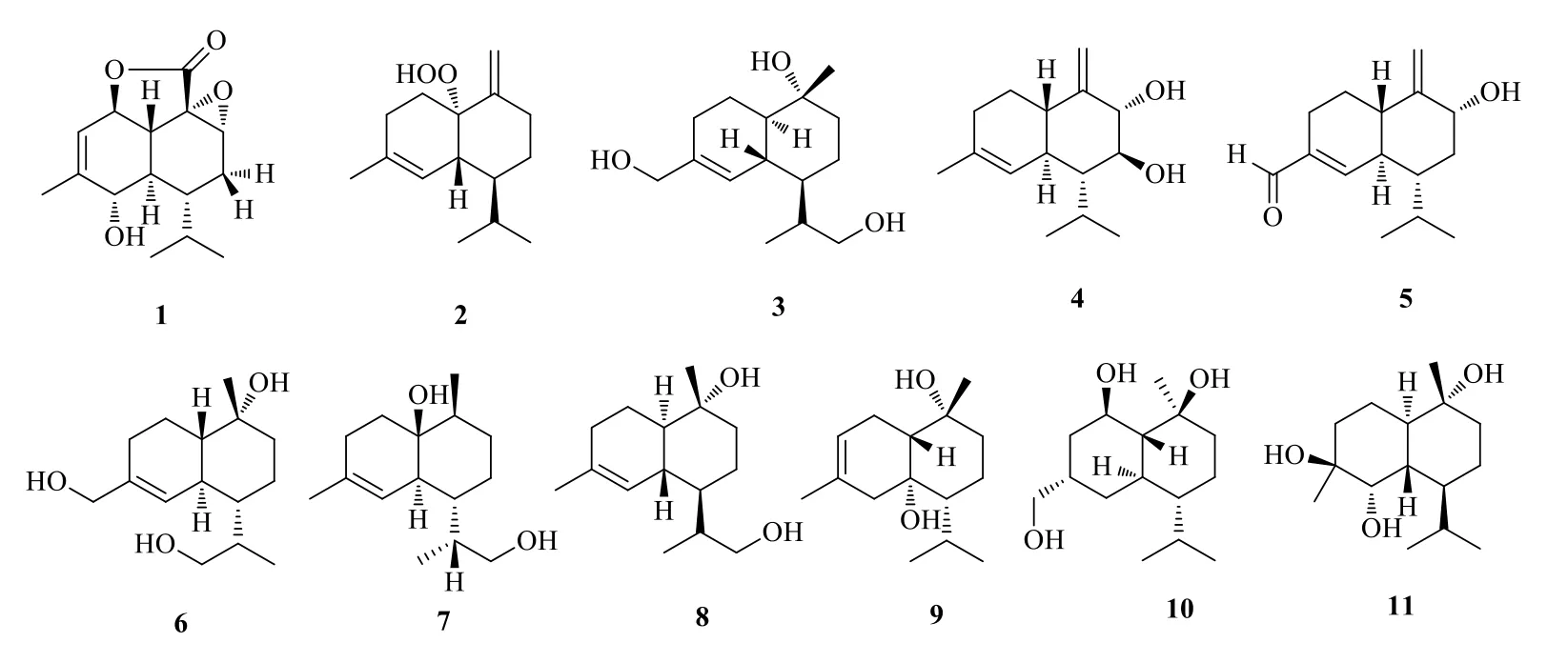
图2 杜松烷型倍半萜结构Fig.2 Structures of cadinanes type sesquiterpenoids
从苔属植物指叶苔Lepidozia reptans(L.)Dumont 中得到了1 个新的杜松烷型倍半萜内酯5α-羟基-9α,10α-环氧杜松-3-烯-2β,14-内酯(5α-hydroxy-9α,10α-epoxycadinan-3-en-2β,14-olide,1)[10]。鳞指软珊瑚素B(scabralin B,2)是从鳞指软珊瑚Sinularia scabra中分离得到,值得一提的是,这是首次从海洋无脊椎动物中发现的具有过氧基团的杜松烷型倍半萜[11]。从龙牙草Agrimonia pilosaLdb.的镰刀菌属内生菌中分离得到龙牙草草醇 C(agripilol C,3)[12]。从灵芝属薄盖灵芝Ganoderma capense(Lloyd) D.A.中分离得到了薄盖灵芝醇(ganodermanol)D(4)、E(5)和F(6),其结构和绝对构型通过广泛的光谱分析、圆二色光谱(CD)和Mo2(AcO)4-诱导CD 确定[13]。从担子菌类桦附毛孔菌Trichaptum pargamenum(Fr.) G.Cunn.中分离得到桦附毛孔菌素A(trichapargin A,7)[14]。从真菌火木层孔菌Phellinus igniarius中分离得到12-羟基-α-杜松醇(12-hydroxy-α-cadinol,8)[15]。从菖蒲属藏菖蒲Acorus calamusRhizoma 的根茎中得到1,7(H)-3-杜松二烯-6α,10α-二醇 [1,7(H)-3-cadinadiene-6α,10α-diol,9][16]。从腐木菌褐芝小孔菌Microporus affinisHFG829 中分离得到了褐芝小孔菌三醇(microporotriol,10)[17]。从千年健Homalomena occulta(Lour.) Schott 的根状茎中分离得到了新的杜松烷型倍半萜,杜松烷-4β,5α,10α-三醇(cadinane-4β,5α,10α-triol,11),其结构进一步通过X-射线单晶衍射分析确定[18]。
1.2 木萝烷型
木萝烷型倍半萜的基本骨架是 (1R,6R,7S)-7-异丙基-4,10-二甲基双环 [4.0.4]癸烷,或它的对映异构体。近10年从自然界中分离得到的此类化合物约有23 个(12~34),其结构如图3所示。

图3 木萝烷型倍半萜结构Fig.3 Structures of muurolanes type sesquiterpenoids
从粘毛鼠尾草Salviaro borowskiiMaxim 中分离得到了 1 个新的木萝烷型杜松烷型倍半萜,(βR,1S,4αR,8αS)-1,2,4α,8α-四氢-β,4,7-三甲基-1-萘乙醇 [(βR,1S,4αR,8αS)-1,2,4α,8α-tetrahydro-β,4,7-
trimethyl-1-naphthalene ethanol,12][19]。从鳞指软珊瑚Sinularia scabra中分离得到了1 个此类化合物鳞指软珊瑚素A(scabralin A,13),化合物13 是首次从海洋无脊椎动物中发现的具有过氧基团的木萝烷型倍半萜[11]。从齿叶耳叶苔Frullania serrataGottsche 中分离得到耳叶苔酸(frullanic acid,14)和耳叶苔酸甲酯(frullanic acid methylester,15)2个木萝烷型倍半萜。它们的绝对构型通过运用含时密度泛函理论以及CD 激子手性方法对比实验和计算电子圆二色性光谱预测[20]。(1R,6S,7S)-1-羟基-杜松烷型-4,9-二 烯-8-酮 [(1R,6S,7S)-1-hydroxycadin-4,9-dien-8-one,16]是从中国濒危植物香木莲Manglietia aromaticaDandy 中分离得到1 个新的木萝烷型化合物[21]。从白腐菌Panus conchatus(Bull.:Fr.) Fr.中分离得到1 个新的木萝烷型倍半萜紫革耳酮A(panutorulon A,17)[22]。从担子菌类桦附毛孔菌Trichaptum pargamenum(Fr.) G.Cunn.中分离得到桦附毛孔菌素B(trichapargin B,18)[14]。从异形南五味子Kadsura heteroclita(Roxb.) Craib 的茎中分离得到2 个新的木萝烷型倍半萜,6α,9α,15-三羟基杜松烷-4-烯-3-酮(6α,9α,15-trihydroxycadinan-4-en-3-one,19)[23]、6α,9α-二羟基杜松烷-4-烯-3-酮(6α,9α-dihydroxycadinan-4-en-3-one,20)[24]。从真菌火木层孔菌Phellinus igniarius(L.:Fr.) Quél.中分离得到1 个新的木萝烷型倍半萜3α,12-二羟基-δ-杜松醇(3α,12-dihydroxy-δ-cadinol,21)[15]。从担子菌类桦附毛孔菌Trichaptum pargamenum(Fr.)G.Cunn.中分离得到了3 个木萝烷型倍半萜,(+)-(1R,3R,6S,7S,11R)-3,12-二羟基-α-木罗烯 [(+)-(1R,3R,6S,7S,11R)-3,12-dihydroxy-α-muurolene,22]、(+)-(1R,3R,6S,7S,11S)-3,12-二羟基-α-木罗烯 [(+)-(1R,3R,6S,7S,11S)-3,12-dihydroxy-α-muurolene,23]、(+)-(1R,3R,6S,7S,8R,11S)-3,8,12-三羟基-α-木罗烯 [(+)-(1R,3R,6S,7S,8R,11S)-3,8,12-trihydroxy-αmuurolene,24],其中化合物23 的绝对构型通过X-射线单晶衍射确定[25]。从鬼伞属辐毛小鬼伞Coprinellus radians(Desm.) Fr.的发酵液中分离得到了1 个杜松烷型倍半萜,辐毛小鬼伞醇(coprinol,25)[26]。从簇梨木Cleistochlamys kirkii(Benth.) Oliv的根皮中分离得到1 个新的苯并吡喃基杜松烷型倍半萜簇梨木醇(cleistonol,26)[27]。从艾叶Artemisia argyiLevl.et Vant.的内生菌绿木霉Trichoderma virensQA-8 中分离得到绿木霉杜松素 F(trichocadinin F,27)[28]。从真菌Montagnula donacina中分离得到了新的杜松烷型倍半萜类化合物,多纳新醇A(donacinol A,28)[29]。从海洋真菌Cadophora malorum中分离到了4 个羟基化硬孢子菌素衍生物,硬孢子菌素是1 种罕见的抗真菌、致孢子化的杜松烷型倍半萜,15-羟基核菌素(15-hydroxysclerosporin,29),12-羟基核菌素(12-hydroxysclerosporin,30),11-羟基核菌素(11-hydroxysclerosporin,31),和8-羟基核菌素(8-hydroxysclerosporin,32)[30]。从肉桂Cinnamomum cassiaPresl 中分离得到了2 个新的杜松烷型倍半萜,肉桂体(cinnamoid)B(33)和C(34)[31]。
选取2016年1月至2016年12月于本院实施消化内镜微创治疗的110例患者作为研究对象,按照数字随机法将患者分成两组,一组采用表面麻醉,为常规组,一组采用静脉麻醉,为实验组,每组55例患者。常规组患者年龄25~82岁,平均年龄(54.8±1.2)岁,其中有男性25例,女性30例;实验组患者年龄24~80岁,平均年龄(54.5±1.4)岁,其中有男性26例,女性29例。所有患者及其家属均同意参与本次研究,排除感觉功能异常的患者;排除存在语言功能障碍的患者;排除麻醉过敏患者,本实验获得了本院伦理委员会的批准,两组患者一般资料比较不存在统计学意义(P>0.05),可以进行比较。
1.3 布尔加烷型
布尔加烷型倍半萜的基本骨架是 (1R,6S,7S)-7-异丙基-4,10-二甲基双环 [4.0.4]癸烷,或它的对映异构体。在自然界中这类杜松烷型倍半萜比较少,近10年主要分离得到7 个(35~41),其结构如图4所示。
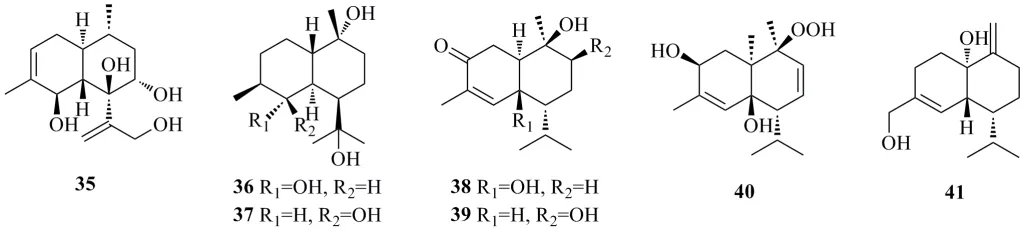
图4 布尔加烷型倍半萜结构式Fig.4 Structures of bulgaranes type sesquiterpenoids
从口蘑科植物液体培养的食用菌Strobilurus ohshimae中分离得到了新的杜松烷型倍半萜,斯托比醇L(strobilol L,35)[32]。从灵芝属薄盖灵芝中分离得到了2 个新的杜松烷型倍半萜薄盖灵芝醇(ganodermanol)G(36)和H(37)[13]。从海洋来源的真菌肉座菌Hypocrealessp.中分离得到了2个新的杜松烷型倍半萜,肉座菌萜烯(hypocreaterpene)A(38)和 B(39)[33]。从软珊瑚科印尼闪千手Heteroxenia fuscescens(Fam.Xeniidea) 中分离得到了 1 个过氧氢倍半萜,印尼闪千手萜烯 A(heterofusceterpene A,40)[34]。从真菌Montagnula donacina中分离得到了新的杜松烷型倍半萜类化合物,多纳新醇B(donacinol B,41),其结构通过光谱方法、X-射线单晶衍射和计算的方法确定[29]。
1.4 阿摩芬烷型
阿摩芬烷型倍半萜的基本骨架是 (1S,6S,7S)-7-异丙基-4,10-二甲基双环 [4.0.4]癸烷,或其对映异构体。近年来只分离得到了1 个此类型的倍半萜(42),其结构如图5所示。从泰国海绵Halichondriasp.中分离得到了新的阿摩芬烷型杜松烷型倍半萜,软海绵D(halichon D,42)[35]。

图5 阿摩芬烷型倍半结萜构式Fig.5 Structures of amorphanes type sesquiterpenoids
1.5 含苯环的杜松烷型倍半萜
在自然界中还存在着进一步芳香化的的杜松烷型倍半萜,结构如图6所示。以海滨锦葵Kosteletzkyavirginica(L.) Presl.的根茎为原料,从中得到了海滨锦葵素(virginicin,43)[36]。从冲绳软珊瑚Sinulariasp.中分离得到(1R,4S)-1-过氧氢-4-异丙基-1,6-二甲基-1,2,3,4-四氢化萘 [(1R,4S)-1-hydroperoxy-4-isopropyl-1,6-dimethyl-1,2,3,4-tetrahydronaphthalene,44],通过光谱分析和分子建模确定其结构[37]。从菊科植物旋复花异囊菊Heterotheca inuloidesCass.中分离得到新的杜松烷型倍半萜7-羟基-14-杜松烯醛(7-hydroxy-14-cadalenal,45)、(4R)-3,4-二氢杜松烯-15-羧酸 [(4R)-3,4-dihydrocadalen-15-oic acid,46],化合物45 通过X-射线单晶衍射确定结构,它的绝对构型主要通过比较电子俘获检测器(electrical conductivity detector,ECD)值以及通过使用来自氧原子的反常X-射线散射对Flack 参数进行完善[38]。从姜科植物土田七Stahlianthus involucratus(King ex Bak.) Craib ex Loesener 的根状茎中分离得到了6 个新的杜松烷型倍半萜土田七酚A~F(involucratusols A-F,47~52)。化合物47 的绝对构型是通过X-射线单晶衍射确定的,而在化合物49 的C-9,50 的C-9,52 的C-6 通过原位生成的 [Rh2(OCOCF3)4]的CD 数据和Mo2(OAc)4-原位诱导的CD 分析确定的。其中,化合物49 为48 在C-9 的立体异构体[39]。从口蘑科植物液体培养的食用菌Strobilurus ohshimae中分离得到了新的杜松烷型倍半萜,斯托比醇M(strobilol M,53)[32]。从莪术Curcuma phaeocaulisValeton 中分离得到了莪术杜松烷(phacadinane)C(54)和D(55),化合物54 是第1 个罕见的从姜科植物中提取到的4,5-裂环-杜松烷型倍半萜烯[40]。从黑葱花霉Periconiasp.中分离得到黑葱花霉 A(pericoterpenoid A,56),这是首次报道杜松烷型倍半萜在黑葱花霉中的存在[41]。从没药Commiphora myrrha(Nees) Engl.的树脂渗出液中分离到了具有神经保护作用的杜松烷型倍半萜,没药萜烯A-C(commiterpenes A-C,57~59)[42]。从异形南五味子的茎中分离得到2 个新的杜松烷型倍半萜,(+)-3,11,12-三羟基菖蒲烯 [(+)-3,11,12-trihydroxycalamenene,60]和(-)-3,10,11,12-四羟基-菖蒲烯 [(-)-3,10,11,12-tetrahydroxy-calamenene,61],这是首次从异形南五味子中分离得到具有去氢白菖烯核心骨架的杜松烷型倍半萜[24]。从没药的树脂渗出物中分离得到3 个新的杜松烷型倍半萜,没药素A-C(commiphoins A-C,62~64)[43]。从土坛树Alangium salviifolium(L.f.) Wanger.精油中分离得到了1 个新型的杜松烷型倍半萜,(-)-7,8-二羟基卡醛 [(-)-7,8-dihydroxy-calamenal,65][44]。从黄槿Hibiscus tiliaceusL.中发现了杜松烷型倍半萜,黄槿萜烯(hibiscusterpene)I(66)和S(67),其中,化合物66 的绝对构型是通过使用X-射线单晶衍射确定的[45]。从菊科泽兰属紫茎泽兰Ageratina adenophora(Sprengel) R.M.King &H.Robinson 的根部分离得到了1 个新的杜松烷型倍半萜,1,6-二羟基-1-异丙基-4,7-二甲基-3,4-二氢萘-2(1H)-酮[1,6-dihydroxy-1-isopropyl-4,7-dimethyl-3,4-dihydronaphthalen-2(1H)-one,68][46]。从橄榄科植物没药树Resina Commiphora的树脂没药中分离得到了没药烯(commiphorene)A(69)和B(70),化合物70是1 个新型的杜松烷型倍半萜,具有全新的碳骨架,1 个额外的碳通过碳碳双键连接在杜松烷骨架上[47]。从艾叶的内生菌绿木霉中分离得到杜松烷型倍半萜,绿木霉杜松素(trichocadinin)B(71)、C(72)和G(73),其中,化合物71 和72 的结构和绝对构型是通过X-射线晶体分析得到的[28]。从金粟兰属安徽金粟兰Chloranthus anhuiensisK.F.Wu 中分离得到了 1 个新的杜松烷型倍半萜,莪术松烷 E(phacadinane E,74),它是1 个罕见的4,5-裂环-杜松烷型倍半萜[48]。从郁金Curcuma aromaticaSalisb.根茎的95%乙醇提取物中得到2 个新的杜松烷型倍半萜,温郁金酮(curcujinone)A(75)和B(76),它们的绝对和相对构型通过量子化学密度泛函理论和13C-NMR 化学位移的含时密度泛函理论计算,ECD 光谱和特定的光学旋转确定[49]。从橄榄科植物没药树的树脂没药中分离得到了没药烷 H(commiphorane H,77)[50]。从红花木莲Manglietia insignis(Wall.) Blume 的叶和茎中分离得到了1 个新的含苯环的杜松烷型倍半萜,红花木莲素 D(maninsigin D,78)[51]。
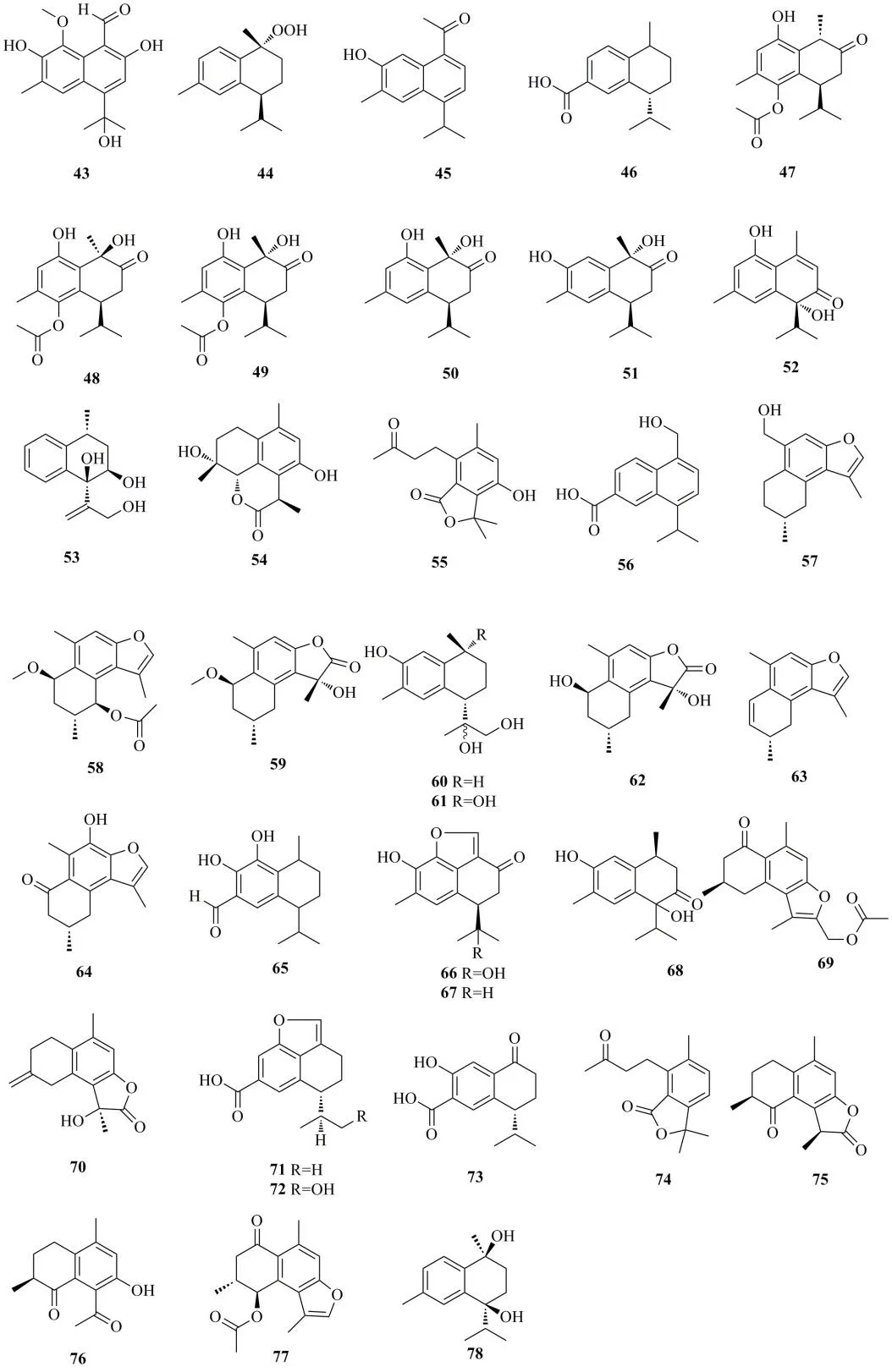
图6 含苯环杜松烷型倍半萜的结构式Fig.6 Structures of cadinane-type sesquiterpenes with benzene
1.6 环氧及含过氧基的杜松烷型倍半萜
环氧及含过氧基的杜松烷型倍半萜的环氧通常可出现在1、4 位,2、14 位,3、4 位,4、5 位,4、6 位,5、11 位,6、8 位,8、12 位之间。结构如图7所示。

图7 含环氧及过氧基杜松烷型倍半萜的结构Fig.7 Structures of cadinane-type sesquiterpenes with epoxy or peroxy group
从欧亚旋覆花Inula britannicaLinnaeus 中首次分离的得到1个新的罕见的12,7-杜松烷型倍半萜内酯,(5R,6R,7R,9S,10S)-9-羟基-杜松烷-3(4),11(13)-二烯-12,7-内酯 [(5R,6R,7R,9S,10S)-9-hydroxycadina-3(4),11(13)-dien-12,7-olide,79][52]。从冲绳软珊瑚Sinulariasp.中分离得到了1个新的杜松烷型倍半萜,(2S,4αS,5S,8R)-8-异丙基-2,5-二甲基-3,4,5,6,7,8-六氢化-2H-2,4α-环二氧萘 [(2S,4αS,5S,8R)-8-isopropyl-2,5-dimethyl-3,4,5,6,7,8-hexahydro-2H-2,4αepidioxynaphthalene,80][37]。从担子菌类Stereum cf.sanguinolentumBCC 22926 中分离得到5 个新的杜松烷型倍半萜内酯(stereumins Q-U,81~85)[53]。从没药属红没药Commiphora erythraea(Ehrenb.)Engl.树脂中分离得到1 个新的杜松烷型倍半萜内酯红没药树脂烯酮(agarsenone,86),通过实验和计算的旋光色散谱和电子圆二色谱的比较,确定了其相对构型和绝对构型[54]。从灵芝属薄盖灵芝中分离得到了3 个新的杜松烷型倍半萜薄盖灵芝醇A~C(ganodermanols A-C,87~89),它们的结构和绝对构型通过广泛的光谱分析、CD 和Mo2(AcO)4-诱导CD 确定[13]。从纫革菌属 CCTCC AF 2012007(Stereum sp.CCTCC AF 2012007)中分离得到6 个新的杜松烷型倍半萜,韧革菌素K-P(stereuminK-P,90~95),化合物94 很可能是由93 在提取过程中非自然形成的。化合物90~92 和95 的结构和90的绝对构型进一步通过X-单晶衍射确定[55]。从角孢离褶伞Lyophyllum transforme中分离得到2 个新的杜松烷型倍半萜,角孢离褶伞酮A(lyophyllone A,96)和角孢离褶伞三醇A(lyophyllanetriol A,97)[56]。从黄槿中发现了3个杜松烷型倍半萜,黄槿萜烯T~V(hibiscusterpenes T-V,98~100)[45]。
从烟色韧革菌Stereum gausapatumATCC 60954 中分离得到了1 个新的杜松烷型倍半萜,斯托比醇N(strobilol N,101)[57]。从大米发酵的真菌小孔硬孔菌Rigidoporus microporus(Sw.) Overeem中分离得到杜松烷型倍半萜,小孔硬孔菌酮B(rigidoporone B,102)[58]。从千年健的根状茎中分离得到了新的杜松烷型倍半萜,5(11)-环氧杜松烷-4β,5β,10β,11-四醇 [5(11)-epoxycadinane-4β,5β,10β,11-tetraol,103][18]。
1.7 含羰基的杜松烷型倍半萜
含羰基的杜松烷型倍半萜,其羰基一般存在于2、3、5、8 和9 位。近10年提取分离得到的该类型的化合物结构如图8所示。
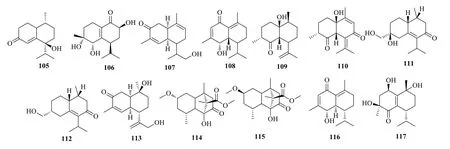
图8 含羰基杜松烷型倍半萜的结构式Fig.8 Structures of cadinane-type sesquiterpenes with carbonyl group
从益智Alpinia oxyphyllaMiq.的干燥成熟果实益智95%乙醇水提取物的醋酸乙酯萃取部位中分离得到1 种新的15-降碳杜松烷型倍半萜类化合物益智烯酮H(oxyphyllenone H,105)[60];从其正丁醇萃取部位中也分离得到1 个新的降碳的杜松烷型倍半萜3α,4α,8β-三羟基-3β-甲基-6β-异丙基-14-降碳杜松烷倍半萜(3α,4α,8β-trihydrocy-3β-methyl-6β-isopropyl-14-decarbonizing cadinane-type sesquiterpene,106)[61]。
从芸香科九里香Murraya exoticaL.Mant.的干燥叶中分离得到了1 个新的含羰基的杜松烷型倍半萜 (4αS,5S,8αR)5-[(1R)-2-羟基-1-甲基乙基]-3,8-二甲基-4α,5,6,8α-四氢-2(1H)-萘酮 [(4αS,5S,8α)-5-[(1R)-2-hydroxy-1-methylethyl]-3,8-dimethyl-4α,5,6,8αtetrahydro-2(1H)-naphthalenone,107][62]。从石菖蒲Acorus tatarinowiiSchott 中分离得到石菖蒲素B(tatarinowin B,108)[63]。从广藿香Pogostemon cablin(Blanco) Benth.地上部分分离得到了(+)-(1S,4R,6S,7R,10S)-1-羟基杜松烷-12-烯-5-酮 [(+)-(1S,4R,6S,7R,10S)-1-hydroxycadinan-12-ene-5-one,109][64]。从莪术中分离得到了新的杜松烷型倍半萜,莪术杜松烷倍半萜B(phacadinane B,110)[40]。从海洋真菌Leptosphaerulina Chartarumsp.3608 中分离得到2 个新的杜松烷型倍半萜化合物,来普托萜烯(Leptoterpene)A(111)和B(112),这是对Leptosphaerulina Chartarumsp.3608 的首次化学成分研究。新化合物绝对构型的测定通过单晶X 射线衍射和电子圆二色性数据分析[65]。从大米发酵的真菌小孔硬孔菌Rigidoporus microporus(Fr.) Overh 中分离得到杜松烷型倍半萜,小孔硬孔菌酮 A(rigidoporone A,113)[58]。
从奇南沉香Aquilaria malaccensisLam.的干燥木质部中分离得到了2 个新型的杜松烷型倍半萜,沉香酮(malacinone)A(114)和B(115),具有6/6/5 三元环系统。它们的结构通过各种光谱数据分析确定,它们的绝对构型通过ECD 分析确定,并提出了1 个关于化合物114 和115 的生物合成途径[66]。从石菖蒲中分离得到了石菖蒲素A(tatarinowin A,116)[67]。从内生真菌棒曲霉Aspergillus clavatus中分离得到了1 个新的杜松烷型倍半萜,棒曲霉酮D(aspergillusone D,117)[68]。
1.8 含羧基的杜松烷型倍半萜
羧基可存在于12、14、15 位,因此常在2、14位,5、12 位,6、12 位,8、12 位可形成内酯。结构如图9所示。
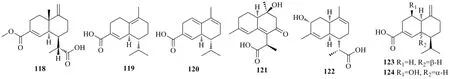
图9 含羧基杜松烷型倍半萜的结构Fig.9 Structures of cadinane-type sesquiterpenes with carboxyl group
从姜科高良姜Alpinia officinarumHance 根茎中得到1 个新的此类型的杜松烷型倍半萜高良姜萜烯A(alpiniaterpene A,118)[69]。从菊科植物旋复花异囊菊中分离得到2 个新的杜松烷型倍半萜(4R,10S)-δ-杜松萜烯-15-羧酸 [(4R,10S)-δ-cadinen-15-oic acid,119]、(4R,10S)-3,4,7,10-四氢荜澄茄烯-15-羧酸 [(4R,10S)-3,4,7,10-tetrahydrocadalen-15-oic acid,120],化合物119 和120 通过X-射线单晶衍射确定结构,它们的绝对构型主要通过比较ECD值以及通过使用来自氧原子的反常X-射线散射对Flack 参数进行完善[38]。另外,Ma 等[40]从莪术中分离得到新的含羧基的杜松烷型倍半萜,莪术杜松烷A(phacadinane A,121)。从担子菌类桦附毛孔菌Trichaptum pargamenum(Fr.) G.Cunn.中分离得到了3α-羟基青蒿酸(3α-hydroxyartemisinic acid,122),其绝对构型是通过X-射线晶体分析得到的[25]。从艾叶的内生菌绿木霉中分离得到了2 个杜松烷型倍半萜,绿木霉杜松烷素(trichocadinin)D(123)和E(124)。其中,化合物123 的结构和绝对构型通过X-射线晶体分析得到[28]。
1.9 苷类
杜松烷型倍半萜也有少数糖基取代的产物,一般可见于3、9 位。结构如图10所示。

图10 苷类杜松烷型倍半萜的结构Fig.10 Structures of cadinane-type sesquiterpene glycosides
从山茱萸Cornus officinalisSieb.et Zuuc.的果实中分离得到5 个新型且稀有的杜松烷型倍半萜苷类化合物,山茱萸杜松苷A-E(cornucadinosides A-E,125~129),新的化学结构连同它们的绝对构型在光谱数据的基础上,通过对计算和实验的ECD进行得到,这些结构拥有1 个萘骨架,在山茱萸中首次报道[70]。从伞形科窃衣属小窃衣Torilis japonicaDecandolle 果实分离得到1 个新的杜松烷型倍半萜苷类化合物杜松烷小窃衣苷(cadinatoriloside,130),在光谱分析的基础上对其进行了结构鉴定[71]。从菊科植物Chromolaena laevigata(Lam.) R.M.King &H.Rob 的地上部分分离得到了1 个新的不同寻常的糖基化杜松烷型倍半萜,泽兰葡萄糖苷(chromolaevigone glucoside,131)[72]。从防己科青牛胆属中华青牛胆Tinospora sinensis(Lour.) Merr.中分离得到了2 个新的杜松烷型倍半萜糖苷,中华青牛胆苷(tinosinenoside)G(132)和H(133),其中化合物132 的绝对构型通过含时密度泛函理论、ECD 和原位二鉬CD 法确定[73]。
1.10 杜松烷型二聚体
此外,还从自然界中发现了杜松烷型二聚体,常在C-2、9'位,3、9'位,3、3'位,9、14'位聚合。结构如图11所示。
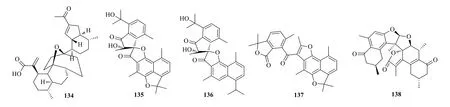
图11 杜松烷型二聚体的结构Fig.11 Structures of dimeric cadinane-type sesquiterpenoids
从青蒿Artemisia annuaL.中分离得到了1 个新型的杜松烷型倍半萜二聚体,青蒿体A(arteannoide A,134)。其具有1 个罕见的6,8-dioxabicyclo [3.2.l]octan-7-one 环系统。它的结构由核磁共振波谱、电子圆二色谱和X-射线单晶衍射技术确定[74]。从土田七分离得到了三个倍半萜烯二聚体,土田七酮(involucratustones A-C,135~137),这3 个杜松烷型倍半萜含有多个相邻的四元环。化合物135 和136是首次在天然产物中出现的1-oxaspiro [4.4]nonane核全取代的杜松烷型倍半萜二聚体,化合物137 是1 个新型的3′,4′-裂环-杜松烷型二聚体[75]。从橄榄科植物没药树的树脂中分离得到1 个杜松烷型倍半萜二聚体,没药酮A(commiphoratone A,138),它的结构通过光谱、计算和结晶等方法确定为马鞍形[76]。
1.11 其他
除上述类型外,还有其他的一些杜松烷型倍半萜,如图12所示。肖世基等[77]从金钗石斛Dendrobium nobileLindl.茎中分离得到1 个新的杜松烷型倍半萜,经鉴定为δ-杜松萜烯-12,14-二醇(δ-cadinen-12,14-diol,139)。从冲绳软珊瑚Sinulariasp.中分离得到了1个新的杜松烷型倍半萜,(1R,4R,4αR)-1-过氧氢-4-异丙基-1,6-二甲基-1,2,3,4,4α,7-六氢萘 [(1R,4R,4αR)-1-hydroperoxy-4-isopropyl-1,6-dimethyl-1,2,3,4,4α,7-hexahydronaphthalene,140],通过光谱分析和分子建模确定其结构[37]。从姜科植物土田七的根状茎中分离得到了新的杜松烷型倍半萜土田七醇G(involucratusol G,141),化合物的平面结构是通过光谱数据和HRMS 的基础上确定的,化合物141 的1,2-二醇基是通过原位生成的 [Rh2(OCOCF3)4]的CD 数据和Mo2(OAc)4-原位诱导的 CD 分析确定的[38]。从樟科植物Nectandra amazonumNEES.的叶中分离得到2 个杜松烷型倍半萜rel-(4S,6S)-杜松烷-1(10),7(11)-二烯[rel-(4S,6S)-cadina-1(10),7(11)-diene,142]、rel-(1R,4S,6S,10S)-杜松烷-7(11)-烯-10-醇 [rel-(1R,4S,6S,10S)-cadin-7(11)-en-10-ol,143],其结构通过光谱技术和离散傅里叶变换分子建模确定[78]。从泰国海绵Halichondriasp.中分离得到3 个新的杜松烷型倍半萜,软海绵C(halichon C,144)、4-表-软海绵C(4-epi-halichon C,145)和软海绵G(halichon G,146)[35]。从软珊瑚Sinularia vanderlandi中分离得到 1 个新的杜松烷型倍半萜,万得兰定(vanderlandin,147)[79]。从真菌Montagnula donacina中分离得到新杜松烷型倍半萜类化合物,多纳新醇C(donacinol C,148),其结构通过光谱、X-射线单晶衍射和计算的方法确定[29]。
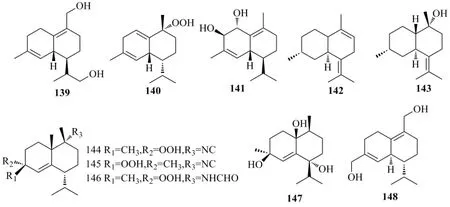
图12 其他杜松烷型倍半萜的结构Fig.12 Structures of other cadinane-type sesquiterpenoids
2 药理作用
2.1 抗菌作用
化合物43 对大丽轮枝菌具有较强的杀灭作用,可用于棉花黄萎病的预防[36]。化合物44、80 和140,通过金黄色葡萄球菌、沙门菌和大肠杆菌证实,具有抗菌活性[37]。化合物56 对黑曲霉菌具有中等的抗菌活性,对白念珠菌具有弱的活性[41]。化合物25对白色念球菌ATCC 18804、白色念球菌SC-5314、新型隐球菌ATCC 13690 和酵母菌ATCC 2345进行了抗真菌测试,其最低抑菌浓度(minimum inhibitory concentration,MIC)值为128.0 μg/mL,与两性霉素B(MIC=0.25 μg/mL)和酮康唑(MIC=1.0 μg/mL)相比显示出了轻度的抗真菌活性[26]。化合物27、71 和72 显现出了抗菌和抗真菌的活性[28]。
2.2 抗肿瘤作用
化合物13 对人乳腺癌MCF-7 细胞、人结直肠癌WiDr 细胞、人髓母细胞瘤Daoy 细胞、喉癌HEp2细胞系展示出弱的细胞毒性[11]。化合物44、80 和140对人结肠癌HCT116细胞具有弱的细胞毒性[37]。化合物4 对HCT116 细胞表现出中等的细胞毒性活动,半数抑制浓度(half maximal inhibitory concentration,IC50)值为16.6 μmol/L[13]。化合物7对人结肠癌SW480 细胞显示出了微弱的抑制活性,IC50值为24.8 μmol/L[14]。倍半萜烯二聚体135和136对人类骨肉瘤U-2OS 细胞和人肝癌SMMC-7721 细胞显现出强的生长抑制作用(IC50为6.78~10.27 μmol/L)[75]。化合物43 对MCF-7 细胞和人卵巢癌OVK-18 细胞具有中等细胞毒性[34]。化合物69 对人的正常细胞产生可接受的细胞毒性而对肿瘤细胞产生高的选择性,特别是HepG2 细胞[47]。化合物144和145 对于人急性T 淋巴细胞白血病MOLT-3 细胞系显现出中等的细胞毒性(IC50=20.9、29.0 μmol/L)。其中,化合物 145 对 HepG2 和MDA-MB-231 显示中等细胞毒性,IC50值分别为24.3、19.3 μmol/L[35]。化合物117 对2 种细胞株(MCF-7、A549 细胞)均显示出细胞毒性,IC50值分别为5.9、0.2 μmol/L[68]。
2.3 抗炎作用
化合物13 能显著抑制促炎症诱导一氧化氮合酶蛋白的积累,是首个具有抗炎活性的海洋天然杜松烷型倍半萜[11]。化合物44、80 和140,具有抗炎的活性[37]。化合物45 在十四烷酸佛波醋酸酯(TPA)诱导的小鼠耳肿胀抗炎实验具有抗炎的活性,IC50>228 μg/耳[38]。化合物121 和110 二者的抑制效应通过对LPS-活化的巨噬细胞一氧化氮产量进行了评估。化合物121 和110 对一氧化氮的产生有较强的抑制作用[40]。倍半萜烯二聚体137,具有显著的抗炎活性[75]。化合物113 对小鼠单核细胞RAW264.7 巨噬细胞产生一氧化氮的抑制活性进行了评估(IC50>25 μmol/L)[58]。
2.4 其他
化合物107 通过体外实验证明该化合物能够使H2O2应激损伤后心肌细胞存活率明显增高[62]。化合物12 通过体外实验证明其具有神经保护作用[19]。化合物16 对蛋白酪氨酸磷酸酶1B(protein tyrosine phosphatase-1B,PTP1B)具有中等抑制作用,可用于治疗二型糖尿病和肥胖症[21]。具有神经保护作用的化合物57~59 在SH-SY5Y 细胞中对MPP+所致全身的神经细胞死亡的神经保护效应[42]。杜松烷型倍半萜苷类化合物126~130,除了128 外,所有的化合物对α-糖苷酶都表现出显著的体外抑制效果[70]。化合物62 和64 具有明显的抗阿尔茨海默病的作用[43]。化合物8 和21 具有抗苯肾上腺素引起的血管紧张的作用,在30 mmol/L 时血管舒张率分别为11%、7%[15]。化合物65 抗氧化活性和对酪氨酸酶抑制活性很强[44]。化合物101 对线虫病具有显著的效果,在200 μg/mL 时在36 h 时的死亡率为75.8%[57]。杜松烷型倍半萜二聚体138 能以浓度依赖的方式明显阻碍脂质新陈代谢[76]。化合物32 对3T3-L1 小鼠脂肪细胞具有较弱的脂肪积累抑制作用[30]。
3 结语
杜松烷型倍半萜数量较多,主要分布于菊科、姜科、唇形科、杉科、柏科以及苔藓等植物之中,在抗菌、抗炎、抗肿瘤、抗疟疾、抗氧化等方面具有较好的活性,尤其在抗疟疾方面深为世人所瞩目。
杜松烷型倍半萜结构极其多样化,有的既具有芳香环,亦具有环氧、过氧基或羰基等基团,化合物分类越来越趋于复杂化。
杜松烷型倍半萜结构复杂,活性多样,引起了越来越大的天然产物学者深入研究。同时,杜松烷型倍半萜手性中心多,绝对构型难以确定,也吸引了众多有机化学、计算化学学者的关注和挑战,为各种复杂化合物的绝对构型确定带来了希望。
——青蒿素

