珠江口及其邻近海域赤潮物种的生物多样性研究进展
姚艳欣 , 陈楠生
(1. 中国科学院海洋研究所 海洋生态与环境科学重点实验室, 山东 青岛 266071; 2. 青岛海洋科学与技术试点国家实验室 海洋生态与环境科学功能实验室, 山东 青岛 266071; 3. 中国科学院海洋大科学研究中心, 山东青岛 266071; 4. 中国科学院大学, 北京 100049)
珠江又名粤江, 是长江以南最大的河流, 也是中国的第三大河流。珠江口水域系指21°30′~22°49′N,113°30′~114°30′E的海域[1], 包括珠江的河口湾, 毗邻粤港澳三地, 面积约为210 km2[1]。珠江口海域浮游植物按照地理位置可以划分为河口类、近岸类和外海类三大生态类群[2]。珠江口海域由于受到珠江水系径流汇入的影响, 加上广东沿岸流、南海暖流和黑潮的影响, 具有丰富的营养盐。该海域浮游植物物种多样性较高, 物种组成跨度大, 其中丰水期以淡水种和广温广盐种为主, 而枯水期以广温广盐种为主[2]。
赤潮(red tide)是一种由海洋藻类、原生动物或细菌在水体中过度繁殖或聚集导致海水变色的全球性海洋生态异常现象, 目前国际上更多称其为有害藻华(harmful algal blooms, HABs)[3]。近年来珠江流域经济迅速发展, 广东省城市人口急剧增加, 沿岸地区大量的工业和农业废水直接排放进珠江口, 废水中含有大量的有机物、重金属、无机盐和污染物, 导致珠江口海域出现严重的污染。另外, 珠江口海域大规模的水产养殖业也是其重要的污染物来源。这些污染源导致珠江口海域的营养盐浓度不断升高, 尤其是大量的含氮营养盐, 使得水体富营养化趋势日益严重, 成为赤潮暴发的主要原因[2]。另外, 压舱水导致的外来有毒有害藻类的引入、核电站的温排水影响及底层休眠孢囊的存在可能也促成了珠江口海域赤潮暴发[4-5]。
赤潮研究的方法有很多, 主要包括利用形态和分子方法对赤潮物种进行分类、追踪和生理生化分析, 研究赤潮的时空分布特征以及与环境相互作用的关系[6-8], 并对其进行防治研究[9-12]。近年来, 各种组学技术不断应用于赤潮研究中, 对物种鉴定、发现新种以及对赤潮生物的组成、分布、动态变化等方面都有很大的提升。除此之外, 遥感技术、地理信息系统(geography information system, GIS)以及现场调查的方式进行调查, 建立赤潮监测数据库, 为赤潮防治奠定基础[13-18]。本文综述了珠江口及其邻近海域浮游植物, 重点分析了珠江口及其邻近海域的赤潮物种的生物多样性研究进展, 为研究珠江口浮游植物物种和赤潮物种组成和动态变化提供了帮助,对解读宏组学以及宏条形码分析结果、分析珠江口浮游植物和赤潮物种的动态变化提供了基础。
1 珠江口及其邻近海域的赤潮
1980年以来, 随着广州经济的高速发展, 污水的排放量增加, 珠江口及其近海海域污染严重, 海域内营养盐含量迅速升高, 成为有害藻华的高发地带, 暴发频次逐渐升高。1982年11月上旬南海内伶仃洋浅滩首次报道了甲藻赤潮[5]。李永振在1990—1991年在广东沿岸河口海域采集浮游植物样品, 并结合近几年广东沿岸河口海域采样分析资料, 报道了47种硅藻赤潮物种[19]。据统计, 1987—2017年珠江口及其近海海域共发生了454次赤潮[4]。珠江口及其近海海域一年四季均有赤潮发生, 其中春季赤潮暴发频率最高, 其次是夏秋冬季节。4月和8月为甲藻赤潮暴发的高峰期, 其中4月主要赤潮物种为夜光藻(Noctiluca scintillans)、米氏凯伦藻(Karenia mikimotoi)、裸甲藻(Gymnodiniumspp.)、双胞旋沟藻(Cochlodinium geminatum)和多环旋沟藻(Cochlodinium polykrikoides), 8月多暴发锥状斯氏藻(Scrippsiella trochoidea)赤潮, 5月为硅藻赤潮暴发的高峰期, 其中中肋骨条藻(Skeletonema costatum)被认为是赤潮暴发的主要原因种。秋冬季节多暴发定鞭藻赤潮, 其中棕囊藻(Phaeocystisspp.)占主导[4]。王汉奎等人分析了2002年6月珠江口海域无纹环沟藻(Gyrodinium instriatum)赤潮的生长消亡过程, 认为海域富营养化是诱发此次赤潮的主要原因[20]。双胞旋沟藻赤潮多次出现在珠江口海域。2006年10月至11月和2009年10月, 珠江口海域暴发了双胞旋沟藻赤潮, 研究人员发现富营养化水体和适宜其生长的温度促使了该藻赤潮的暴发[21]。在双胞旋沟藻赤潮发生后期, 海水中出现双胞旋沟藻休眠期的群体细胞[22]。暴发赤潮的原因很复杂, 其中营养盐浓度的升高是此次赤潮暴发的重要原因之一[16]。双胞旋沟藻赤潮暴发时会产生致畸物视黄醛, 严重危害浮游动物[23]。双胞旋沟藻赤潮对卤虫幼体也有一定的毒害作用[24]。
2 珠江口及其邻近海域的航次调查
通过对公开发表的航次调查数据分析, 我们总结了1985—2014年间22个针对珠江口及其邻近海域的浮游植物和赤潮物种调查(附表1)。从空间上来看, 这些航次调查站位集中于珠江口及其邻近海域,即18°~24°N, 109°~119°E范围内, 几乎涵盖了珠江口及沿岸海域所有的赤潮暴发区, 共描述了几百种浮游植物物种以及几十种重要的赤潮物种, 体现了珠江口及邻近海域浮游植物和赤潮物种的生物多样性。从时间上来看, 航次调查时间跨度越长, 尽管大部分调查集中在夏季, 我们仍然可以通过它们了解该海域浮游植物物种的组成和变化, 并了解赤潮物种时空变化, 对珠江口以及沿岸海域浮游植物物种和赤潮物种的研究有重要的参考价值。
3 珠江口及其邻近海域的浮游植物
3.1 珠江口及其邻近海域浮游植物全长18S rDNA序列统计分析及优势浮游物种分析
针对珠江口的22个航次调查总共报道了428种浮游植物, 包括硅藻门(Bacillariophyta)270种, 甲藻门(Dinophyta)130种, 绿藻门(Chlorophyta)9种, 蓝藻门(Cyanophyta)8种, 定鞭藻门(Coccolithophore)5种,金藻门(Chrysophyta)4种, 着色鞭毛藻门(Cryptophyceae)1种和裸藻门(Euglenophyta)1种(附表2)。
在这428种浮游植物物种中, 有120种的全长18S rDNA序列(>1 600 bp)可以在公共数据库NCBI中查到, 不到总数的三分之一(28.0%), 表明珠江口及其邻近海域浮游植物物种中绝大多数物种还没有得到分子分析。
利用数据库中查找到的全长18S rDNA序列构建系统进化树发现珠江口及其邻近海域的浮游植物聚类到6个门, 其中以硅藻门物种最多(72个), 其次是甲藻门(36个)。在珠江口及其邻近海域历年的航次调查中出现频率最高的浮游植物包括中肋骨条藻、菱形海线藻(Thalassionema nitzschioides)、洛氏角毛藻(Chaetoceros lorenzianus)、柔弱伪菱形藻(Pseudonitzschia delicatissima)、铁氏束毛藻(Trichodesmium thiebautii)、红海束毛藻(Trichodesmium erythraeum)和叉状角藻(Ceratium furca)(图1b、1c)。
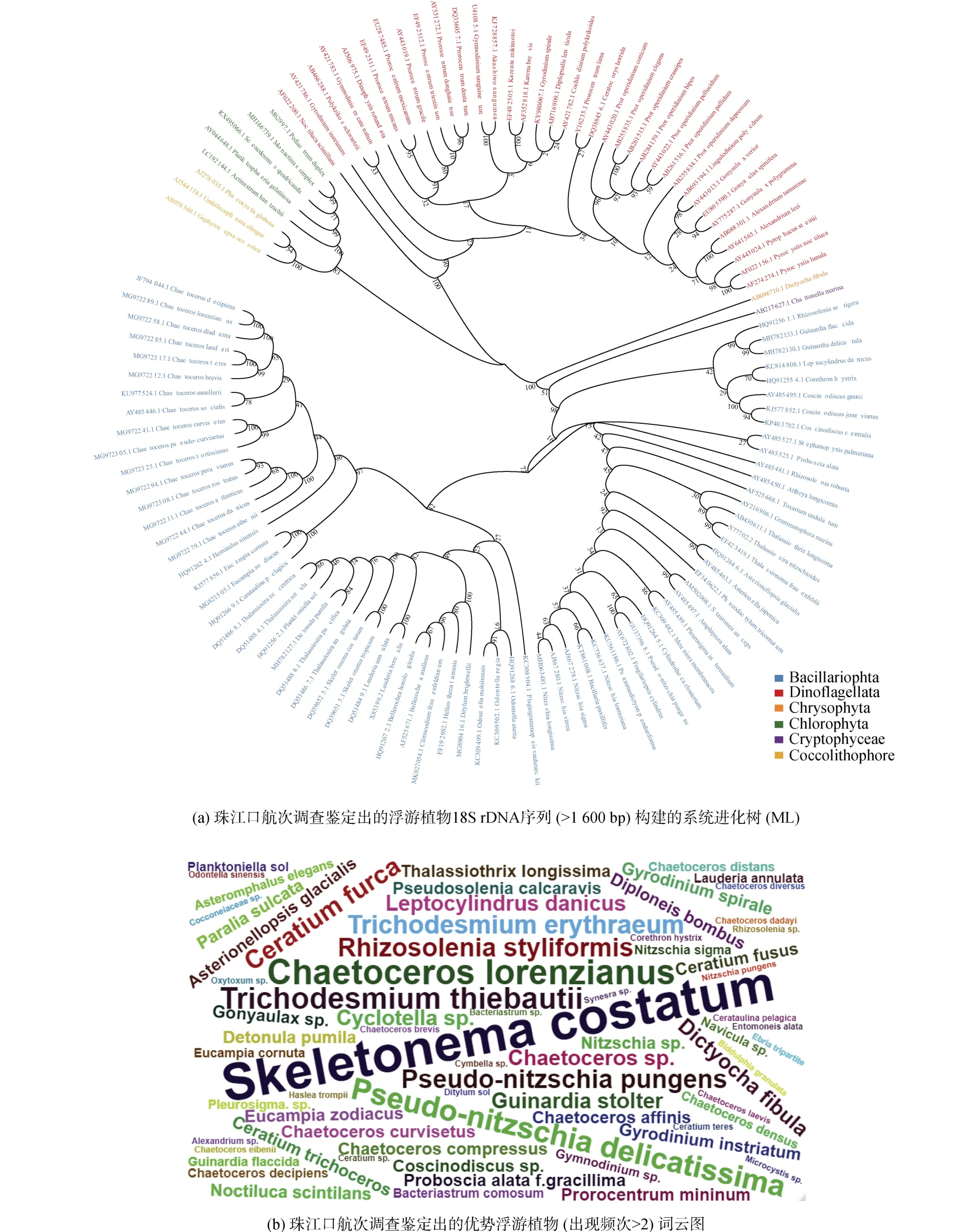
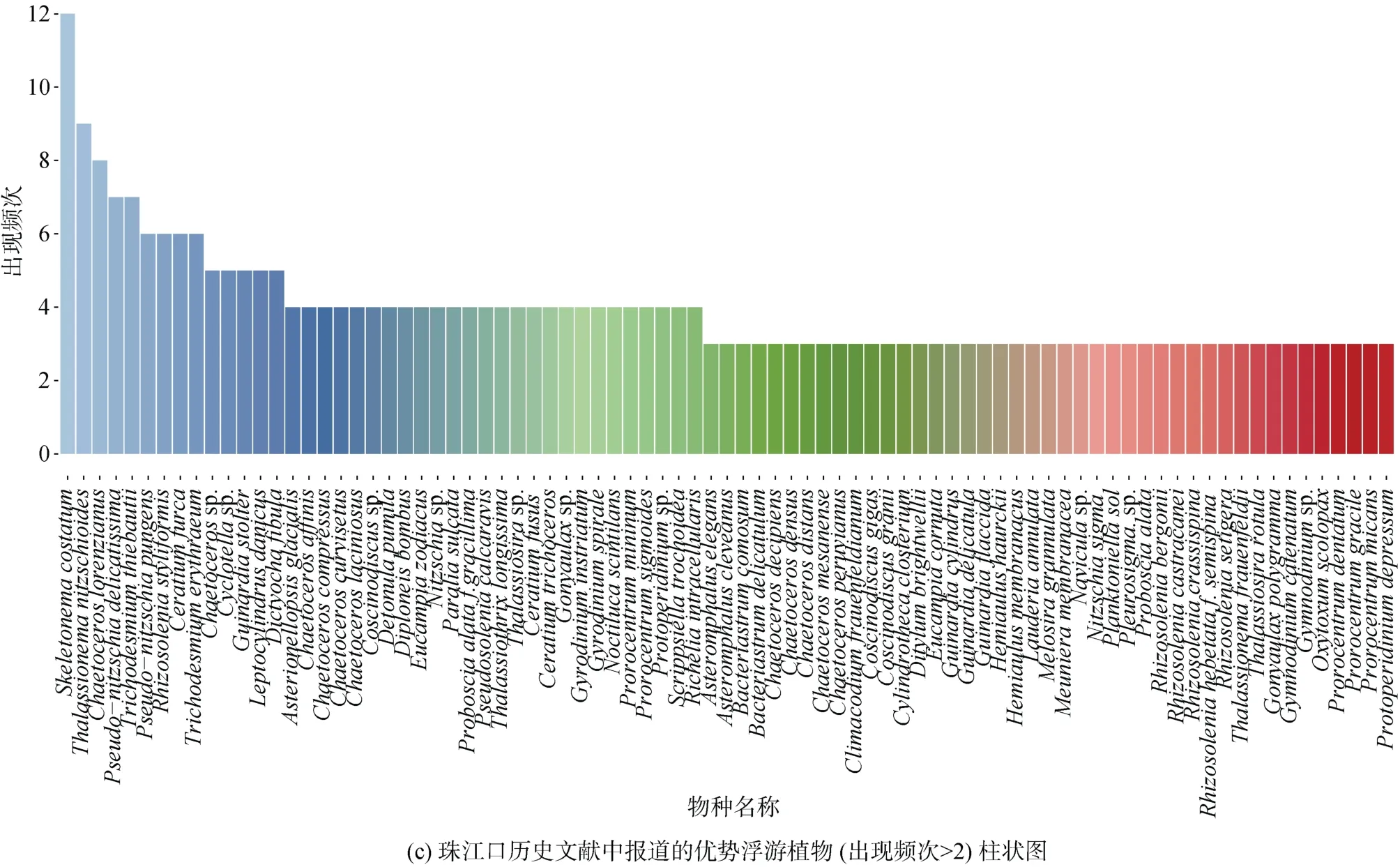
图1 珠江口浮游植物物种组成Fig. 1 Composition of phytoplankton species in the Pearl River Estuary
3.2 珠江口及其邻近海域航次调查结果的比较分析
通过对航次调查结果的比较分析(图2a)发现,不同航次鉴定出的浮游植物物种组成差异较大, 较多浮游植物物种只在单一航次中都被调查到, 并且没有任何一种浮游植物物种出现在所有的航次调查结果中。造成这种调查结果差异的原因有多种, 比如航次调查季节存在差异, 航次调查时采样范围不尽不同, 航次调查针对的浮游植物对象具有不同的聚焦, 对浮游植物的分析方法不同等。
硅藻和甲藻是浮游植物物种中的主要组成部分,赤潮物种中多数种类也以硅藻和甲藻为主。有研究表明珠江口海域优势物种趋于简单, 小型硅藻的数量逐渐增加, 优势度显著提升[25]。本文利用22个航次中甲藻和硅藻的数目以及各自相对所占的比例来跟踪分析历年来珠江口及其邻近海域甲藻和硅藻物种数目的相对变化。结果表明, 历年来珠江口及其邻近海域中甲藻和硅藻物种相对数目并没有显示出明显的变化规律(图2b)。不过, 上面的分析可能不足以充分揭示甲藻和硅藻物种数目的相对变化规律, 因为这些航次各自独立, 不同航次采样目的也不相同,航次采样季节的不同, 物种分类及分析标准存在差异, 并不能准确跟踪珠江口浮游植物相对丰度的变化。基于形态的分析方法与基于分子生物学(比如比较宏条形码分析[26])的分析方法的联合使用, 将促进珠江口及其邻近海域浮游植物组成的更加准确的判断、鉴定和分析。
莱茵哈德·根策尔成长于德国黑森林里的小城市弗莱堡。年轻的时候,他是德国最好的标枪运动员之一,甚至能与国家队一起备战1972年慕尼黑奥运会。现在,他的“标枪”掷向了更远的地方。
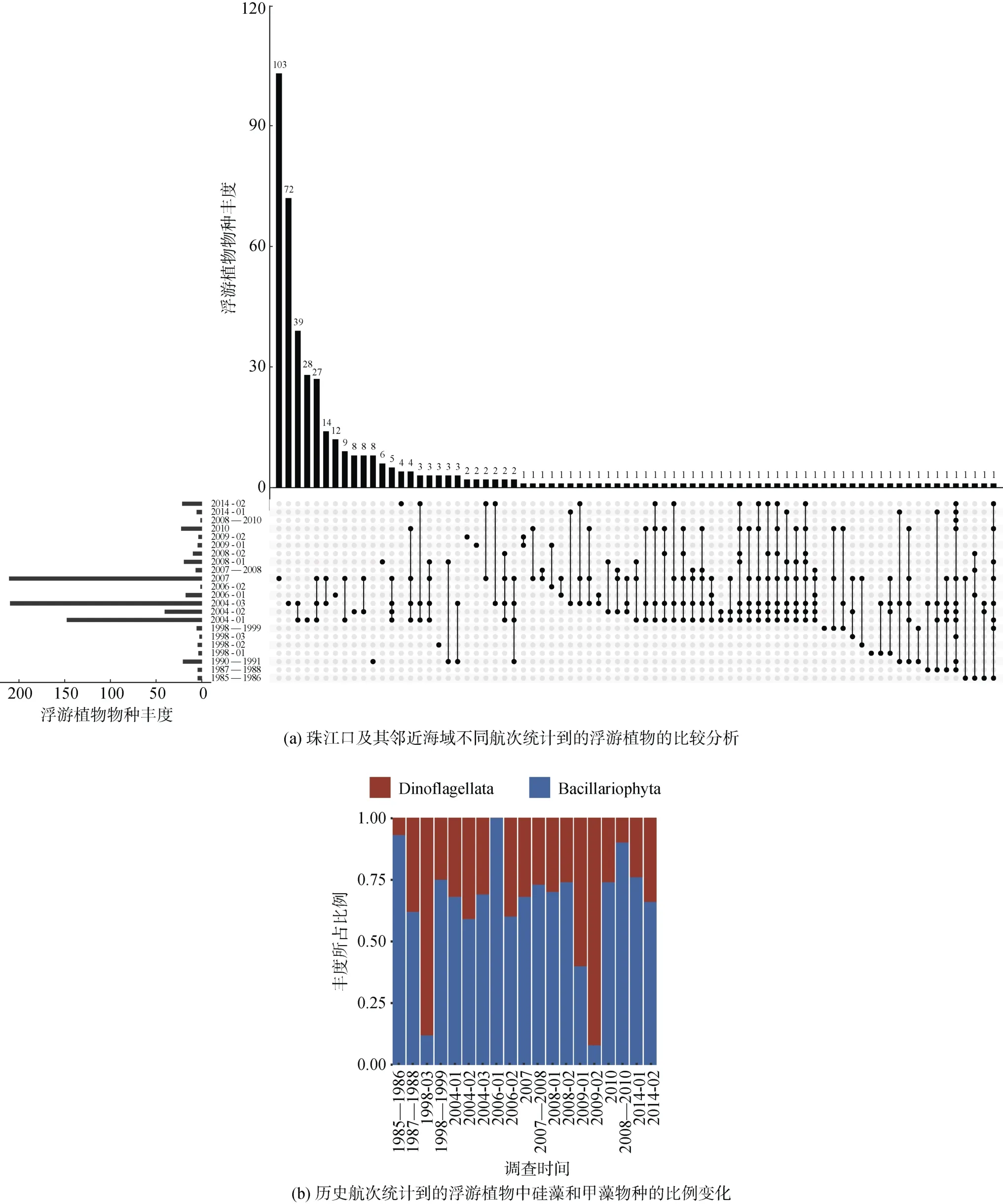
图2 珠江口浮游植物组成的历史变迁Fig. 2 Historical changes in the composition of phytoplankton species in the Pearl River Estuary
4 珠江口及其邻近海域常见赤潮物种
珠江口及其附近海域的这些航次调查共鉴定了5个门54种常见的赤潮物种, 包括硅藻门25种、甲藻门24种、金藻门2种、蓝藻门2种以及着色鞭毛藻门1种(表1)。这些物种为珠江口及其邻近海域常见的赤潮物种, 且在珠江口及其邻近海域暴发的次数较多。不同航次报道的赤潮物种的种类和数目有显著差异, 在图3a中可以发现, 不同航次调查结果差异较大, 并且没有一个赤潮物种出现在所有航次调查中(图3a)。其中最常见的赤潮物种有中肋骨条藻、洛氏角毛藻、柔弱伪菱形藻、铁氏束毛藻、梭角藻(Ceratium fusus)、尖刺伪菱形藻(Pseudonitzschia pungens)、红海束毛藻、叉状角藻、丹麦细柱藻(Leptocylindrus danicus)和微小原甲藻(Prorocentrum mininum)(图3b、3c)。此外, 米氏凯伦藻、夜光藻(Noctiluca scintilans)、双胞旋沟藻和球形棕囊藻(Phaeocystis globosa)也是珠江口海域经常暴发的赤潮物种。

表1 珠江口历史航次赤潮物种名录Tab. 1 HAB species reported in the Pearl River Estuary in historical expeditions
续表
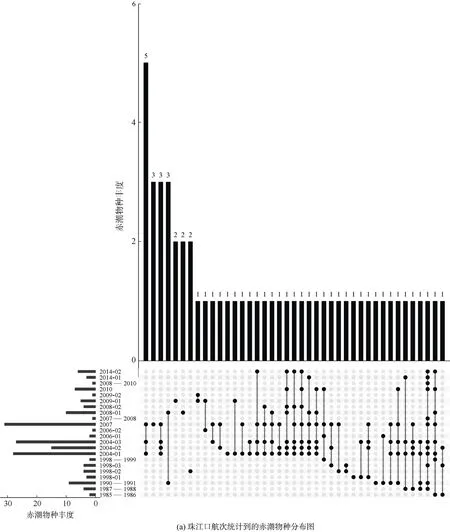
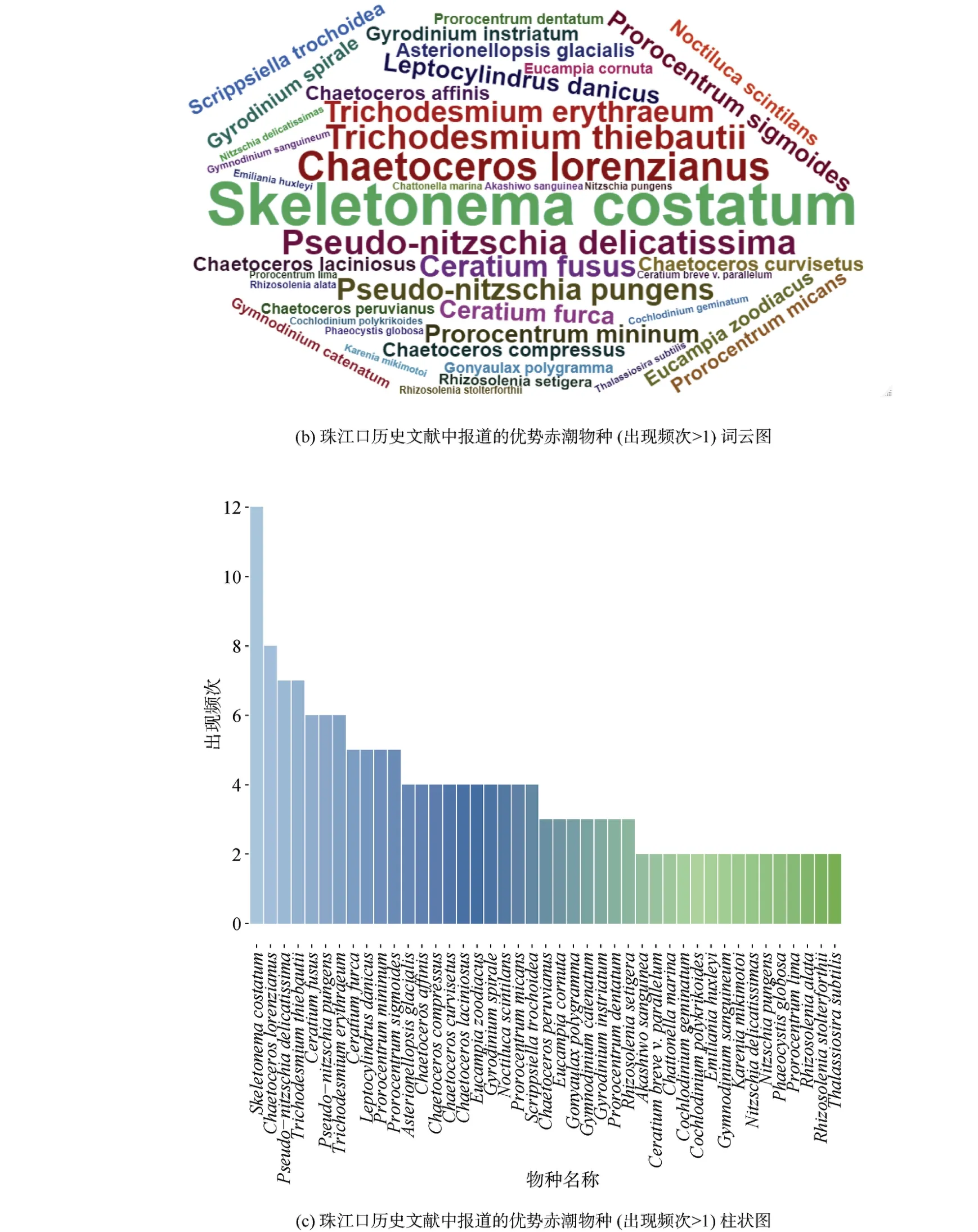
图3 珠江口赤潮物种组成(出现频次>1)Fig. 3 Composition of phytoplankton species in the Pearl River Estuary
4.1 中肋骨条藻
中肋骨条藻隶属于硅藻门(Bacillariophyta), 中型硅藻纲(Mediophyceae), 海链藻目(Thalassiosirales), 骨条藻科(Skeletonemataceae), 骨条藻属(Skeletonema), 细胞为圆柱形或透镜形, 直径大小6~7 μm,壳面鼓起, 相邻细胞间通过刺连成长链, 无毒, 属于浮游广布种, 是广温广盐的典型代表[19]。分布于朝鲜、阿拉斯加湾、白令海、黑海、欧洲沿岸等海区, 中国包括珠江口海域的各个海区均有出现[19]。该种是珠江口—大亚湾海域秋季优势种, 细胞总量可以达到238万个/m3[19]。中肋骨条藻也是川山群岛海域秋季优势种, 细胞总量可以达到12万个/m3[19]。自1990年以来, 中肋骨条藻在大鹏湾水域多次引发赤潮[19]。2002年6月在珠江口发生了无纹环沟藻和中肋骨条藻的双相赤潮[27]。据统计, 自1980—2017年间, 硅藻中的主要赤潮种类为中肋骨条藻, 有记录的中肋骨条藻赤潮为43起, 其中时间分布中春季发生次数最多, 珠江口附近暴发次数最多[4]。中肋骨条藻在珠江口分布格局呈现为由内河口向外河口递增的趋势。此研究还表明中肋骨条藻的丰度和硅酸盐呈现显著的正相关关系, 和磷酸盐呈现显著的负相关关系, 两者都是影响珠江口海域中肋骨条藻丰度的重要因素[28]。有研究者利用中肋骨条藻作为赤潮代表种, 浒苔作为绿潮代表种, 表明在未来全球气候变暖和海洋酸化的环境下, 赤潮比绿潮的影响更大[29]。研究者通过对日本海域中分离得到的中肋骨条藻全基因组序列分析发现, 该种有与氧化应激反应和细胞分裂素相关的多拷贝基因, 并在暴发赤潮时得到表达[30]。
4.2 双胞旋沟藻
双胞旋沟藻隶属于甲藻门(Dinophyta), 横裂甲藻纲(Dinophceae), 裸甲藻目(Gymnodiniales), 裸甲藻科(Gymnodiniaceae), 和旋沟藻属(Cochlodinium)[75],有游泳细胞和成对细胞两种形态, 细胞近椭圆形,背腹略扁, 细胞长宽为30~40 μm, 色素体为网状黄褐色[21]。该藻有休眠期细胞, 细胞呈卵形或深褐色,通过黏液相连成群, 在赤潮暴发期间不产生毒素[21]。2006年4月在广东珠海桂山岛附近海域首次暴发了双胞旋沟藻赤潮, 同年10至11月期间又暴发了两次该种引发的赤潮[21]。双胞旋沟藻易与同属的多环旋沟藻比较容易混淆, 关于该藻赤潮暴发的种源问题还有待进一步的研究[21]。2009年10月至11月再次暴发大规模的该藻赤潮, 富营养化水平高是此次赤潮暴发的基础。2018年11月期间在珠江口暴发双胞旋沟藻赤潮, 在赤潮期间, 浮游植物群落结构发生了改变, 优势浮游物种的数量明显下降。同时赤潮期间视黄醛的含量升高, 视黄醛可导致水生生物发生畸变, 对水生生物具有潜在的威胁[31]。
4.3 夜光藻
夜光藻隶属于甲藻门(Dinophyta), 横裂甲藻纲(Dinophceae), 环沟藻目(Gymnodiniales), 夜光藻科(Noctiluceae)和夜光藻属(Noctiluca), 是一种分布于世界沿岸的广布型低盐发光种, 是完全异养型浮游生物, 同时具有植物的属性和动物的功能[32]。夜光藻利用分泌黏液的触手将食物送入泡口。水体中营养盐含量的增加促进其他浮游生物的生长来间接促进夜光藻的繁殖[32]。夜光藻的大量繁殖并不直接依赖于水体的高营养环境, 不能单一地将水体富营养化程度作为该藻赤潮暴发的标准[33]。长江口及其邻近海域、南海海域都是夜光藻暴发的高发海域, 自20世纪30年代首次暴发夜光藻赤潮以来, 赤潮范围不断扩大, 直至覆盖了中国近海所有的海域[34]。夜光藻在暴发赤潮时, 其空间分布格局受到生物因素和物理因素的综合影响, 但是主要受到风、潮汐和海流等物理过程的影响[35]。一方面, 夜光藻会产生氨, 在碱性条件下危害有鳃的水生动物[36]; 另一方面, 夜光藻还会分泌大量黏液, 导致鱼类以及其他水生生物死亡[37]。此外, 在赤潮衰亡之后, 细胞内会有大量的内噬细菌释放到水体中, 这些内噬细菌会产生有毒物质, 威胁水生生物的生存[32]。田媛等收集了1980—2017年广东沿岸赤潮发生数据, 结果发现珠江口大鹏湾海域多发生夜光藻赤潮, 其中在223起甲藻赤潮中就有77起是夜光藻赤潮[4]。
4.4 球形棕囊藻
球形棕囊藻隶属于定鞭藻门(Haptophyta), 颗石藻纲(Coccolithophyceae), 棕囊藻目(Phaeocystales),棕囊藻科(Phaeocystaceae)和棕囊藻属(Phaeocystis),是广温广盐性藻类[38], 能产生溶血性毒素, 是全球海洋广泛分布的赤潮物种[39]。该种有复杂的异型生活史, 存在有单细胞和胶质囊体两种形态[40]。在富营养条件下能够暴发性增殖形成赤潮, 大量胶质囊体的形成不仅有效抵御细菌、病毒侵入及浮游动物的摄食[41], 在赤潮发生过程中产生溶血性毒素、二甲基硫化物(DMSP/DMS)及硫丙酸等化合物毒害海洋生物[42]。球形棕囊藻温度适应范围明显高于其他藻类,能够在短时间内暴发赤潮, 严重影响了海洋生态系统的结构和功能, 同时对海洋渔业以及养殖业造成了巨大损失。1997年10月中国东南沿海首次暴发球形棕囊藻赤潮, 覆盖范围广, 从福建泉州、厦门以南直至广东汕尾海域, 持续时间长达6个月, 经济损失严重。据不完全统计, 从1997年至2017年20年间,共暴发球形棕囊藻赤潮50起, 面积超过10 000 km3,严重影响了海洋生态系统正常的结构和功能。球形棕囊藻赤潮多发生在汕头汕尾海域, 据统计, 在1980—2017年间, 广东省沿岸共发生该藻赤潮39起[4]。此外, 球形棕囊藻能够产生溶血性毒素, 严重危害海洋中鱼类以及其他海洋生物的生存[39]。我国对球形棕囊藻赤潮防治的方法有很多, 主要有生物方法、化学方法、光催化法以及黏土矿物絮凝法等, 此外有研究者利用海洋放线细菌对有毒球形棕囊藻囊体进行有效地移除[43]。
4.5 米氏凯伦藻
米氏凯伦藻隶属于甲藻门(Dinophyta), 横裂甲藻纲(Dinophceae), 裸甲藻目(Gymnodiniales), 凯伦藻科(Kareniaceae)和凯伦藻属(Karenia), 藻体呈单细胞,细胞背腹扁平, 呈宽卵圆形。细胞长20~30 μm, 宽16~30 μm, 侧面宽度10~15 μm, 长略大于宽[44]。细胞上壳部为半球形或宽圆锥形。下壳部底部中央有凹陷,为两浅裂片状。下壳部大于上壳部[44]。该藻为游泳生活, 主要分布在温带和热带海域, 是一种常见的有毒有害赤潮物种, 在广东省沿岸春季为多发季节[4]。1980年, 该藻首次在香港海域暴发赤潮, 1998年3月中旬至4月中旬, 在珠江口海域暴发了一次严重的米氏凯伦藻赤潮, 持续时间近30 d, 造成了大规模的鱼类和贝类死亡, 并且值得注意的是1998年在广东省沿岸海域就发生了8起米氏凯伦藻赤潮[4]。2002年,该藻首次在东海暴发赤潮[45]。2001年至2006年间, 我国共发生米氏凯伦藻赤潮59起[46]。米氏凯伦藻赤潮是我国近海鱼毒性赤潮的典型代表种, 该藻能产生细胞毒素和溶血性毒素等一系列毒素, 这些毒素会造成大量鱼类死亡。此外, 还会影响浮游动物的生长发育、摄食、产卵等生命活动。比如, 米氏凯伦藻能影响部分敏感贝类幼体的早期发育, 可致其幼体和成体死亡[44]。有相关研究表明, 虽然米氏凯伦藻的代谢产物有毒, 但是却为抗肿瘤药物以及新药的设计提供了潜在的可能[46]。
4.6 洛氏角毛藻
4.7 铁氏束毛藻
铁氏束毛藻隶属于蓝藻门(Cyanobacteria), 蓝藻纲(Cyanophyceae), 颤藻目(Oscillatoriales), 微鞘藻科(Microcoleaceae)和束毛藻属(Trichodesmium), 是全球性广布型蓝藻, 普遍存在于热带、亚热带和温带海域中。藻丝体放射状排列成球形或中部扭曲成绳状, 束中藻丝体的排列较乱, 但顶端游离。藻丝直径6~16 μm, 长与宽相等或2~8倍于宽。在太平洋和大西洋海域经常会形成优势物种, 被认为是东海和黄海黑潮流系的指示种[50]。铁氏束毛藻是一种非常重要的固氮蓝藻, 无异形胞。在贫营养海域中, 该种生物量占主导, 成为海洋初级生产力和全球氮循环过程的重要组成部分。该藻在暴发赤潮时会产生毒素, 导致海洋中鱼类、虾类和双壳类等海洋生物的死亡[51]。中国海域固氮蓝藻中铁氏束毛藻成为东海低氧区和邻近海域的优势物种, 并且细胞丰度在8月份最高。透明度会影响铁氏束毛藻的生长, 温度会促进其生长, 而盐度对其生长的影响不显著[52]。在本文统计的22个航次的历史文献中, 该藻共发生过7次赤潮。
5 主要结论与展望
本文通过对珠江口及其邻近海域历史航次资料整理, 主要有以下几点总结:
1) 本文综合了1985—2014年间22个航次调查结果, 共整理了428种浮游植物物种, 其中硅藻270种,甲藻130种, 绿藻9种, 蓝藻8种, 定鞭藻5种, 金藻4种, 着色鞭毛藻1种和裸藻1种。这表明珠江口海域浮游植物物种组成丰富, 多样性较高。
2) 我们共统计了54种赤潮物种, 其中硅藻25种,甲藻24种, 定鞭藻2种, 蓝藻2种, 着色鞭毛藻1种。其中暴发频率最高的赤潮物种为中肋骨条藻, 其次是洛氏角毛藻和柔弱伪菱形藻。珠江口及其邻近海域甲藻和硅藻赤潮物种数不相上下, 有些甲藻赤潮物种,比如双胞旋沟藻和米氏凯伦藻, 一旦暴发赤潮, 其危害程度远远大于硅藻赤潮物种, 应该引起充分的重视。分析发现珠江口及其邻近海域硅藻和甲藻的相对组成在1985—2014年间没有显著变化。不过, 由于航次调查结果分析时的方法有限以及各个航次采样目的可能不同等原因, 此结论会存在一定的误差, 需要结合将来的数据进一步核实。
3) 通过分析比较历年的航次结果数据可以发现,航次之间报道的物种丰度以及物种多样性方面还是存在一定的差距, 可能是因为航次调查时间、海域,以及对样品的处理方式存在不同, 但是最主要的原因是物种鉴定方法存在一定的局限性, 最初航次调查时利用传统的形态学鉴定方法会遗漏许多隐存物种, 相对降低了物种多样性。
4) 对珠江口历年航次中统计到的浮游植物物种构建进化树时发现, 数据库中并不是所有的物种都有18S rDNA的分子标记, 并且单个物种的代表性分子标记(如18S rDNA, 28S rDNA, ITS,cox1,rbcL)种类不全面, 限制了基因组宏条形码分析结果的解读和分析。
因此, 基于以上几点结论, 我们建议:
1) 对于珠江口及其邻近海域赤潮高度暴发海区,增加对航次采样的频率, 结合遥感技术、GIS以及以往的赤潮数据库对赤潮暴发时间和海域进行及时预测, 避免造成严重的生态灾害和经济损失。
2) 对浮游植物物种进行系统分析, 补充相应的18S rDNA的分子标记序列, 并且丰富分子标记的种类, 特别是对于高度频发的赤潮物种, 丰富数据库,支撑宏条形码分析方法对赤潮物种进行解读和分析。近年来, 分子分析方法迅速发展, 基于DNA分子标记扩增和测序的宏条形码分析方法(metabarcoding analysis)逐渐应用到野外样本的研究中, 并已取得很多有益的成果。比如, 有研究者将形态学观察和基于18S rDNA V2-V3区的高通量测序分析相结合, 发现黄海和东海海域的寄生性甲藻在高通量测序方法中占优势, 却在形态学研究中被忽略[53], 可见分子分析方法能够弥补传统形态学研究的不足。通过采用具有高分辨率和高特异性的分子生物学方法, 同时结合传统镜检鉴定方法, 对数据进行深入准确的分析, 全面揭示自然样本中物种的组成及相对丰度, 从而系统了解珠江口及其邻近海域浮游植物尤其是赤潮物种的详细信息, 丰富珠江口及其邻近海域赤潮物种数据库数据, 进而对赤潮暴发时间进行准确预测和预报, 对赤潮物种进行准确的鉴定和分析, 推进赤潮研究领域更进一步。

