液质联用法测定掺有复原乳的巴氏杀菌乳中的糠氨酸
周鑫,王雪松,谷守国,张淼怡,葛凯,郑百芹*
1. 唐山市食品药品综合检验检测中心(唐山 063000);2. 河北省农产品质量安全检测技术创新中心(唐山 063000)
牛奶等乳制品具有很高的营养价值,在世界各地都有消费[1]。一些乳企使用奶粉溶解在水中制成复原乳,将其冒充生鲜乳作为原料生产加工成商品奶出售给消费者,但未加复原乳标识,进而损害消费者利益[2]。糠氨酸是在美拉德反应早期阶段形成的化合物,而生鲜乳中缺乏糠氨酸[3-4];浓缩牛奶和奶粉通常是通过热处理获得,糠氨酸质量分数的变化受到乳品及生产加工过程中热处理程度的影响,因而糠氨酸可用于评价乳品的热加工程度[5]。NY/T 939—2016也将糠氨酸作为巴氏杀菌乳和UHT灭菌乳中复原乳鉴定的重要指标之一[6]。
检测液态奶中糠氨酸的方法较多,其中包括液相色谱法[7-9]、紫外分光光度法[10]、液质联用法[11-12]、毛细管电泳法[13]等,这些测定方法均能对液态奶中的糠氨酸进行准确的定量分析。试验针对不同品牌的奶粉进行溶解,分别以不同比例掺入生鲜乳中,经巴氏杀菌,使用液相色谱串联质谱对杀菌后的乳液进行糠氨酸含量的测定,旨在应用该方法提升对于复原乳掺入生鲜乳的比例下限的辨识度。
1 材料与方法
1.1 仪器与试剂
Waters H-Class超高效液相色谱仪(美国Waters公司);API 4000 Q trap三重四级杆质谱仪(美国AB公司);Kjeltec8400凯氏定氮仪(丹麦Foss公司);干燥箱(上海齐欣科学仪器有限公司,DHG-9240A);固相萃取柱:PLS小柱(200 mg/6 mL,Dikma公司);微孔滤膜(0.22 μm,Dikma公司)。
标准品糠氨酸(CAS号19746-33-9,德国Iris公司);牛奶和奶粉样品(市售);甲醇、甲酸、乙腈(色谱纯,Fisher公司);其余试剂为国产优级纯;试验用水为自制超纯水(电阻率18.25 MΩ·cm)。
1.2 标准溶液配制
准确称取适量糠氨酸对照品,用3 mol/L盐酸溶解并定容,配制成50 mg/mL的糠氨酸储备液,在-18 ℃条件下保存。使用时,根据需求稀释成合适浓度。
1.3 样品处理
称取不同品牌的奶粉各25 g,分别加入180 mL 45℃超纯水,充分溶解,回复至室温备用。分别在生鲜乳中掺入0,5%,10%,15%,20%,40%,60%,80%和100%的复原乳,充分混匀[14-15]。将样品置于63℃水浴中预热30 min,后置于75 ℃水浴中30 s,回复至室温备用[16]。
1.4 超高效液相色谱法测定糠氨酸
参照NY/T 939—2016测定糠氨酸。
1.5 液质联用法测定糠氨酸
准确吸取2.00 mL试样于耐热耐压螺口试管中,加入6.00 mL 10.6 mol/L盐酸溶液,封闭试管,在110 ℃烘箱中加热水解16 h。待试管冷却至室温后,摇匀水解液并过滤,收集滤液备用。用3 mL甲醇和3 mL水活化、平衡固相萃取柱,取1.0 mL滤液过柱上样,用2.0 mL水洗脱,收集洗脱液并定容到2.0 mL,取0.5 mL洗脱液,用甲醇稀释100倍,取适量过膜待上机。
色谱柱,ACQUITY BEH HILIC液相色谱柱(50 mm×2.1 mm,1.7 μm,美国Waters公司);流速0.3 mL/min;柱温40 ℃;进样量5 μL。流动相A,0.1%甲酸水溶液;流动相B,乙腈。洗脱方式为梯度洗脱,洗脱条件:0~0.5 min,5% A;0.5~1.0 min,5% A升至45% A;1.0~2.2 min,保持45% A;2.2~2.3 min,45%A下降到5% A;2.3~3.5 min,保持5% A。
离子源,电喷雾(ESI+);检测方式,多反应监测(MRM);雾化气(GS1)40 psi;辅助气30 psi(GS2);碰撞气(CAD),Medium;源温550 ℃;喷雾电压(IS)5 000 V;入口电压(EP)10 V。糠氨酸监测离子对和碰撞能量(CE)、去簇电压(DP)参数见表1。

表1 糠氨酸的选择离子及碰撞能量
1.6 水解液中蛋白含量测定
参照GB 5009.5—2016测定蛋白含量。
2 结果与讨论
2.1 液质联用法基质效应考察
基质效应是样品中除分析物以外的组分对分析物的分析过程造成的干扰和影响。在液相色谱串联质谱的离子源中,受到基质中其他组分竞争电离的影响,目标化合物的电离程度往往会受到抑制,相应值下降。分别使用溶剂和空白基质配制标准系列浓度分别上机检测,利用线性回归标准曲线斜率,评价基质效应(ME),如式(1)所示。
ME=(slopem/slopes-1)×100% (1)式中:ME为基质效应;slopem为基质标标准曲线斜率;slopes为溶剂标标准曲线斜率。计算ME的数值,根据其范围判断基质效应的大小程度。ME=-27.5%(见图1和表2),表明目标化合物离子化受到抑制,并属于中等基质效应[17]。为消除或减小基质效应给试验定量分析带来的误差,采用基质标对牛奶样品进行定量分析。
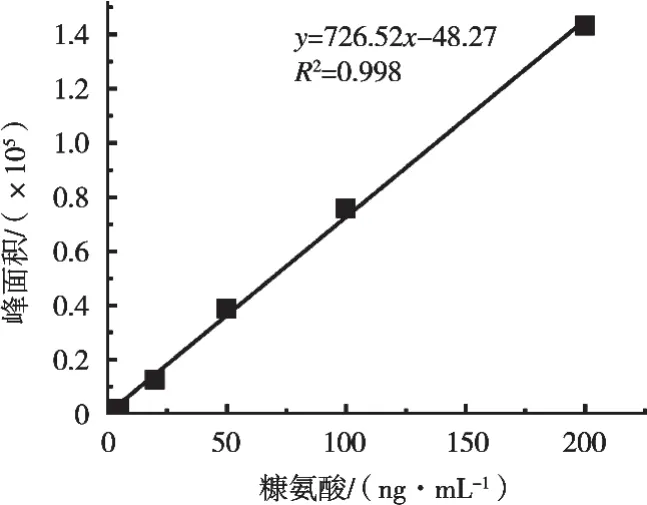
图1 有机溶剂配制糠氨酸标准曲线图
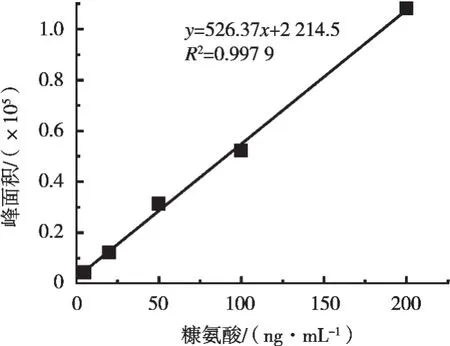
图2 空白基质配制糠氨酸标准曲线图
2.2 液质联用法与液相法测定糠氨酸结果比较
采用NY/T 939—2016中超高效液相色谱法和试验介绍的液质联用法对糠氨酸定量分析进行比较,2种方法的糠氨酸特征峰色谱图见图3和图4。结果显示,糠氨酸在2种检测方法中均有较好的峰型,这有助于对糠氨酸进行准确定量分析。
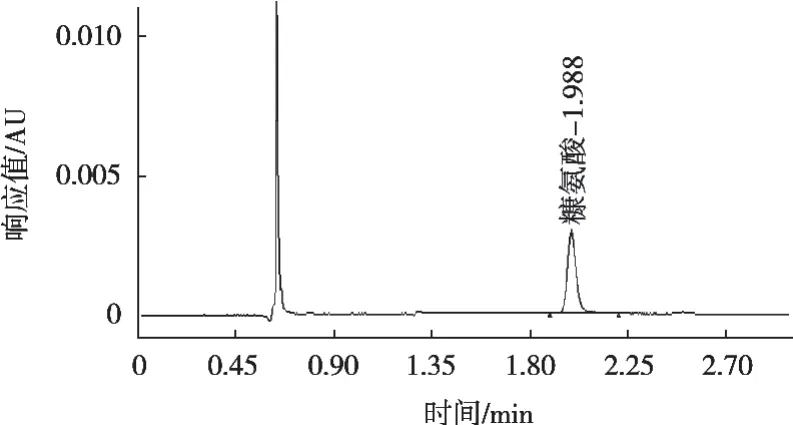
图3 糠氨酸标准溶液(2 μg/mL)色谱图(UPLC)

图4 糠氨酸标准溶液(0.1 μg/mL)MRM色谱图
选取同一超高温灭菌乳样品,分别用超高效液相色谱法和液质联用法对糠氨酸进行测定分析,比较2种方法的测定结果,2组数据之间没有显著性差异,如表2所示。说明试验所应用的液质联用法测定糠氨酸是稳健、可靠的。

表2 超高效液相法和液质联用法测定糠氨酸方差分析
2.3 巴氏杀菌乳中的复原乳测定
选取不同品牌的奶粉N、奶粉A、奶粉L,加水溶解为复原乳。将得到的3种品牌奶粉的复原乳按照0,5%,10%,15%,20%,40%,60%,80%和100%的比例添加到生鲜乳中,经过巴氏杀菌加热,使用液质联用法对处理后的样品糠氨酸参数的测定,结果见图4和表3。
一般来说,生鲜乳和巴氏杀菌乳中的糠氨酸含量较低,不高于15 mg/100 g蛋白质[5],试验中3种品牌复原乳添加0点的巴氏杀菌乳的数值分别10.08,10.45和9.93 mg/100 g蛋白质,与文献中数值范围一致,没有显著性差异(p=0.769),说明同一未添加复原乳的生鲜乳在经过巴氏杀菌后,在批次间没有差异,加热过程和测定方法稳定。
由图5可知,随着生鲜乳中复原乳掺入比例增大,糠氨酸含量呈线性升高,掺入比100%时,即复原乳经巴氏杀菌加热后的糠氨酸含量最高,3种复原乳N、A、Y中糠氨酸含量分别为254.84,190.99和188.40 mg/100 g 蛋白质,差异主要来源于奶粉本身糠氨酸的含量及奶粉的存储时间[18],致使掺入复原乳N的样品组形成的拟合曲线斜率要大于另两组。
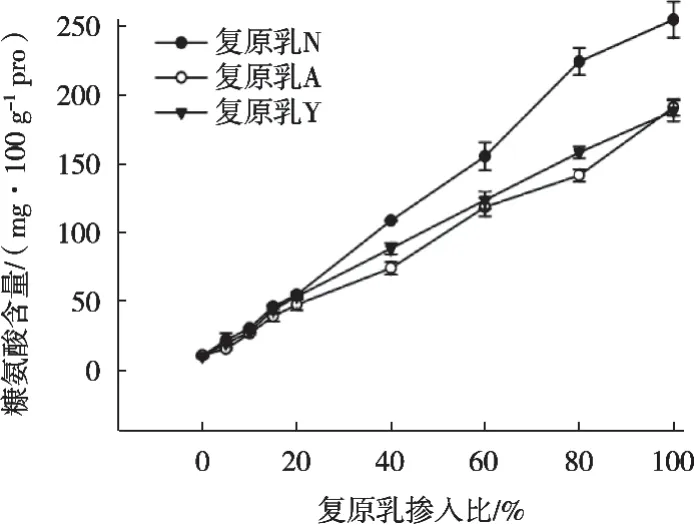
图5 掺入不同比例复原乳的巴氏杀菌乳糠氨酸含量
在复原乳N、A、Y每个掺入比设定点做3个平行重复试验,测定糠氨酸含量,并求出其平均值及标准差,利用方差分析考察掺入复原乳比例对糠氨酸测定值的影响程度,如表3所示。通过方差分析研究掺入比例对于复原乳N、复原乳A、复原乳Y共3项的差异性,结果表明,不同比例样本对于糠氨酸含量均呈现出显著性差异(p<0.05),表明3种品牌的奶粉溶解制成的复原乳,掺入比例达到5%,即与常规巴氏杀菌乳有显著不同,能够辨别出在加工过程中加入复原乳。
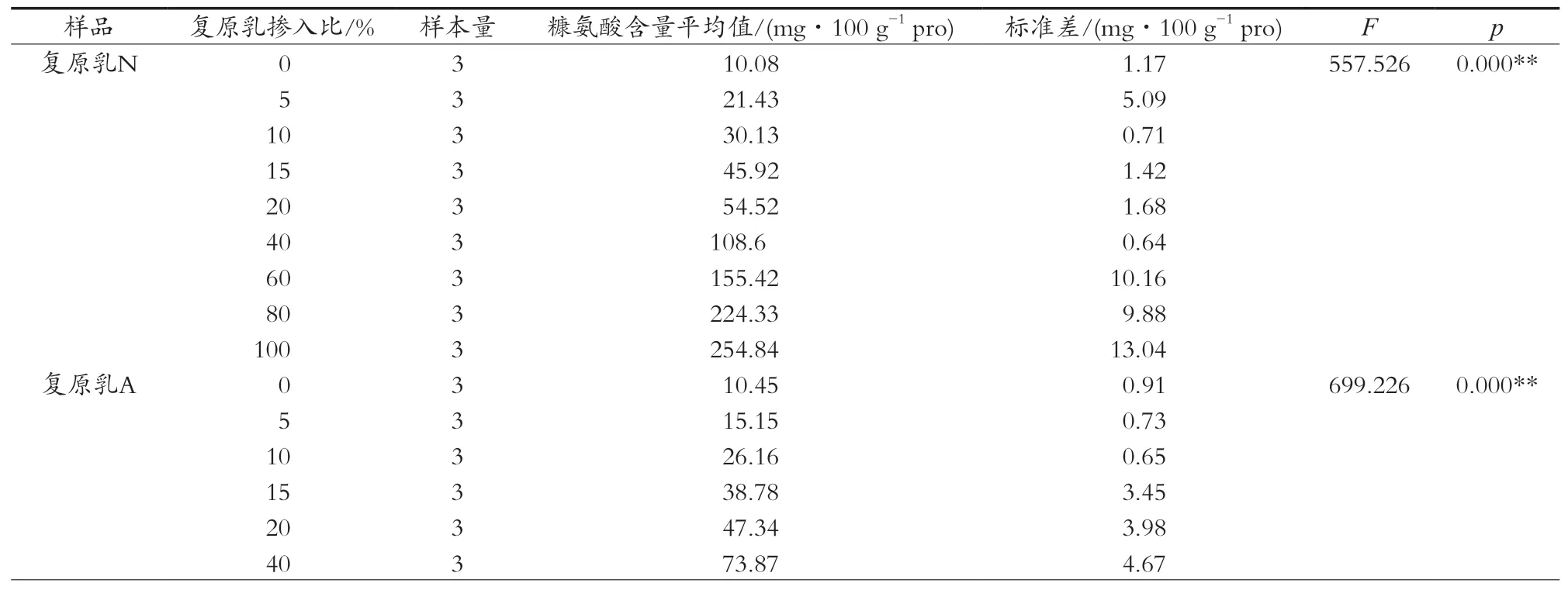
表3 糠氨酸含量方差分析
牛奶在乳制品工业中经过热处理,以确保微生物安全和延长保质期。不同类型的热处理可以影响牛奶的感官、理化性质和营养品质[19]。试验对生鲜乳巴氏杀菌掺入复原乳的情况进行研究,得到掺入5%复原乳即与生鲜乳有不同结果;生鲜乳的超高温灭菌程度要高于巴氏杀菌,如改变杀菌条件,测定其各掺入比例点的糠氨酸含量,可能得到斜率更低的样品回归曲线,使得复原乳掺入的低比例点相互之间的差异性降低。

接表3
3 结论
通过对比液质联用法和超高效液相色谱法测定牛奶中糠氨酸含量,对液质联用法测定糠氨酸含量的稳定性进行确认。生鲜乳经由不同品牌奶粉溶解成的复原乳按照不同比例掺入后进行巴氏杀菌加热,测定糠氨酸含量。结果表明,随着掺入复原乳比例增大,其糠氨酸含量呈线性增长趋势;3种复原乳在掺入5%后,巴氏杀菌乳的糠氨酸含量均有显著提高。因此应用试验所述的液质联用法测定巴杀奶中的糠氨酸,最低能辨别到5%的复原乳添加量,为巴氏杀菌乳中复原乳的分析提供方法。

