气相色谱-氮化学发光检测器测定土壤中嗪草酮残留的方法研究
李鑫圆 吕 平 邓志华 仇玉萍 郑 毅,4 孙仕仙
(1. 西南林业大学生态与环境学院,云南 昆明 650233;2. 昆明海关技术中心,云南 昆明 650228;3. 西南林业大学国家高原湿地研究中心/湿地学院,云南 昆明 650233;4. 云南开放大学乡村振兴学院,云南 昆明 650223)
嗪草酮,又称赛克津,属三嗪类除草剂,是预防粮谷和豆类等旱田作物领域杂草生长的高效选择性除草剂[1-2]。据统计,2016年嗪草酮在马铃薯、大豆和甘蔗作物上的销售额占到了总市场的35%[3]。残留在生物环境中的嗪草酮因其结构上具有3个碳和3个氮对称排列的六元环结构(均三氮苯环结构),不易被微生物降解,很容易造成土壤环境污染[4-5]。土壤是最大的有机污染物仓库,这些污染物会通过径流进入到土壤深处和水环境中,通过食物链威胁生态环境和人类健康[6]。嗪草酮被世界自然基金会认定为环境内分泌干扰物,能够对生物或人体的生殖、神经和免疫系统造成功能损伤,由此可见,环境中嗪草酮的残留测定方法研究是保障食品安全的重点问题。目前,嗪草酮残留分析方法主要有气相色谱法(GC)、液相色谱法(LC)及色谱-质谱联用技术(GC/LC-MS)。因质谱具有很高的灵敏度和选择性,已在国标和农残检测研究中广泛使用[7-11]。除质谱外,气相色谱仪常根据所测物质的不同类别而与不同的检测器联用,常见用于嗪草酮残留检测的有电子捕获器(ECD)[12]和氮磷检测器(NPD)[13]。
氮化学发光检测器(NCD)是利用检测样品中氮化合物和臭氧产生的发光反应,来检测样品中的氮含量,从而对样品进行定量的检测器。在复杂的基质条件下,NCD对有机氮化合物产生等摩尔的线性响应,不会受到样品中其他化合物的干扰。现阶段NCD检测器的应用还只存在于对胺、硝基化合物、吡啶和喹啉合成物原材料或中间体等有机氮化合物的检测[14-20],将NCD检测器应用于有机污染物农药类残留的检测还屈指可数[21-22]。例如向章敏等采用GC-NCD建立了快速测定鲜烟叶中苦参碱的测定方法,并利用建立的方法进行了消解动态田间试验;Sun等建立了用GC-NCD测定水溶液和香根草植物体内扑草净的方法,说明GC-NCD在分析环境中的痕量含氮农药存在巨大潜力[22]。现阶段对嗪草酮残留检测方法的研究主要集中于农产品[23-27]、蔬果[4,28]以及水环境样品[29-32],包括土壤环境样品在内,都需经过复杂的净化处理过程,来排除基质样品对其响应的干扰。本研究在综合考虑土壤基质存在吸附作用和物理化学吸收作用的前提下,选择V(乙腈)∶V(水)=3∶1作为提取剂,配合考虑基质效应,无需净化处理,结合气相色谱-氮化学发光检测器(GC-NCD)进行残留测定。以期在现有分析方法的基础上,建立一种高效、高灵敏度、成本较低的除草剂嗪草酮检测方法,为环境中嗪草酮的检测提供更便捷的方法。
1 材料与方法
1.1 仪器与试剂
1.1.1 仪器设备
Agilent7890A气相色谱仪(美国Agilent公司),配有Agilent255氮化学发光检测器(Nitrogen chemiluminescence detector,NCD)(美国Agilent公司),7683B进样器(美国Agilent公司),SG8200HDT超声波清洗器(上海冠特超声仪器有限公司),TS-211C恒温摇床(上海天呈实验仪器制造有限公司),Eppendorf AG高速冷冻离心机,HB10 S96水浴旋转蒸发仪(IKA公司)。
1.1.2 标准物质和试剂
嗪草酮标准品(纯度99.8%,上海泰坦科技有限公司),甲醇(色谱纯,德国默克公司),乙腈、无水MgSO4、无水Na2SO4和氯化钠(分析纯,天津市风船化学试剂科技有限公司)。
1.2 标准溶液的配制
将购买的嗪草酮农药标准品,用甲醇溶解并定容制取浓度为1 000 mg/L的嗪草酮农药标准储备液,试验时再用甲醇逐级稀释制取不同梯度的嗪草酮系列标准溶液,其浓度分别为:2.0、0.5、0.1、0.05 mg/L和0.01 mg/L,储存于-18 ℃冰箱备用。
1.3 样品前处理
1.3.1 土壤样品的制备
供试的土壤样品为设施土,土壤样品采集自晋宁区大沟尾村,该区域大量种植无公害蔬菜,海拔2 200~2 648 m,为红壤性地带,局部为黄棕壤。经测定,土壤理化性质为:含水量28.37%,土壤有机质含量3.82%,pH为7.64,阳离子交换量(CEC)为21.02 cmol/kg。
采集的土壤样品风干后去除树枝、腐叶和石子等杂物,经研碎后过孔径0.25 mm(65目)筛,密封袋中保存备用。
1.3.2土壤样品的处理
准确称取5.0 g待测土壤样品(精确至 0.01 g),置于50 mL塑料离心管中,加入4 mL超纯水浸润15 min后加入12 mL乙腈,59 kHz高频超声提取20 min(清洗池内放入生物冰袋),向离心管中加入2.5 g NaCl振荡混匀,以6 000 r/min离心6 min,将上清液经无水Na2SO4与无水MgSO4混合填充的漏斗过滤至旋转蒸发瓶内;向离心管内加入10 mL乙腈重复萃取一次,合并提取液后将旋转蒸发瓶置于40 ℃水浴蒸发仪中旋转蒸发至干,用5 mL甲醇分两次润洗蒸发瓶,使用连接有0.45 μm有机相滤膜的一次性注射器将润洗液转移至2 mL棕色进样瓶,待测。
1.4 仪器工作条件
色谱条件:Agilent7890A气相色谱仪,Agilent HP-5MS石 英 毛 细 管 柱(30 m×0.32 mm×0.25 μm,长×直径×壁厚),载气为N2(纯度≥99.999%),分流模式为不分流,进样口温度280 ℃,进样量为1 μL,柱流速1 mL/min,柱温40 ℃保持2 min,25 ℃/min升温至200 ℃,保持8 min,共运行时间为16.4 min,检测器温度为328 ℃。
氮化学发光检测器(NCD)条件:等离子炬的裂解温度为1 000 ℃,氧气流量为10 mL/min,氢气流量为4 mL/min。
1.5 基质效应
将空白土壤样品按照“1.3.2”节方法进行前处理,用其提取液作为基质溶液,配制系列基质匹配标准溶液。取基质匹配标准溶液与溶剂标准溶液,分别按照“1.4”节的仪器工作条件进样测定。以质量浓度为横坐标、峰面积为纵坐标,分别绘制基质匹配标准曲线和溶剂标准曲线。
2 结果与分析
2.1 土壤样品的工艺条件优化
在前期实验中,使用纯乙腈进行目标物提取时,由于无法将样品完全浸润,目标物的回收率为60%~70%。当尝试加水浸润时,回收率略有提高,这是因为添加的水可与三嗪类化合物竞争形成氢键从而阻碍目标物与土壤胶体和腐殖酸的亲水区形成氢键作用[13]。因此,实验要求必须使添加的水和农药可以完全浸润土壤,又不能过量添加,增加后期除水难度。通过优化乙腈和水的配比,最终确定采用混合液V(乙腈)∶V(水)为3∶1进行提取,从而获得理想提取效果。
现阶段研究已逐渐将超声波辅助提取替代耗时较长的振荡提取法,在使用超声波批量处理样品时,超声池温度过高会影响目标物的稳定性,从而影响回收率。因此,本实验中使用恒温摇床对样品进行恒温提取,与超声波辅助提取进行提取效果比较,结果表明:使用摇床和超声波辅助提取都可以在一定时间内达到提取效果,但是超声波辅助提取达到良好提取效果所需时间更短,在短时间内就能完成所有样品的提取。为防止超声提取过程中温度过高而影响目标物的稳定性,在超声池中加入生物冰袋,进行人为降温,从而避免了上述问题的再次发生。
三嗪类除草剂属于中等弱极性农药,应选择极性中等及以上的提取溶剂进行提取。乙腈极性较强,作为通用性强的提取溶剂,对目标物溶解度大,可在一定程度上节约提取溶剂的使用量;且共提取杂质少,不会干扰目标物的响应。此外还需注意盐析剂和脱水剂的添加量,所有经过匀浆提取的样品都应加入适量盐析剂,将提取溶剂完全脱离水相,使待测样品达到完全脱水状态。本实验在提取时通过优化改进盐析剂、脱水剂的添加量和过滤方法,帮助乙腈与水有效分离,防止样品中水分及干扰成分进入提取液,从而达到理想的提取效果[33]。
2.2 色谱条件和升温程序
色谱条件的优化对分析物的峰形和灵敏度有很大影响,因此了解待测物质的物理属性,选择合适的色谱柱和建立准确的升温程序既是气相色谱分析的核心,又是物质精确检出的关键所在。
本实验中的嗪草酮属于中等极性农药,因此选择Agilent HP-5MS石英毛细管柱来进行色谱分析。众所周知,提高进样量可以直接增大仪器对目标物的响应值。气相色谱的进样量基本在1~2 μL之间,但如果不考虑目标物和进样溶剂的气化膨胀体积,盲目提高至2 μL很可能会造成衬管污染,并直接影响目标物定量分析。综合考虑在1~2 μL进样条件下的定量结果,选择1 μL进样量。
此外,升温程序参数设置也是影响色谱图待测物质出峰时间和峰形的关键所在,本实验尝试了5、15 ℃/min和25 ℃/min 3种情况下的色谱图出峰情况。三种情况下都可出峰,但考虑到进样运行时间过长影响实验效率,经过优化参数,将程序设置为柱温40 ℃保持2 min,25 ℃/min升温至200 ℃,保持8 min,共运行时间为16.4 min,可保证色谱图的良好出峰和精确定量。
2.3 检测器对嗪草酮的响应及参数优化
氮化学发光检测器(NCD)依靠“化学发光反应”具有独特的选择原理,检测器天生就具有很强的选择性。它与硫化学发光检测器(SCD)依靠专利双等离子体检测技术实现了对氮和硫的灵敏效能,常被用于检测石油、汽油和柴油等基质中的硫/氮分析物[14]。
NCD检测器的检测原理可以解释为:气相色谱柱流出物进入双等离子体燃烧室,燃烧室中氢和氧的等离子体将所有氮化合物转化成一氧化氮。一氧化氮进一步与臭氧反应生成激发态的二氧化氮,化学反应式为:R-N+O2→NO+CO2+H2O;NO+O3→NO2+O2+hγ[34]。激发态的二氧化氮回到基态时,在红外区(600~3 200 nm)发出光,红色的光学滤波器可使氮化学发光反应产生的光通过,光的强度与样品中氮化合物的量成正比。
本实验对检测器的裂解温度和氢气氧气流量都进行了优化,裂解温度的高低可以影响仪器对目标物的响应情况。在925 ℃和975 ℃的情况下,色谱峰会出现严重拖尾,影响定量,但温度过高,又会导致基线不稳,最终确定在1 000 ℃时可以达到最佳状态。在对氢气和氧气流量进行调节时发现,流量过小会导致响应值偏低,而过大会导致基线不稳和噪音值增大,通过优化发现氧气流量为10 mL/min,氢气流量为4 mL/min时可得到良好响应效果。
2.4 色谱分析
嗪草酮标准溶液色谱图见图1,土壤空白基质样品及样品加标色谱图见图2,色谱图表明,在嗪草酮标准组分出峰处无明显的干扰杂峰,说明本方法的色谱条件及前处理条件选择合适。

图1 2.0 mg/L(a)和0.05 mg/L(b)嗪草酮标准溶液色谱Fig. 1 Gas chromatogram of 2.0 mg/L(a) and 0.05 mg/L(b) metribuzin standard solution
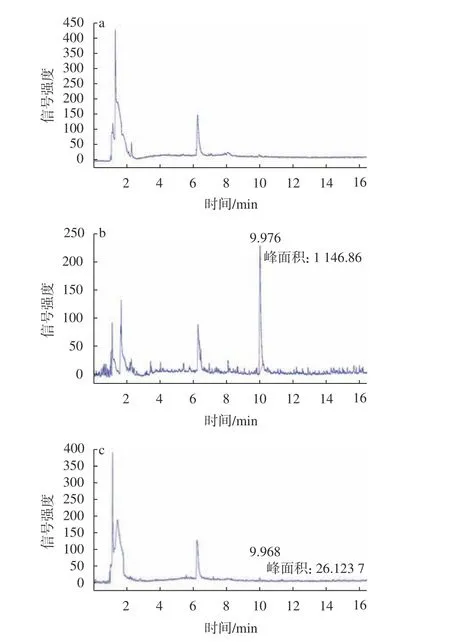
图2 土壤空白基质样品(a)、2.0 mg/kg(b)和0.01 mg/kg(c)加标样品的色谱Fig. 2 Gas chromatograms of a blank soil matrix sample(a), 2.0 mg/kg(b) and 0.01 mg/kg(c) spiked sample
2.5 标准曲线与线性范围
取配制好的嗪草酮系列溶剂标准溶液和基质匹配标准溶液,在建立好的仪器工作条件下进行GC-NCD测定,每个浓度平行测定3次,采用外标法峰面积定量。以标准品的质量浓度(x)为横坐标、峰面积响应值(y)为纵坐标进行线性回归。结果表明,嗪草酮质量浓度(x)在0.01~2.0 mg/L范围内与峰面积(y)呈良好的线性关系,在溶剂甲醇中的线性回归方程为y=397.22x+4.349 9,相关系数为0.999 4;在土壤中的线性回归方程为y=573x+3.055,相关系数为0.999 9。
2.6 基质效应
在采用色谱仪器进行农药残留分析时,有些样品存在的基质效应会影响提取液中某些待测物信号的强度,从而影响实验的准确定量。本实验参考现有的基质效应测定方法,采用基质匹配标准曲线和溶剂标准曲线的斜率之比(k)来评价基质效应:当k=1时,表示不存在基质效应;当0.9<k<1.1时,基质效应不明显;当k>1.1时,表现为基质增强效应;当k<0.9时,表现为基质减弱效应;若k>1.5或<0.5时,则表现为强烈的基质增强或抑制效应。根据“2.5”节的结果计算得出嗪草酮的k值为1.44,说明在本实验条件下,基质效应对定量结果有增强的影响。可能是由于不经过净化处理,导致含基质共提物无法避免,会对检测器NCD的定量有一定的影响,因此,使用外标法基质匹配标准曲线定量来消除基质效应造成的影响。
2.7 检出限和定量限
2.7.1 仪器检出限和定量限
根据IUPAC对检出限和定量限的定义[35],C1=3·Sd/k,C2=10·Sd/k,其中,C1和C2分别为检出限和定量限(浓度),Sd为多次空白试验的标准偏差,k为浓度和响应信号曲线的斜率。将Sd=0.075 8,k=397.22带入上式,C1=0.000 6 mg/L,C2=0.002 mg/L。
2.7.2 方法检出限和定量限
所建立方法的检测限,用基质空白所产生的仪器背景信号的3倍定义方法的检出限(LOD),该方法的检出限为0.006 mg/kg,用最低添加浓度定义方法的定量限(LOQ),该方法的定量限为0.05 mg/kg。
2.8 方法回收率实验
在相同的实验条件下,对空白土壤样品进行加标回收实验,将土壤样品平均分为15份,添加3个浓度水平的标准溶液,每个浓度重复5次,经过相同的前处理过程,计算加标回收率和精密度。结果显示,在0.5、0.1 mg/kg和0.05 mg/kg三个添加水平下,平均回收率为105%、116%和90%;5次测定的相对标准偏差(RSD)为2.38%、3.92%和7.76%。
2.9 方法比较
将本方法与现行行业标准方法[36]进行比较,实验使用Thermo scientific TRACE1310气相色谱配有ISQ Mass Spectrometer单四极杆气质联用仪(GC-MS)作为方法比较的检测仪器。
2.9.1 色谱和质谱仪器条件
基于嗪草酮为中等弱极性农药,选择类似于HP-5MS的TG-5MS石英毛细管色谱柱作为气相色谱柱,采用全扫描模式(扫描范围为45~350m/z)和选择离子监测模式(SIM),通过监测离子82m/z、89m/z、103m/z、198m/z、214m/z,对嗪草酮标准溶液进行定量测定,建立嗪草酮的定量分析方法。可得到10.0 mg/L嗪草酮标准溶液总离子流图及目标物保留时间(图3)、目标物全扫描质谱图(图4)以及0.05 mg/L嗪草酮标准溶液定性离子扫描色谱图(图5)。
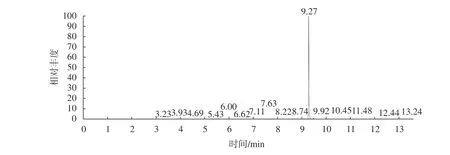
图3 10.0 mg/L嗪草酮标准溶液总离子流图及目标保留时间Fig. 3 Total ion current chromatograph and retention time of 10.0 mg/L metribuzin standards

图4 目标物全扫描质谱图Fig. 4 Ions chromatogram for prometryn in full scan mode

图5 0.05 mg/kg加标样品定性离子扫描色谱图Fig. 5 Characteristic ions chromatograph of 0.05 mg/kg spiked sample
2.9.2数据结果比较
采用10.0、5.0、2.0、0.5、0.1 mg/L和0.05 mg/L的梯度标准溶液和基质匹配标准溶液进行定量实验。最终得到y=97.754x-8.105 7的标准溶液线性回归方程,相关系数为0.999 和y=152.38x-31.385的基质匹配标准曲线回归方程,相关系数为0.996 7。采用“2.6”节的基质效应测定方法,得到k值为1.56。采用“2.8”节中所述的实验方法计算检出限和定量限,方法的检出限0.006 mg/kg,定量限为0.05 mg/kg。
采用“1.3.2”节中所述的实验方法进行相同的前处理后,并参照“2.9”节中的实验方法进行完全相同的回收率实验。结果显示:在0.5、0.1 mg/kg和0.05 mg/kg 3个添加水平下,平均回收率为110%、84.6%和110%;5次测定的相对标准偏差(RSD)为5.06%、0.96%和1.14%。
3 结论与讨论
本研究将氮化学发光检测器(NCD)作为实验气相色谱分析仪器,依靠检测器(NCD)的“化学发光反应”原理,建立了一种测定土壤中嗪草酮的研究方法。本实验的方法学验证表明该仪器可以灵敏地捕捉氮化合物转化为的氮化学发光元素,而很少受到基质中其他碳氢化合物的干扰。通过对裂解温度和氢气氧气流量参数的改进优化,使NCD检测器在农药残留检测领域得到了更广泛的技术前景。
本研究将优化后的实验方法与气相色谱-质谱(GC-MS)进行方法的基质效应比较,两种检测器所产生的基质效应值(k)为1.0~1.5,表现为弱基质增强效应,高选择性的质谱检测器在同等实验条件下的抗基质干扰程度并不优于NCD检测器,说明除了检测器会受到干扰以外,气相色谱进样系统端也会受到基质的影响,在样品定量检测中应使用外标法基质匹配标准曲线定量来消除气相色谱中所受到的基质干扰。
综合上述结果表明,土壤样品经乙腈/水混合溶液提取,采用NCD作为检测器,无需复杂且成本昂贵的净化过程,所得色谱图在嗪草酮标准组分出峰处无明显的干扰杂峰,实验结果低于国家制定的MRL值(最大残留限量标准),方法的准确度、精密度和灵敏度较高,且使用的有机溶剂种类、用量较少,能满足土壤环境中嗪草酮残留测定的要求,分析结果达到环境中农药检测的国家标准。
气相色谱-氮化学发光检测器(GC-NCD)可用于土壤介质中除草剂嗪草酮的残留检测,采用V(乙腈)∶V(水)为3∶1提取,氯化钠作为盐析剂,超声离心提取。方法的回收率为90%~116%,RSD值为2.38%~7.76%,LOD和LOQ值分别为0.006 mg/kg和0.05 mg/kg,该方法高效且成本低廉,可为嗪草酮在土壤环境中残留检测提供新的方法参考。

