绢纺精炼液中丝胶蛋白的二级结构和起泡性能探究
王志强 张慧华
(1.南阳市经济作物技术推广站,河南南阳 473000;2.河南民兴生物科技股份有限公司,河南社旗 473300 )
丝胶是包覆在丝素外层的蛋白质,主要起保护丝素和胶黏的作用[1]。因丝胶具有良好的水溶性[2],因此传统绢纺行业中丝胶通常会被去除。蚕丝在高温碱性条件下可以去除绝大部分的丝胶,而丝胶中主要成分为蛋白质,也含有少量的碳水化合物、脂类及色素。丝绸绢纺厂去除丝胶的过程称为精炼,精炼液中含有浓度极高的丝胶蛋白,而以往精炼液都会被排放至污水处理站加以处理,这一方面给污水处理带来严峻的压力,另一方面丝胶作为天然的自然资源未得到利用。近年来,从丝绸绢纺精炼液中提取丝胶蛋白的技术已取得显著成果,如有酸析法、化学混凝法、有机溶剂沉淀法、膜过滤技术[3-4]等。丝胶蛋白是一种球状蛋白质,具有良好的吸湿性[7],张雨清等报道的丝胶的抗氧化能力可与维生素C相媲美[8],日本学者研究发现丝胶蛋白可作为一种新型的非离子表面活性剂[9],饶建伟等人将丝胶、丝素混合制备成丝混合物,再引入制孔剂制备丝蛋白骨架[13],现阶段对从绢纺精炼液中提取回收的丝胶蛋白的结构鲜有报道,本文旨在探究从绢纺精炼液中回收的丝胶蛋白的结构和起泡性,为丝胶蛋白进一步开发应用提供理论参考。
1 材料与方法
1.1 试验材料
1.1.1 供试材料
绢纺精炼液,取自河南民兴生物科技股份有限公司的蚕桑条吐脱胶工艺池,丝胶蛋白质量体积浓度0.87 mg/mL。
1.1.2 主要试剂
氢氧化钠、碳酸钠、柠檬酸三钠、浓盐酸、尿素、精氨酸,国药试剂,均为分析纯;BCA蛋白定量试剂盒,北京普利莱基因技术有限公司产品;1-苯胺-8-萘磺酸,国药试剂,为色谱纯;溴化钾、三氯乙酸、异硫氰酸苯酯、三乙胺,均为分析纯,美国 Sigma公司产品。
1.1.3 主要仪器
0.5 m2陶瓷膜(孔径200 nm)、36 m2有机膜(8 000 Da),购自江苏久五高科技股份有限公司;LPG-5型高速离心喷雾干燥机,购自常州异能干燥设备有限公司;WT600-1F型蠕动泵,购自保定兰格恒流泵有限公司;恒温水浴锅,购自浙江力辰仪器科技有限公司;PHS-3E型pH计,购自上海雷磁科技有限公司;超纯水机,购自德国PURELAB公司;凯式定氮仪,购自上海精密科学仪器有限公司;酶标仪、电动移液器、移液枪,购自美国Thermo公司;万分之一电子天平,购自上海恒平科学仪器有限公司。
1.2 试验方法
1.2.1 丝胶蛋白提取回收
将绢纺精炼液(丝胶蛋白质量体积浓度0.87 mg/mL)首先经过预处理出渣和采用截留分子量为400 000 Da(蛋白分子量的计量单位)的超滤膜精出渣,能完全去除丝胶废液中残渣,其次采用截留分子量为400 000 Da的超滤膜截留分子量400 000 Da以上的丝胶蛋白(液体),而400 000 Da以下的丝胶蛋白则透过超滤膜,最后再用截留分子量为8 000 Da的纳滤膜浓缩截留分子量为400 000 Da的渗透液,渗透液洗涤纯化后再经高速离心喷雾干燥得到分子量为8 000~400 000 Da的丝胶蛋白粉(固体)。丝胶蛋白粉中蛋白质含量的测定采用凯氏定氮法,具体操作参照GB 5009.5-2016。
1.2.2 圆二色谱分析
在蛋白质的规则二级结构中,肽键是高度有规律排列的,根据不同蛋白质或者多肽产生的CD谱带的位置的变化和产生峰的强弱程度,可以获取蛋白质二级结构的相关信息。首先将丝胶蛋白用磷酸盐缓冲液配制为质量体积浓度为0.20 mg/mL的蛋白溶液。因丝胶蛋白为球状蛋白质,因此用圆二色谱仪分别检测其在180~220 nm和在200~240 nm处的紫外峰。具体操作如下:取300 μL 0.20 mg/mL的丝胶蛋白样品溶液,选择光径为 0.2 cm的石英杯,调整仪器扫描速率至170 nm/min和1.0 s响应时间,上机扫描2~3次,得到丝胶蛋白CD图谱。既可以分析出丝胶蛋白二级结构中无规卷曲、α-螺旋、β-折叠和β-转角的具体含量。
1.2.3 傅立叶红外光谱分析
红外光谱是测定蛋白质二级结构相对含量的重要手段之一。蛋白质在红外光谱中有很多特征吸收峰,其中酰胺Ⅰ带(1 600~1 700/cm),包括了蛋白质的二级结构信息(无规卷曲、α-螺旋、β-折叠和β-转角等),因此酰胺Ⅰ带常用来解析蛋白质的二级结构。首先对样品进行压片处理,具体操作如下:将200 mg KBr和2 mg丝胶蛋白分别置于鼓风干燥箱中,100 ℃干燥1.5 h,取出混合均匀后,再置于研钵中将二者充分研磨至大小为1~2 μm的颗粒,必要时可要用100目滤网进行过滤以保证颗粒大小均一,最后在进行压片处理。通过傅里叶红外光谱仪在4 000~400/cm处进行全波段扫描,分辨率4/cm,扫描33次。用200 mg干燥后的KBr进行同样操作,做KBr阳性对照。
1.2.4 丝胶蛋白的起泡性及起泡稳定性
探究在pH和温度恒定条件下丝胶蛋白的起泡能力和起泡稳定性。具体操作如下:配置不同质量分数(0.5%、1.0%、1.5%、3.0%、5.0%)的丝胶蛋白溶液,调节丝胶蛋白溶液pH至7.0,取上述不同质量分数丝胶蛋白溶液40.0 mL于100 mL烧杯中,并置于恒温套筒中,调节恒温套筒温度至25 ℃,用高速分散机经行剪切,剪切速度10 000 r/min,保持3 min,记录剪切后的泡沫液面高度,静置30 min后再次记录泡沫液面高度,具体计算过程参考文献[16]。试验以大豆分离蛋白为阳性对照探讨丝胶蛋白的起泡能力和起泡稳定性。
2 结果与分析
2.1 丝胶蛋白的蛋白质含量
按照GB 5009.5-2016中蛋白质含量第一种检测方法,得到丝胶蛋白粉中蛋白质含量为92.4%。
2.2 圆二色谱分析丝胶蛋白二级结构
参照丝胶蛋白的圆二色谱图并利用CDNN软件预测丝胶蛋白二级结构中的α-螺旋、β-折叠、β-转角和无规卷曲所占的摩尔百分比。分析结果得出:丝胶蛋白在180~260 nm范围的紫外区内有一较弱的吸收峰,说明丝胶蛋白的二级结构中含有少量的α-螺旋,傅立叶红外光谱分析丝胶蛋白中α-螺旋结构所占的摩尔百分比仅为3.9 %。另外,由于丝胶蛋白是一种球状蛋白质,而球状蛋白质结构中含有β-转角和β-折叠是其典型特征表现,这种构象使得丝胶蛋白分子中的多肽链反相折叠,同时这两种结构的存在促使了丝胶蛋白球状结构的形成。
2.3 傅立叶红外光谱分析丝胶蛋白
依据蛋白质的二级结构红外光谱特征谱带中1 650~1 660 /cm处谱峰是由酰胺Ⅰ C-O伸缩振动形成的,1 530 /cm处谱峰为酰胺Ⅱ C-N伸缩振动和N-H面内变形振动形成的[9-10]。分析结果可以看出:丝胶蛋白在1 633 /cm和1 239 /cm处有明显的吸收峰,表明丝胶蛋白中含有β-折叠结构;在1 693 /cm和1 270 /cm处有正吸收峰出现,表明丝胶蛋白中含有β-转角;在1 663 /cm和1 303 /cm处有较弱的吸收峰出现,表明丝胶蛋白中含有少量的α-螺旋结构;在1 637~1 648 /cm之间有强烈的吸收峰出现,说明丝胶蛋白二级结构中含有大量的无规卷曲。具体含量见表1。
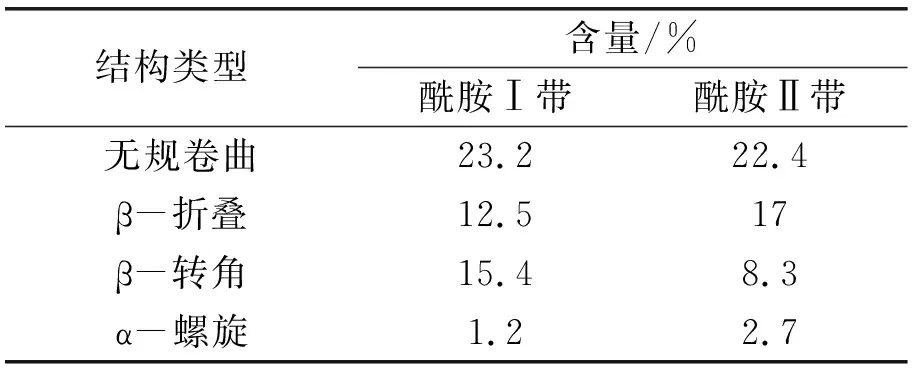
表1 丝胶蛋白的二级结构占比
2.4 不同浓度丝胶蛋白的乳化性及乳化稳定性
对于在pH和温度恒定条件下丝胶蛋白的起泡能力和起泡稳定性,分析计算的结果,当丝胶蛋白在质量分数为0.5%时,其乳化性只有15.49 m2/g,乳化稳定性为12.22 m2/g;当丝胶蛋白质量分数升至3.0 %时,丝胶蛋白的乳化性为为22.00 m2/g ,乳化稳定性为15.80 m2/g;当丝胶蛋白质量分数在5%时,期乳化性和乳化稳定性分别为21.89 m2/g和16.20 m2/g。说明在pH和温度恒定的条件下随着丝胶蛋白质量分数的提高,其乳化性和乳化稳定性也随之增强。以大豆分离蛋白(SPI)为阳性对照,在相同的蛋白质浓度情况下,丝胶蛋白的乳化性明显优于SPI。大豆分离蛋白以作为良好的食品添加剂而得到广泛认可,如其加入到面包、奶制品等食品中,可使产品状态保持蓬松且稳定的产品相态。因此实验结果表明,在pH和温度恒定条件下,丝胶蛋白的乳化性均优于SPI,丝胶蛋白具有作为新型乳化剂的潜质。
3 小结与讨论
本文通过膜过滤技术从绢纺精炼液提取回收丝胶蛋白,该技术方法丝胶回收率高,提取过程中零添加,且得到的丝胶蛋白分子量范围较小,有利于丝胶产品的开发。利用圆二色谱仪和红外光谱仪对丝胶蛋白的二级结构进行分析,发现丝胶蛋白的二级结构以无规卷曲为主,约占总量的45.6%,并含有部分β构象(β-折叠和β-转角,约占29.5%、23.7%),含少量的α螺旋结构,约占总量的3.9%。丝胶蛋白的乳化性优于SPI,为丝胶蛋白的进一步开发利用提供了理论参考。因此,绢纺精炼液中丝胶蛋白的提取、研究、开发应用不仅可以达到节能减排的环境保护目的,还可以变废为宝,具有很好的经济效益和生态效益。

